Au cours de l’évolution, la structure des chromosomes évolue sous l’effet de réarrangements chromosomiques, tels que délétions, duplications, fusion de chromosomes, translocation et inversions. Quand on compare chez différentes espèces l’arrangement relatif des gènes, il est frappant de voir que celui-ci est parfois extrêmement conservé et forme de grands blocs de synténie. Plusieurs études chez les mammifères ainsi que chez d’autres espèces ont montré que les gènes adjacents sont souvent co-exprimés, suggérant un lien fonctionnel entre activité transcriptionnelle et organisation du génome [ 1].
Un tel lien est illustré de manière extrême par les gènes homéotiques (Hox). Ces gènes codent des facteurs de transcription à homéoboîte qui contrôlent l’identification des structures le long de l’axe antéro-postérieur de l’embryon [ 2]. Cette fonction, cruciale pour la morphogenèse de l’embryon, est intimement liée à la répartition de ces gènes le long des chromosomes. Ils sont en effet regroupés en clusters (complexes) et leur profil d’expression est colinéaire à leur position au sein du complexe. Cette organisation a été extrêmement conservée au cours de l’évolution (avec toutefois quelques exceptions [ 3]) et, chez les vertebrés, 9 à 11 gènes Hox sont regroupés dans des régions d’à peu près 100 kb. Il est communément accepté que l’organisation particulière des gènes Hox joue un rôle crucial pour coordonner leur expression le long de l’axe antéro-postérieur dans l’espace, mais surtout dans le temps, ainsi que dans d’autres domaines d’expression acquis plus tard au cours de l’évolution, comme le tube diges tif, ou les membres et le système urogénital [ 4]. Cependant, les mécanismes associés ne sont pas encore précisément connus.
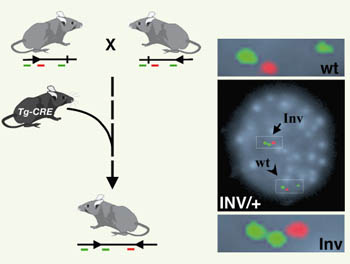
Afin de tester directement l’importance du clustering pour les gènes Hox, de localiser les enhancers associés à leurs domaines d’expression et de mieux comprendre les mécanismes impliqués dans la colinéarité axiale de ces gènes, nous avons décidé de séparer un des quatre complexes Hox que comporte la souris en deux morceaux indépendants, par le biais d’une inversion chromosomique ciblée [ 5]. La technique utilisée en général pour produire de tels réarrangements repose sur plusieurs étapes de recombinaison homologue permettant d’introduire dans le génome de cellules ES murines des sites de reconnaissance loxP. Puis, l’expression transitoire de la recombinase CRE permet de sélectionner le réarrangement voulu entre ces sites, au terme de longues et délicates manipulations des cellules ES. Comme nous disposions déjà de souris comportant des sites loxP dans le cluster HoxD, et que des lignées comportant des sites loxP à plusieurs cM du complexe avaient été établies par d’autres groupes, nous avons opté pour une approche de recombinaison in vivo, ne nécessitant que des croisements successifs. Cette nouvelle stratégie (STRING) nous a permis, en 5 générations et après environ 500 génotypages, d’isoler une souris comportant l’inversion chromosomique de 7 cM souhaitée, entre le locus HoxD et la partie 3’ du gene Itga6 (Figure 1).
| Figure 1.
Stratégie STRING. Elle repose une succession de croisements visant à amener les sites loxP (triangle) flanquant la région d’intérêt sur un même chromosome (résultat d’un crossing-over en méiose), puis à introduire un transgène exprimant la recombinase CRE (Tg-CRE) afin d’induire la recombinaison (produisant une inversion ici) entre les sites loxP. Cette inversion peut être mise en évidence par hybridation in situ sur chromosomes en interphase à l’aide de sondes fluorescentes (vert ou rouge) correspondant à des BAC placés le long du chromosome. La séquence des signaux correspond à la disposition des sondes le long du chromosome. Dans un noyau de fibroblaste de souris hétérozygote pour l’inversion, on peut voir à la fois la séquence normale vert-rouge-vert (wt, pointe de flèche) et la séquence vert-vert-rouge correspondant à l’inversion du segment Itga6-Hoxd (Inv, flèche). |
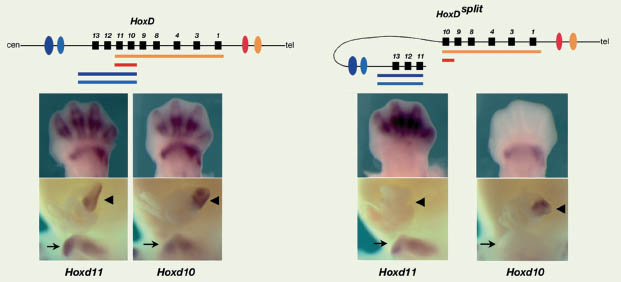
Nous avons choisi comme point de cassure la région entre les gènes Hoxd10 et Hoxd11, car ceux-ci présentent des profils d’expression très similaires et qui recouvrent la plupart des sites d’expression des gènes du complexe. Quand ce dernier est « cassé » en deux, on observe une partition de ces domaines d’expression, entre l’un ou l’autre des demicomplexes (Figure 2). Les gènes associés au demi-complexe contenant Hoxd11 conservent leur expression dans la partie distale du bourgeon de membre (l’autopode) qui formera les doigts, ainsi que dans le bourgeon génital, mais ne sont plus détectés dans la hernie intestinale ou dans la partie proximale des membres. Inversement, Hoxd10 est exprimé dans ces deux derniers domaines, mais pas dans le bourgeon génital, ni dans l’autopode. Cette ségrégation des différents domaines entre chaque demi-complexe indique que ces domaines sont déterminés par des séquences différentes, localisées soit en 5’, soit en 3’ du complexe. Nous avions précédemment montré que l’expression dans l’autopode était sous le contrôle d’une séquence appelée GCR (global control region), située à 250 kb en 5’ du complexe [ 6]. Ces nouvelles données confortent cette localisation et indiquent que l’élément contrôlant l’activité dans la partie proximale des membres est distincte du GCR, car localisé à l’autre extrémité du complexe. Incidemment, cela conforte le modèle issu de données paléontologiques qui voient dans les doigts une innovation évolutive [ 7] : les gènes Hoxd sont importants pour le développement des différentes parties du membre des tétrapodes, mais leur recrutement s’est effectué de manière indépendante pour l’autopode et le zeugopode, via des éléments régulateurs distincts.
| Figure 2.
La séparation du complexe HoxD en deux entraîne une partition des domaines d’expression. La structure du complexe est indiquée schématiquement, l’inversion cassant le complexe entre Hoxd11 et Hoxd10 sépare chaque partie par ~3 Mb. Les domaines de co-expression sont indiqués par des barres de couleur différentes. L’expression des gènes Hoxd11 et Hoxd10 est analysée par hybridation in situ. Dans un contexte normal, ces deux gènes sont co-exprimés dans des domaines distaux (autopode) et proximaux (zeugopode) des membres, dans le bourgeon génital (flèche) et dans la hernie intestinale (pointe de flèche). Après cassure du complexe, Hoxd11 est exprimé seulement dans l’autopode et le bourgeon génital, alors qu’à l’inverse Hoxd10 n’est détecté que dans l’intestin et le zeugopode. Ces expériences permettent de positionner les enhancers (ovales de couleur) associés à ces différents domaines d’expression, soit d’un côté, soit d’un autre du complexe. |
Chez les mammifères, l’expression des gènes du complexe HoxD est donc sous le contrôle d’enhancers situés en dehors et de part et d’autre du complexe, et qui définissent des domaines de régulation chevauchants. Si cette situation est sans doute apparue tardivement au cours de l’évolution des vertébrés et n’explique peut-être pas à elle seule le maintien de ces gènes en complexe, elle y a vraisemblablement contribué, comme l’indiquent les conséquences des réarrangements chromosomiques à l’intérieur du complexe (notre inversion) ou à proximité : ceux-ci se traduisent par de nombreuses anomalies du développement y compris chez l’homme, selon leur localisation en 5’ et 3’ [ 8, 9].
De manière plus générale, de nombreux syndromes humains liés à des « effets de position » associés à des réarrangements chromosomiques sont sans doute la conséquence de la séparation entre un élément régulateur et un gène parfois situé très loin du réarrangement [ 10]. L’utilisation du STRING devrait permettre de mettre à nu ces contraintes mécanistiques et de déterminer les bases fonctionnelles qui sous-tendent l’arrangement coordonné de gènes le long des chromosomes.