Les facteurs de transcription de la famille Sox (sry related HMG box) sont des acteurs majeurs du développement chez les métazoaires, en contrôlant des étapes de détermination, prolifération et différenciation cellulaire dans de nombreux tissus, parmi lesquels le système nerveux, l’intestin, les gonades, les os. Les analyses comparatives chez de nombreux organismes modèles, vertébrés et invertébrés, ont montré que les gènes Sox du groupe B (SoxNeuro et Dichaete chez la drosophile et leurs homologues vertébrés Sox1/2/3) agissaient comme des médiateurs des inducteurs neuraux précoces dans la formation des cellules souches neuronales (neuroblastes), d’une part en dirigeant les cellules de l’ectoderme vers un destin neural et, d’autre part, en maintenant ces neuroblastes dans leur état indifférencié (pour revue, voir [ 1]). Ainsi, chez la drosophile, SoxNeuro (SoxN) est requis pour la formation d’environ 70 % des neuroblastes et semble intervenir à différentes étapes de la neurogenèse embryonnaire, lors de la régionalisation dorso-ventrale du neuroectoderme (en partenariat avec les gènes à homéodomaine vnd, ind et msh, et le gène Sox Dichaete), et lors de la formation des groupes proneuraux, via la régulation de l’expression des gènes proneuraux du complexe Achaete-Scute [ 2, 3].
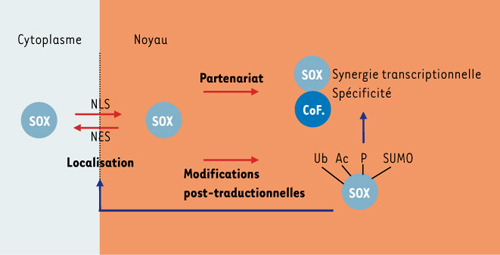
Le mécanisme d’action moléculaire des facteurs Sox repose sur leur partenariat spécifique avec d’autres facteurs de transcription se fixant sur des sites adjacents au site Sox sur l’ADN; cette association conduirait à l’élaboration de complexes nucléoprotéiques plus stables, transcriptionnellement actifs (synergie transcriptionnelle) et spécifiques de certains gènes cibles (combinatoire). La fonction des Sox est modulable à plusieurs niveaux (Figure 1): leur propriété de navigation nucléocytoplasmique permet de contrôler leur localisation subcellulaire (pour revue, voir [ 4]), leur partenariat avec d’autres facteurs de transcription dicte leur spécificité d’action, et les modifications post-traductionnelles qui les affectent régulent leur activité transcriptionnelle [ 5– 8]. Parmi ces modifications post-traductionnelles figure la SUMOylation, qui consiste en l’attachement covalent et réversible d’un polypeptide de 97 acides aminés (SUMO, small ubiquitin-like modifier) sur une lysine de la protéine cible. La diversité des substrats de la SUMOylation l’implique dans de nombreuses fonctions cellulaires, dont la transcription. En effet, tous les acteurs de la machinerie transcriptionnelle sont des substrats de la SUMOylation, et l’activité transcriptionnelle de nombreux facteurs de transcription est modulée par SUMOylation (pour revue, voir [ 9]).
| Figure 1.
Mécanisme d’action moléculaire des facteurs de transcription Sox. Après traduction, les protéines Sox entrent dans le noyau, grâce à leur signal de localisation nucléaire (NLS, nuclear localisation signal), situé dans leur domaine HMG de liaison à l’ADN. Pour certaines protéines Sox, la présence conjointe d’un signal d’extrusion nucléaire (NES, nuclear extrusion signal) leur confère la propriété de naviguer entre le noyau et le cytoplasme, et fournit ainsi un mode de contrôle de leur activité. Une fois dans le noyau, l’affinité du domaine HMG des Sox pour l’ADN est trop faible, et ce n’est que leur partenariat spécifique avec d’autres facteurs de transcription qui conduit à la formation d’un complexe nucléoprotéique stable et transcriptionnellement actif (synergie transcriptionnelle). Les protéines Sox subissent des modifications post-traductionnelles, qui agissent sur leur activité à différents niveaux, en modifiant leur affinité pour l’ADN (phosphorylation), en modulant leur activité transcriptionnelle (phosphorylation, ubiquitinylation et SUMOylation) ou encore en contrôlant leur distribution nucléo-cytoplasmique (acétylation). Ub: ubiquitinylation; AC: acétylation; P: phosphorylation; SUMO: SUMOylation. |
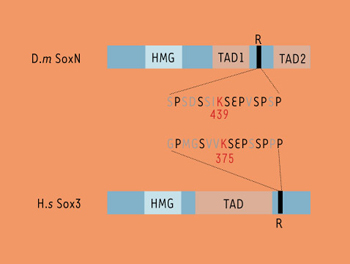
Récemment, nous avons montré [ 10], en système cellulaire hétérologue (cellules humaines HeLa) et en système cellulaire homologue (cellules S2 de drosophile), que SoxN était SUMOylé sur sa lysine K439, contenue dans un site consensus de SUMOylation de type ψKXE (où ψ est un résidu hydrophobe et K la lysine cible). Une étude structure-fonction de SoxN, réalisée en mesurant le pouvoir transactivateur de différents mutants de délétion de SoxN, nous a permis de montrer que SoxN contenait dans son extrémité carboxy-terminale deux domaines transactivateurs (TAD) séparés par une courte région contenant le motif ψKXE, capable d’inhiber en cis le pouvoir transcriptionnel de ces deux domaines transactivateurs (Figure 2). Nous avons également montré que lorsque la machinerie cellulaire de SUMOylation était partiellement inhibée (par la surexpression d’une forme dominante négative de l’enzyme E2 Ubc9 responsable de la conjugaison de SUMO), SoxN présentait une activité transcriptionnelle plus élevée. De même, une forme «non SUMOylable» de SoxN –où la lysine K439 a été mutée en arginine– présente une activité transcriptionnelle nettement supérieure à celle de la forme sauvage. Ces trois approches complémentaires montrent que la SUMOylation de la lysine K439 de SoxN réprime son activité transcriptionnelle.
| Figure 2.
Analyse structure fonction de SoxN et de Sox3. SoxN possède dans sa partie carboxy-terminale deux domaines transactivateurs (TAD) séparés par un court domaine (R), contenant le site consensus de SUMOylation et capable d’inhiber le pouvoir transactivateur des deux TAD. Sox3 possède lui aussi dans sa partie carboxy-terminale un court domaine contenant le site consensus de SUMOylation (R) capable de réprimer l’activité de son domaine transactivateur (TAD). Une comparaison de la séquence en acides aminés entre SoxN et Sox3 révèle entre eux une importante conservation de séquence au voisinage de la lysine SUMOylée (en rouge), notamment les sérines en position –3, +1 et +5 par rapport à la lysine SUMOylée. Plus particulièrement, les sérines «S + 1» et «S + 5» se situent respectivement dans des sites consensus de phosphorylation par la glycogen synthase kinase 3 (GSK3) et la mitogen activated protein kinase (MAPK) ERK1. |
La surexpression, via le système UAS-GAL4 chez la drosophile, de la forme «non SUMOylable» de SoxN (K439R) provoque de sévères altérations de l’architecture axonale de la corde neurale ventrale, alors que la surexpression de la forme sauvage de SoxN reste sans effet. Ces résultats suggèrent que la forme «non SUMOylable» de SoxN, qui échappe à la régulation de son activité transcriptionnelle par SUMOylation, est capable d’interférer avec la forme endogène de SoxN, montrant ainsi l’importance de la régulation de l’activité transcriptionnelle de SoxN par la SUMOylation de sa lysine K439 in vivo.
La SUMOylation des Sox est conservée chez les mammifères. Ainsi, Sox3, l’homologue humain de SoxN, est également la cible d’une modification par SUMO sur sa lysine K375, elle aussi contenue dans un site consensus. De manière similaire à SoxN, la SUMOylation de Sox3 [10] et de Sox9 [ 7] réprime leur activité transcriptionnelle. Par ailleurs, des protéines Sox dépourvues de site consensus de SUMOylation ne sont pas SUMOylées [10], d’où l’hypothèse selon laquelle la SUMOylation constituerait un moyen pour contrôler de façon différentielle l’activité transcriptionnelle des protéines Sox, notamment dans le cas où un même gène est la cible transcriptionnelle de différents facteurs Sox.