L’agrine est une protéine de la matrice extracellulaire, isolée à partir d’extraits de lame basale de l’organe électrique du poisson torpille Torpedo californica (Figure 1) [ 1]. A la jonction neuromusculaire (JNM), l’agrine a pour fonction physiologique principale l’agrégation des récepteurs de l’acétylcholine et de protéines associées [ 2], d’où sa dénomination issue du grec ageirein pour «assembler». Elle favorise ainsi la formation de la densité post-synaptique apposée à la terminaison axonale, et contribue à l’établissement d’une transmission nerfmuscle fonctionnelle.
Depuis sa purification en 1987, cette protéine a fait l’objet de très nombreuses études visant à caractériser son mode d’action et le rôle-clé qu’elle entretient dans le processus de maturation de la membrane post-synaptique de la JNM [ 3, 4]. La présence d’agrine dans le système nerveux central laisse supposer que cette protéine pourrait également être impliquée dans la formation et la plasticité des connexions synaptiques interneuronales [ 5]. En effet, lors du développement du système nerveux central, les pics d’expression d’agrine coïncident avec des périodes de synaptogenèse importante [ 6, 7]. Par ailleurs, dans le cerveau mature, l’expression de la protéine reste élevée dans des structures telles que l’hippocampe ou encore le cortex, qui présentent une forte plasticité synaptique [7]. De plus, le blocage de l’expression d’agrine par des oligonucléotides antisens et/ou de sa fonction par des anticorps spécifiques entraîne d’importantes perturbations de la différenciation et la transmission synaptique ainsi que de l’exocytose [ 8], confirmant ainsi un rôle de cette protéine dans la formation/maturation des synapses du système nerveux central.
Durant la période de synaptogenèse, de nombreux remaniements cellulaires et moléculaires s’opèrent, conduisant in fine à l’établissement de contacts synaptiques fonctionnels et à la formation de réseaux neuronaux. Ces remaniements s’accompagnent notamment d’un changement du mode de communication entre cellules neuronales. En effet, très tôt au cours du développement embryonnaire, et avant même qu’apparaissent les synapses, les neurones échangent des informations électriques et chimiques via des structures membranaires particulières appelées jonctions gap [ 9]. Ces structures correspondent à des canaux transmembranaires présents au niveau d’étroites appositions des membranes plasmiques de cellules adjacentes et sont à l’origine d’interactions directes entre cellules via le passage d’ions et de petites molécules entre les cellules couplées. Avec la progression de l’embryogenèse, ce couplage cellulaire médié par les jonctions gap diminue à mesure de l’établissement des contacts synaptiques [ 10], principaux supports de la propagation d’information au sein des réseaux neuronaux matures. Jusqu’à très récemment, les facteurs impliqués dans cette transition entre communication électrique jonctionnelle et transmission synaptique observée au cours de la synaptogenèse étaient inconnus. Par ailleurs, nul n’avait envisagé jusqu’ici que l’agrine puisse exercer un rôle majeur sur une voie de communication intercellulaire autre que la transmission synaptique.
Dans un article récent [ 11], nous décrivons, sur le modèle de la synapse cholinergique entre le nerf splanchnique et les cellules chromaffines de la glande médullo-surrénale, un rôle nouveau et tout à fait inattendu de la protéine agrine comme facteur essentiel impliqué dans la transition entre couplage électrique et transmission synaptique. Les cellules chromaffines de la glande médullo-surrénale sont responsables de la sécrétion de catécholamines (adrénaline, noradrénaline), hormones-clés de la réponse adaptative de l’organisme face aux variations de l’environnement. Chez le rat adulte, le stimulus d’origine centrale est convoyé aux cellules chromaffines via le nerf splanchnique. La sécrétion de catécholamines est alors principalement régulée par l’acétylcholine libérée par les terminaisons du nerf splanchnique (contrôle neurogénique). Chez le rat nouveauné, cette transmission synaptique est immature, et, de fait, le contrôle neurogénique de la libération de catécholamines n’est pas encore fonctionnel. Dans ces conditions, la communication intercellulaire par jonctions gap est prédominante et assure la propagation des informations au sein du tissu sécrétoire [ 12]. À l’image du système nerveux central, la période de synaptogenèse de la glande surrénale s’accompagne donc d’une transition entre couplage jonctionnel et couplage synaptique, ce qui fait du tissu médullo-surrénalien une préparation biologique de choix pour l’étude des mécanismes impliqués dans le remodelage physiologique des communications intercellulaires. Nos travaux ont permis d’identifier l’agrine comme acteur central de ce processus. Tandis que l’agrine n’est que faiblement détectée dans la glande médullo-surrénale à la naissance, elle est fortement exprimée au niveau des lobules de cellules chromaffines chez le rat adulte [11]. De plus, l’expression d’agrine est régulée au cours du développement selon un décours temporel qui suit la période de réduction du couplage jonctionnel et d’aquisition progressive du contrôle neurogénique via l’établissement de contacts synaptiques matures. De manière remarquable, notre étude a surtout permis de montrer que l’agrine participe aux processus de maturation physiologique des communications intercellulaires. Ainsi, une application exogène d’agrine in situ sur des tranches de glandes surrénales de rats nouveau-nés est suivie de deux effets, séquentiels et opposés sur la communication jonctionnelle et la transmission synaptique. En effet, en quelques minutes, l’agrine réduit d’environ 50 % le couplage électrique entre les cellules chromaffines, et ce via une activation de kinases de la famille src. Puis, dans l’heure qui suit, l’agrine favorise la transmission synaptique cholinergique en modifiant notamment la distribution des récepteurs nicotiniques insérés dans la synapse [11]. Il est à noter que ces changements reproduisent l’état des communications intercellulaires tel qu’il est observé chez le rat adulte.
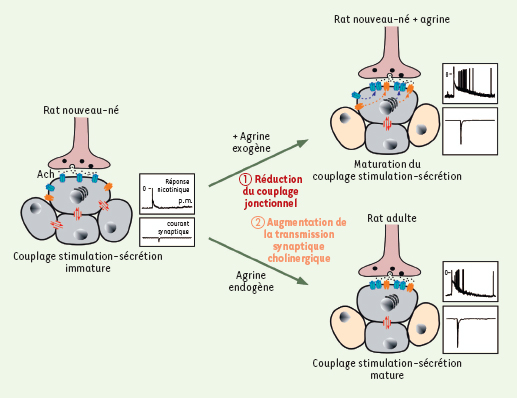
L’ensemble de cette étude permet de proposer l’hypothèse suivante. Par son action double et surtout séquentielle sur le couplage jonctionnel et la transmission synaptique, l’agrine contribue à favoriser, chez le rat nouveau-né, l’acquisition du contrôle neurogénique du couplage stimulation-sécrétionde la glande médullo-surrénale: en réduisant l’échange d’informations empruntant la voie des jonctions gap, et en induisant l’agrégation des récepteurs nicotiniques post-synaptiques, l’agrine permet aux cellules chromaffines d’être sous le contrôle principal, mais néanmoins non exclusif, des neurotransmetteurs (notamment l’acétylcholine) libérés par voie synaptique, à l’image de ce qui est observé chez l’animal adulte (Figure 2).
| Figure 2.
Effets de l’agrine sur les communications intercellulaires dans la glande surrénale de rat nouveau-né. En diminuant le couplage jonctionnel entre les cellules chromaffines puis en augmentant l’efficacité de la transmission synaptique nicotinique, l’agrine contribue fortement à la maturation du contrôle neurogénique du tissu médullo-surrénalien du rat nouveau-né qui présente alors un couplage stimulation-sécrétion comparable à celui du rat adulte. La réponse nicotinique présentée correspond à un enregistrement électrophysiologique des variations de potentiel induite par une application brève (100 ms) et localisée de nicotine, agoniste cholinergique (100 µm) au voisinage d’une cellule chromaffine. ACh: acétylcholine; pm: potentiel de membrane. |
Plus généralement, nous proposons que ce nouveau rôle de l’agrine en tant que régulateur des communications intercellulaires et particulièrement du couplage électrique jonctionnel, pourrait être étendu au système nerveux central, notamment lors du développement ou chez l’adulte lors de situations physiopathologiques associées à un remodelage des connexions synaptiques.