| |
| Med Sci (Paris). 2005 October; 21(10): 832–838. Published online 2005 October 15. doi: 10.1051/medsci/20052110832.L’ostéopontine, une molécule aux multiples facettes Dorothée Chabas*1,2 1Inserm U.546, Faculté de médecine Pitié-Salpêtrière, 105, boulevard de l’Hôpital, 75013 Paris, France ; 2Fédération des maladies du système nerveux, UPMC, AP-HP, Hôpital Pitié- Salpêtrière, 47-83, boulevard de l’Hôpital, 75013 Paris, France |
L’ostéopontine (OPN) est une molécule initialement découverte dans le cortex osseux de bœuf, par fractionnement protéique [
1,
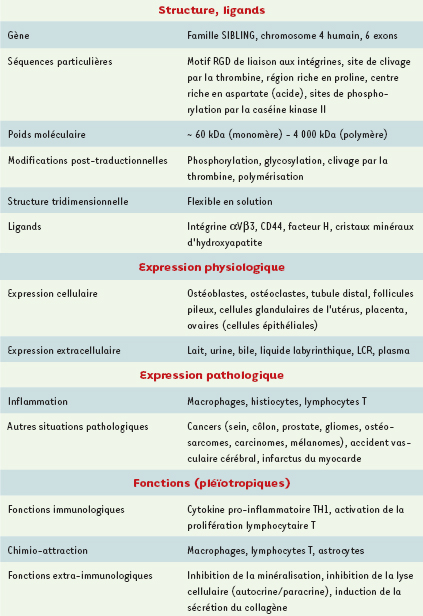
2], et considérée comme une molécule structurale faisant le lien entre les cellules osseuses et la matrice extracellulaire (ostéo : os, pontine : pont). Ses autres fonctions, notamment sur la prolifération cellulaire, la réponse aux infections et le système immunitaire ont été rapportées de façon exponentielle dans la littérature depuis une quinzaine d’années (Tableau I). Le comité officiel de nomenclature HUGO, chargé de définir les noms des gènes humains, a choisi le terme secreted phosphoprotein 1 (SPP1) pour l’OPN. Cependant, le terme le plus communément utilisé dans la littérature reste ostéopontine. Cet article tente de mettre l’accent sur la complexité de la structure et de la fonction de cette molécule, chez l’homme puis chez l’animal, et sur les implications potentielles qui en découlent en pathologie humaine. Une attention particulière sera portée sur les aspects immunologiques récemment mis en évidence, qui ont d’ailleurs valu à l’OPN le surnom d’ « interleukine-18 » et ont abouti au premier essai thérapeutique visant l’OPN chez l’animal.  | Tableau I.
Caractéristiques de l’ostéopontine (d’après [
71]). |
|
Une molécule de structure complexe L’OPN a été d’emblée identifiée par son caractère acide, avec des composants sialylés. C’est une petite molécule de structure très complexe, d’environ 60 kDa, avec des isoformes multiples correspondant à des épissages alternatifs différents, et surtout à des modifications post-traductionnelles par phosphorylation et glycosylation variables, expliquant les différents poids moléculaires apparents et les différents noms rapportés dans la littérature (sialoprotéine I, gène eta-1, 44 kDa bone pp, 2 ar, pp 69, pp 62, spp 1). L’OPN est aussi un substrat de la transglutaminase, qui permet sa polymérisation en complexes de plus de 4 000 kDa [
3,
4]. Il existe des formes intracellulaires et extracellulaires, comme dans la matrice extracellulaire de l’os et dans certains fluides (lait, urine, bile) [
5]. Enfin, il existe des formes libres et liées. L’équipe de Larry Fisher a caractérisé la structure de l’OPN : elle appartient à une famille de proteines dont les gènes sont regroupés dans une même région d’environ 800 000 paires de base, située sur le chromosome 4 chez l’homme (et 5 chez la souris) : la famille SIBLING (small integrin binding lingand N-linked glycoproteins) (Figure 1) [
6]. Tous les membres de la famille SIBLING ont en commun leur expression dans l’os ou la dent, et leur liaison à au moins un récepteur de la famille des intégrines. L’OPN a par ailleurs pour particularité d’être riche en aspartate et d’avoir un site de clivage par la thrombine.  | Figure 1.
Exons des gènes de la famille SIBLING, situés sur le chromosome 4 humain. L’exon 1 est toujours non codant, l’exon 2 comporte la séquence leader et code pour les deux premiers acides aminés (AA) de la protéine mature, l’exon 3 comporte la séquence consensus SSEE pour la phosphorylation par la caséine kinase II (CKII), l’exon 4 code pour la séquence riche en proline qui confère sa charge positive à la molécule, l’exon 5 contient un site CKII et le seul site connu d’épissage alternatif (pour les protéines OPN et DMP1). La majorité des protéines de cette famille est codée par les deux derniers exons et contient un motif RGD (arginine-glutamine-aspartate) se liant aux intégrines. Tous les introns sont de type codon 0, permettant un épissage entre tous les exons sans causer de décalage dans le cadre de lecture. Le gène de l’OPN a été cloné pour la première fois en 1986 [
72], et a été décrit depuis chez plus de six espèces différentes, avec des régions carboxy- et aminoterminales bien conservées, contenant notamment le motif RGD. BSP : bone sialoprotein ; DMP1 : dentin matrix protein 1. |
En solution, l’OPN libre a une structure flexible, comme en témoignent les études par RMN : elle ne présente donc pas de structure secondaire (hélices α ou feuillets β) ou tertiaire particulière. L’hypothèse est que l’OPN adopte une structure fixée par sa liaison avec ses différents ligands. |
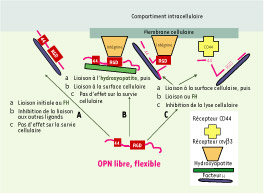
L’OPN a des ligands de structure très variée, aux fonctions à la fois redondantes et pléïotropes. Les interactions entre l’OPN et ses ligands, les cascades moléculaires intracellulaires secondaires à ces interactions et la spécificité de ces interactions, en termes de fonction, sont encore mal connues : ainsi, on ne sait pas si ces différents ligands sont impliqués de façon coordonnée ou non, ni quelle est la part entre les interactions auto/paracrines et endocrines. Liaison aux cristaux d’hydroxyapatite et au facteur H Les travaux de Larry Fisher ont déterminé la structure de l’OPN en solution et précisé ses interactions avec le facteur H et les cristaux d’hydroxyapatite (Figure 2) : l’OPN permet la survie des cellules la sécrétant, ce qui explique probablement en partie sa fonction protumorale (survie anormale des cellules transformées), de même que son rôle dans la survie de cellules fonctionnelles.  | Figure 2.
Interactions entre l’ostéopontine, le facteur H et les récepteurs de l’ostéopontine (intégrine et CD44), et leur effet sur la lyse cellulaire dans l’ostéoclaste. Dans sa forme soluble, l’OPN semble être majoritairement liée au facteur H (FH), ce qui rend difficile sa détection par des anticorps spécifiques. Le facteur H est un complexe moléculaire cofacteur du facteur I, celui-ci permettant la dégradation de la C3 convertase et une inhibition de la lyse de la cellule considérée. Ainsi, l’OPN active la résistance à l’autolyse de cellules qui la sécrètent (promeut la survie cellulaire). Les effets de l’interaction OPN/facteur H sont influencés par la fixation préalable de l’OPN aux cristaux minéraux d’hydroxyapatite : cette liaison OPN/hydroxyapatite inhibe le rôle de promoteur de la survie cellulaire de l’OPN. A. Si l’OPN se lie d’abord au facteur H, elle ne peut plus fixer ses autres ligands, il n’y a donc pas d’effet sur la survie cellulaire. B. Si l’OPN se lie d’abord à ses ligands minéraux (cristaux d’hydroxyapatite), elle peut par la suite se lier aux récepteurs membranaires, mais pas au facteur H : de ce fait, il n’y a pas d’effet sur la survie cellulaire. C. Si l’OPN se lie d’abord aux récepteurs membranaires, via le motif RGD ou de façon indépendante, la liaison au facteur H reste possible et il y a un effet sur la survie cellulaire (prolongée) (d’après [ 6]). |
Liaison au CD44 La nature et les effets de la liaison de l’OPN au récepteur CD44 sont actuellement débattus. Le CD44, présent à la surface des lymphocytes T, est un ligand de la forme déphosphorylée de l’OPN et promeut son action pro-inflammatoire et chimiotactique [
7,
8]. Récemment, Zohar et al. ont démontré que la forme intracellulaire de l’OPN (iOPN) est associée au complexe hyaluronane-CD44-ERM (protéine ezrine/radixine/moesine) dans les fibroblastes embryonnaires migrants [
9]. Ce complexe d’attachement est impliqué dans la migration des fibroblastes, des macrophages activés et des cellules métastatiques. Liaison au récepteur αVβ3 La liaison au récepteur αVβ3 dépend du motif RGD (arginine-glutamine-aspartate) et de la forme phosphorylée de l’OPN [ 8]. Elle induit, entre autres, un effet pro-inflammatoire [ 8] et inhibe de façon paradoxale la synthèse d’iNOS ( nitric oxide synthase) [
10]. La liaison OPN/αVβ3 est nécessaire au pouvoir chimiotactique de l’OPN pour les cellules musculaires lisses, les cellules endothéliales et les macrophages[
11]. |
Une large expression physiologique in vivo
Dans les conditions physiologiques, l’OPN est produite dans de multiples organes. Dans l’os, elle est produite par les ostéoblastes à un stade tardif de maturation, lorsque ces cellules produisent la matrice avant la minéralisation, et par les ostéoclastes [5], et elle est sécrétée dans la matrice extracellulaire. Elle est également exprimée de façon constitutive par certaines cellules épithéliales, comme dans le tubule distal du néphron (rein), les follicules pileux de la peau, les cellules glandulaires de l’utérus, le placenta et les ovaires. Dans de rares études réalisées chez l’animal, l’OPN a pu être détectée dans certains neurones du tronc cérébral durant le développement [
12–
15]. Elle a également été mise en évidence dans le liquide céphalorachidien par Western blot [
16], avec des poids moléculaires variant au cours du développement, ainsi que dans le cerveau humain adulte sain [
17]. Sous sa forme sécrétée, on la détecte dans le lait (environ 5 µg/ml), l’urine, la bile et le liquide labyrinthique (oreille interne). Enfin, on a décrit une forme intracellulaire périmembranaire de l’OPN, l’iOPN, dans des fibroblastes fœtaux migrants [
18]. |
Des fonctions physiologiques et pathologiques variées On sait aujourd’hui que les fonctions de l’OPN sont pléïotropiques [5,
19] : elles concernent classiquement la minéralisation, ainsi que les pathologies cancéreuses, vasculaires et neurologiques. Ses fonctions immunologiques, plus récemment décrites, font l’objet d’un paragraphe spécial. Au-delà de son rôle structural, l’OPN inhibe la minéralisation osseuse, sous sa forme phosphorylée [
20–
22]. Elle est, pour cette même raison, un inhibiteur naturel de la formation de lithiase rénale dans le tubule distal [
23,
24]. L’OPN est impliquée dans de nombreux cancers : sein, côlon, prostate, ostéosarcomes, carcinomes disséminés et mélanomes [
25,
26]. Marqueur de sévérité de la pathologie, l’augmentation de son expression est corrélée à une charge tumorale élevée et à une forte probabilité de métastases osseuses, peut-être en raison de son tropisme osseux [
27–
30]. Mais l’OPN a des effets paradoxaux sur la pathologie cancéreuse, puisqu’elle semble également inhiber la croissance tumorale, en activant la réponse immune antitumorale TH1 et la différenciation de cellules cytotoxiques antitumorales (réponse immune innée) [
31]. L’OPN intervient également dans différentes maladies vasculaires : dans la plaque d’athérome, elle est un inhibiteur naturel de la calcification [
32,
33] ; dans le cœur, elle est synthétisée par les macrophages après un infarctus [
34], ainsi que par les fibroblastes cardiaques et les cellules endothéliales : elle participe à la reconstruction du ventricule gauche en induisant la sécrétion de collagène [
35]. Enfin, l’OPN est surexprimée dans le système nerveux au cours de diverses pathologies. Dans les gliomes cérébraux, on la détecte in situ [
36], et dans les lignées gliomateuses, son expression est corrélée à l’agressivité tumorale [
37]. Par ailleurs, au cours de l’accident vasculaire ischémique cérébral, elle est sécrétée par les cellules microgliales et se lie au récepteur αVβ3 exprimé à la surface des astrocytes qui migrent vers le foyer d’infarcissement à la phase de cicatrisation [
38–
40]. Cette fonction a d’ailleurs valu à l’OPN le surnom d’ « astrokine ». Dans la maladie de Huntington, elle semble être une molécule régulatrice : son expression est accrue dans les cerveaux de patients atteints et, dans un des modèles animaux de cette maladie, elle augmente au cours du traitement par cystamine [
41]. Enfin, l’OPN est surexprimée par certains neurones dans un modèle animal expérimental d’épilepsie [
42]. Ainsi, l’OPN peut être exprimée par différentes cellules du système nerveux central, la glie, et notamment la microglie, et les neurones, au cours de diverses situations pathologiques. |
Souris déficientes en ostéopontine L’étude des souris déficientes en OPN (souris OPN−/−
) a permis de mieux comprendre le rôle de l’OPN et d’envisager ce qu’un traitement ciblé contre l’OPN pourrait entraîner comme effets secondaires. Le phénotype particulier de ces souris concerne différents organes et différentes fonctions. Le phénotype immunologique sera vu séparément dans le dernier chapitre. Phénotype osseux On a récemment montré que les souris OPN−/−
ont des os globlement plus résistants et plus minéralisés que les souris témoins [
43]. Cela serait dû à un retard de résorption osseuse, malgré un nombre d’ostéoclastes élevé. Deux études ont mis en évidence les interactions entre les hormones et l’OPN dans l’os : les souris OPN−/−
sont en effet résistantes à un modèle expérimental d’ostéoporose post-ménopausique (souris ovariectomisées) [
44], et on note par ailleurs une inhibition de la résorption osseuse induite par la PTH (hormone parathyroïde), par inhibition de la prolifération des ostéoclastes [
45]. De ce fait, l’ostéopontine est une cible thérapeutique potentielle pour traiter la déminéralisation, notamment celle survenant au cours de l’ostéoporose post-ménopausique. Phénotypes rénal et cardiovasculaire Dans le rein des souris OPN−/−
, on observe deux phénotypes associés : des anomalies immunologiques et un trouble de la minéralisation. Chez ces souris, l’obstruction urétérale s’accompagne d’un infiltrat macrophagique cinq fois moins important que chez les animaux témoins. Par ailleurs, elles présentent une formation anormale de cristaux d’oxalate de calcium dans les tubules rénaux [ 24]. Les souris OPN−/−
présentent une calcification anormale des vaisseaux [32]. Après infarctus du myocarde, elles présentent une inhibition de dépôt de collagène qui empêche une bonne cicatrisation myocardique et entraîne une dilatation ventriculaire gauche exagérée [35]. Maladies tumorales L’OPN est une molécule protumorale, favorisant les métastases. L’injection de cellules cancéreuses (mélanomiques) chez les souris OPN−/−
induit moins de métastases osseuses et pulmonaires que chez les souris OPN+/+
[
46]. Par ailleurs, l’effet procancéreux de la molécule oncogène Ras nécessite l’intervention de l’OPN : en effet, les cellules 3T3 déficientes en OPN et transformées avec Ras induisent des tumeurs moins importantes que les mêmes cellules tranformées avec Ras, mais non déficientes en OPN [
47]. Selon d’autres auteurs, l’OPN participe au contraire à la prévention de la transformation cancéreuse. Par exemple, le gène de l’OPN est la cible du gène supresseur de tumeur TP53 [
48]. Ainsi, l’induction de la transcription du gène de l’OPN par TP53 empêcherait les cellules abîmées d’entrer dans un cycle de transformation cancéreuse. |
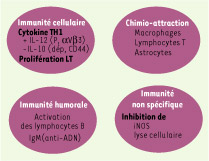
Implication de l’ostéopontine dans le système immunitaire L’OPN est considérée depuis la fin des années 90 comme une molécule pro-inflammatoire majeure jouant un rôle actif dans différentes maladies immunologiques ou infectieuses (Figure 3).  | Figure 3.
Influence de l’ostéopontine sur le système immunitaire (d’après [ 71]). |
Production par les cellules immunocompétentes Au cours de ces pathologies immunologiques ou infectieuses, l’OPN est surtout sécrétée par les cellules macrophagiques [
49] et histiocytaires. Son expression a également été rapportée à la phase précoce de l’activation des lymphocytes T, d’où son autre nom « eta-1 » ( early T cell activation factor gene 1)[
50]. Dans les lymphocytes T humains, l’OPN est spécifiquement surexprimée dans la sous-population TH1, pro-inflammatoire, et non dans la population TH2 [
51], suggérant son implication dans les pathologies médiées par l’inflammation TH1. Un rôle de cytokine pro-inflammatoire L’OPN agit sur le réseau de cytokines comme une molécule pro-inflammatoire de type TH1 [ 8, 19,
52]. En effet, elle active la sécrétion de cytokines pro-inflammatoires telles que l’interféron γ ou l’interleukine-12, et inhibe la sécrétion de cytokines régulatrices telles que l’interleukine-10. L’activité pro-TH1 dépend de sa forme phosphorylée et de sa liaison au récepteur αVβ3, via son motif RGD. L’inhibition de l’interleukine-10 est assurée par la liaison de la forme déphosphorylée de l’OPN à un autre récepteur, CD44. L’OPN active également la prolifération lymphocytaire dans la sarcoïdose [
53]. Activation humorale Dans le lupus et son modèle animal, l’OPN est surexprimée par les macrophages rénaux [
54–
57]. Par ailleurs, les souris surexprimant l’OPN développent des anticorps antinucléaires (anti-ADN double brin) comme on en détecte chez les patients atteints de lupus [
58]. Enfin, quand elles sont croisées avec des souris OPN−/−
, les souris lpr développent une maladie atténuée, caractérisée par un moindre taux d’auto-anticorps [
59]. Ces données suggèrent que l’OPN pourrait être une molécule activatrice de l’immunité B. Cependant, cet effet n’est pas certain, et est peut-être indirect : dans le cas du lupus, par exemple, l’OPN agit peut-être plus sur l’infiltrat macrophagique que, directement, sur l’activation des lymphocytes B. Migration et adhérence cellulaire L’OPN a des capacités d’attraction et d’adhérence cellulaire [
60,
61] : son injection sous-cutanée induit ainsi un afflux local massif de macrophages [ 60], et les souris OPN−/−
sont déficientes sans le recrutement de macrophages. L’OPN attire également les lymphocytes T et les astrocytes dans différents modèles, comme celui de l’accident vasculaire cérébral [ 38– 40]. Ces capacités chimiotactiques et d’adhérence de l’OPN sont assurées par le CD44 [ 7] et les récepteurs de la famille des intégrines, cette dernière voie d’action étant activée par le clivage de l’OPN par la thrombine. Phénotype immunologique des souris déficientes en ostéopontine Les souris OPN−/−
, ayant une déficience de l’immunité TH1, présentent des formes atténuées de maladies dysimmunitaires médiées par TH1. Elles présentent, par exemple, une forme atténuée du modèle de polyarthrite rhumatoïde induit par les anticorps anticollagène, avec une diminution de la destruction articulaire, de l’angiogenèse et de l’apoptose des chondrocytes [
62]. L’allergie de contact (hypersensibilité cutanée) est atténuée chez les souris OPN−/−
, par défaut d’attraction des cellules dendritiques de Langerhans depuis la peau jusque dans les ganglions locorégionaux [61]. Ces souris sont également résistantes à l’induction de granulomes après injection de PVP (pyrrolidone de polyvinyle), en raison d’une inhibition de l’immunité TH1 [8]. Les souris OPN−/−
présentent globalement des réponses inadaptées à diverses infections. Ces anomalies sont en rapport avec les fonctions pro-inflammatoires de l’OPN (relayant l’immunité TH1) et sa fonction chimiotactique sur les macrophages. Par exemple, l’afflux de macrophages formant des granulomes pulmonaires après inhalation de Schistosoma mansoni est significativement diminuée [
63]. On sait par ailleurs que l’OPN est surexprimée au cours de la tuberculose. Les souris OPN−/−
sont également résistantes à l’infection de la cornée induite par le virus HSV1, infection nomalement relayée par l’immunité TH1 [8]. Par ailleurs, les souris OPN−/−
sont incapables de lutter contre l’infection systémique par Listeria monocytogenes, ce qui normalement requiert une immunité TH1 compétente [8]. Enfin, l’induction de la maladie de Lyme par Borrelia burgdorferi chez les souris OPN−/−
induit une arthrite dont la sévérité varie en fonction de polymorphismes localisés sur le chromosome 5, mais cette influence serait due plutôt à des gènes liés qu’au gène de l’OPN [
64]. L’ostéopontine dans la sclérose en plaques : de la physiopathologie à l’application pratique La sclérose en plaques (SEP) est considérée comme une attaque auto-immune de la gaine de myéline du système nerveux central médiée par l’inflammation TH1, d’évolution imprévisible et au traitement seulement partiellement efficace. En 2001, l’analyse transcriptionnelle à large échelle d’échantillons de SEP et de son modèle murin, l’encéphalomyélite auto-immune expérimentale (EAE), a détecté une surexpression de l’OPN dans les lésions [
65]. Cette expression par les cellules immunocompétentes (cellules microgliales) et les cellules fonctionnelles (neurones) est corrélée à la gravité clinique de l’EAE. L’absence d’OPN (souris OPN−/−
) s’accompagne d’une maladie moins sévère et de rémissions, effets médié par une inhibition de la prolifération lymphocytaire, une diminution des cytokines TH1 et une surproduction d’IL-10. Par la suite, des corrélations clinicobiologiques ont été établies chez l’homme, montrant que la concentration d’OPN dans le sang est corrélée à certaines formes agressives de la maladie : les formes secondairement progressives en aggravation, notamment [
66–
68]. Cependant, il semble que la fonction de l’OPN dans la maladie soit plus complexe puisque, in vitro, elle est paradoxalement un facteur de différenciation des progéniteurs d’oligodendrocytes, donc a priori bénéfique dans le processus de remyélinisation au cours de la maladie [
69]. L’OPN est donc une molécule aux fonctions complexes dans cette maladie, influençant l’inflammation, mais peut-être aussi la remyélinisation et la fonction neuronale. Quoiqu’il en soit, le premier essai thérapeutique ciblant l’OPN a été mené en 2003 chez des souris souffrant d’EAE. Ce travail a montré que la vaccination par un ADN codant pour l’OPN atténue la maladie en induisant la production d’anticorps anti-OPN, probablement neutralisants, confirmant l’intérêt de l’OPN en tant que cible thérapeutique [
70]. |
L’OPN est une molécule complexe aux fonctions multiples. Reconnue comme une molécule pro-inflammatoire, elle a récemment été rebaptisée « interleukine-18 » du fait de cette propriété. L’utilisation de l’OPN comme cible thérapeutique s’est révélée efficace pour la première fois dans un modèle animal de sclérose en plaques. Cependant, cette utilisation chez l’homme est pour l’instant prématurée et nécessite une meilleure compréhension de la participation de l’ostéopontine à d’autres phénomènes que l’inflammation, par exemple la dégénérescence axonale et la démyélinisation dans la sclérose en plaques. |
1. Herring K. Some studies on mucosubstances of bovine cortical bone. Biochem J 1963; 89 : 405–14. 2. Herring GM. A comparison of bone matrix and tendon with particular reference to glycoprotein content. Biochem J 1976; 159 : 749–55. 3. Sorensen ES, Petersen TE. Posttranslational modifications of bovine osteopontin : identification of 28 phosphorylation and 3 O-glycosylation sites. Protein Sci 1995; 4 : 2040–9. 4. Sorensen ES, Petersen TE. Phosphorylation, glycosylation and transglutaminase sites in bovine osteopontin. Ann NY Acad Sci 1995; 21 : 363–6. 5. Denhardt DT, Guo X. Osteopontin : a protein with diverse functions. FASEB J 1993; 7 : 1475–82. 6. Fisher LW, Torchia DA, Fohr B, et al. Flexible structures of SIBLING proteins, bone sialoprotein, and osteopontin. Biochem Biophys Res Commun 2001; 280 : 460–5. 7. Weber GF, Ashkar S, Glimcher MJ, Cantor H. Receptor-ligand interaction between CD44 and osteopontin (Eta-1). Science 1996; 271 : 509–12. 8. Ashkar S, Weber GF, Panoutsakopoulou V, et al. Eta-1 (osteopontin) : an early component of type-1 (cell-mediated) immunity. Science 2000; 287 : 860–4. 9. Zohar R, Suzuki N, Suzuki K, et al. Intracellular osteopontin is an integral component of the CD44-ERM complex involved in cell migration. J Cell Physiol 2000; 184 : 118–30. 10. Hwang SM, Lopez CA, Heck DE, et al. Osteopontin inhibits induction of nitric oxide synthase gene expression by inflammatory mediators in mouse kidney epithelial cells. J Biol Chem 1994; 269 : 711–5. 11. Bendeck MP, Irvin C, Reidj M, et al. Smooth cell matrix metalloproteinase production is stimulated via alpha(v)-beta(3) integrin. Arterioscler Thromb Vasc Biol 2000; 20 : 1467–72. 12. Swanson GJ, Nomura S, Hogan BL. Distribution of expression of 2AR (osteopontin) in the embryonic mouse inner ear revealed by in situ hybridisation. Hear Res 1989; 41 : 169–77. 13. Shin SL, Cha JH, Chun MH, et al. Expression of osteopontin mRNA in the adult rat brain. Neurosci Lett 1999; 273 : 73–6. 14. Lee MY, Choi JS, Lim SW, et al. Expression of osteopontin mRNA in developing rat brainstem and cerebellum. Cell Tissue Res 2001; 306 : 179–85. 15. Ichikawa H, Yamashita K, Takano-Yamamoto T, Sugimoto T. Osteopontin-immunoreactivity in the rat trigeminal ganglion and trigeminal sensory nuclei. Brain Res 2001; 919 : 147–54. 16. Lopez CA, Olson ES, Adams JC, et al. Osteopontin expression detected in adult cochleae and inner ear fluids. Hear Res 1995; 85 : 210–22. 17. Ding Q, Stewart J Jr, Prince CW, et al. Promotion of malignant astrocytoma cell migration by osteopontin expressed in the normal brain : differences in integrin signaling during cell adhesion to osteopontin versus vitronectin. Cancer Res 2002; 62 : 5336–43. 18. Zohar R, Lee W, Arora P, et al. Single cell analysis of intracellular osteopontin in osteogenic cultures of fetal rat calvarial cells. J Cell Physiol 1997; 170 : 88–100. 19. O’Regan AW, Hayden JM, Berman JS. Osteopontin augments CD3-mediated interferon-gamma and CD40 ligand expression by T cells, which results in IL-12 production from peripheral blood mononuclear cells. J Leuk Biol 2000; 68 : 495–502. 20. Hunter GK, Kyle CL, Goldberg HA. Modulation of crystal formation by bone phosphoproteins : structural specificity of the osteopontin-mediated inhibition of hydroxyapatite formation. Biochem J 1994; 300 : 723–8. 21. Jono S, Peinado C, Giachelli CM. Phosphorylation of osteopontin is required for inhibition of vascular smooth muscle cell calcification. J Biol Chem 2000; 275 : 20197–203. 22. Hunter GK, Pampena DA, Goldberg HA. Osteopontin meeting, 2002. 23. Beshensky AM, Wesson JA, Worcester EM, et al. Effects of urinary macromolecules on hydroxyapatite crystal formation. J Am Soc Nephrol 2001; 12 : 2108–16. 24. Wesson JA, Johnson RJ, Mazzali M, et al. Osteopontin is a critical inhibitor of calcium oxalate crystal formation and retention in renal tubules. J Am Soc Nephrol 2003; 14 : 139–47. 25. Weber GF. The metastasis gene osteopontin : a candidate target for cancer therapy. Biochim Biophys Acta 2001; 1552 : 61–85. 26. Furger KA, Menon RK, Tuckl AB, et al. The functional and clinical roles of osteopontin in cancer and metastasis. Curr Mol Med 2001; 1 : 621–32. 27. Rudland PS, Platt-Higgins A, El-Tanani M, et al. Prognostic significance of the metastasis-associated protein osteopontin in human breast cancer. Cancer Res 2002; 62 : 3417–27. 28. Euer N, Schwirzke M, Evtimova V, et al. Identification of genes associated with metastasis of mammary carcinoma in metastatic versus non-metastatic cell lines. Anticancer Res 2002; 22 : 733–40. 29. Hotte SJ, Winquist EW, Stitt L, et al. Plasma osteopontin : associations with survival and metastasis to bone in men with hormone-refractory prostate carcinoma. Cancer 2002; 95 : 506–12. 30. Agrawal D, Chen T, Irby R, et al. Osteopontin identified as lead marker of colon cancer progression, using pooled sample expression profiling. J Natl Cancer Inst 2002; 94 : 513–21. 31. Rittling SR BB, Chen Y. Role of host osteopontin in tumorigenesis. Osteopontin meeting, 2002. 32. Speer MY, McKee MD, Guldberg RE, et al. Inactivation of the osteopontin gene enhances vascular calcification of matrix Gla protein-deficient mice : evidence for osteopontin as an inducible inhibitor of vascular calcification in vivo. J Exp Med 2002; 196 : 1047–55. 33. Steitz SA, Speer MY, McKee MD, et al. Osteopontin inhibits mineral deposition and promotes regression of ectopic calcification. Am J Pathol 2002; 161 : 2035–46. 34. Murry CE, Giachelli CM, Schwartz SM, Vracko R. Macrophages express osteopontin during repair of myocardial necrosis. Am J Pathol 1994; 145 : 1450–62. 35. Trueblood NA, Xie Z, Communal C, et al. Exaggerated left ventricular dilation and reduced collagen deposition after myocardial infarction in mice lacking osteopontin. Circ Res 2001; 88 : 1080–7. 36. Markert JM, Fuller CM, Gillespie GY, et al. Differential gene expression profiling in human brain tumors. Physiol Genomics 2001; 5 : 21–33. 37. Saitoh Y, Kuratsu J, Takeshima H, et al. Expression of osteopontin in human glioma. Its correlation with the malignancy. Lab Invest 1995; 72 : 55–63. 38. Wang X, Louden C, Yue TL, et al. Delayed expression of osteopontin after focal stroke in the rat. J Neurosci 1998; 18 : 2075–83. 39. Ellison JA, Velier JJ, Spera P, et al. Osteopontin and its integrin receptor alpha(v)beta3 are upregulated during formation of the glial scar after focal stroke. Stroke 1998; 29 : 1698–707. 40. Ellison JA, Barone FC, Feuerstein GZ. Matrix remodeling after stroke. De novo expression of matrix proteins and integrin receptors. Ann NY Acad Sci 1999; 890 : 204–22. 41. Karpuj MV, Becher MW, Springer JE, et al. Prolonged survival and decreased abnormal movements in transgenic model of Huntington disease, with administration of the transglutaminase inhibitor cystamine. Nat Med 2002; 8 : 143–9. 42. Kim SY, Choi YS, Choi JS, et al. Osteopontin in kainic acid-induced microglial reactions in the rat brain. Mol Cells 2002; 13 : 429–35. 43. Boskey AL, Spevak L, Paschalis E, et al. Osteopontin deficiency increases mineral content and mineral crystallinity in mouse bone. Calcif Tissue Int 2002; 71 : 145–54. 44. Yoshitake H, Rittling SR, Denhardt DT, Noda M. Osteopontin-deficient mice are resistant to ovariectomy-induced bone resorption. Proc Natl Acad Sci USA 1999; 96 : 8156–60. 45. Ihara H, Denhardt DT, Furuya K, et al. Parathyroid hormone-induced bone resorption does not occur in the absence of osteopontin. J Biol Chem 2001; 276 : 13065–71. 46. Nemoto H, Rittling SR, Yoshitake H, et al. Osteopontin deficiency reduces experimental tumor cell metastasis to bone and soft tissues. J Bone Miner Res 2001; 16 : 652–9. 47. Wu Y, Denhardt DT, Rittling SR. Osteopontin is required for full expression of the transformed phenotype by the ras oncogene. Br J Cancer 2000; 83 : 156–63. 48. Morimoto I, Sasaki Y, Ishida S, et al. Identification of the osteopontin gene as a direct target of TP53. Genes Chromosomes Cancer 2002; 33 : 270–8. 49. Ahn JH, Lee Y, Jeon C, et al. Identification of the genes differentially expressed in human dendritic cell subsets by cDNA subtraction and microarray analysis. Blood 2002; 100 : 1742–54. 50. Patarca R, Freeman GJ, Singh RP, et al. Structural and functional studies of the early T lymphocyte activation 1 (Eta-1) gene. Definition of a novel T cell-dependent response associated with genetic resistance to bacterial infection. J Exp Med 1989; 170 : 145–61. 51. Nagai S, Hashimoto S, Yamashita T, et al. Comprehensive gene expression profile of human activated T(h)1- and T(h)2-polarized cells. Int Immunol 2001; 13 : 367–76. 52. O’Regan AW, Nau GJ, Chupp GL, Berman JS. Osteopontin (Eta-1) in cell-mediated immunity : teaching an old dog new tricks. Immunol Today 2000; 21 : 475–8. 53. O’Regan AW, Chupp GL, Lowry JA, et al. Osteopontin is associated with T cells in sarcoid granulomas and has T cell adhesive and cytokine-like properties in vitro. J Immunol 1999; 162 : 1024–31. 54. Masutani K, Akahoshi M, Tsuruya K, et al. Predominance of Th1 immune response in diffuse proliferative lupus nephritis. Arthritis Rheum 2001; 44 : 2097–106. 55. Okada H, Moriwaki K, Konishi K, et al. Tubular osteopontin expression in human glomerulonephritis and renal vasculitis. Am J Kidney Dis 2000; 36 : 498–506. 56. Lampe MA, Patarca R, Iregui MV, Cantor H. Polyclonal B cell activation by the Eta-1 cytokine and the development of systemic autoimmune disease. J Immunol 1991; 147 : 2902–6. 57. Wuthrich RP, Fan X, Ritthaler T, et al. Enhanced osteopontin expression and macrophage infiltration in MRL-Fas(lpr) mice with lupus nephritis. Autoimmunity 1998; 28 : 139–50. 58. Iizuka J, Katagiri Y, Tada N, et al. Introduction of an osteopontin gene confers the increase in B1 cell population and the production of anti-DNA autoantibodies. Lab Invest 1998; 78 : 1523–33. 59. Weber GF, Cantor H. Differential roles of osteopontin/Eta-1 in early and late lpr disease. Clin Exp Immunol 2001; 126 : 578–83. 60. Giachelli CM, Lombardi D, Johnson RJ, et al. Evidence for a role of osteopontin in macrophage infiltration in response to pathological stimuli in vivo. Am J Pathol 1998; 152 : 353–8. 61. Weiss JM, Renkl AC, Maier CS, et al. Osteopontin is involved in the initiation of cutaneous contact hypersensitivity by inducing Langerhans and dendritic cell migration to lymph nodes. J Exp Med 2001; 194 : 1219–29. 62. Yumoto K, Ishijima M, Rittling SR, et al. Osteopontin deficiency protects joints against destruction in anti-type II collagen antibody-induced arthritis in mice. Proc Natl Acad Sci USA. 2002; 99 : 4556–61. 63. O’Regan AW, Hayden JM, Body S, et al. Abnormal pulmonary granuloma formation in osteopontin-deficient mice. Am J Respir Crit Care Med 2001; 164 : 2243–7. 64. Potter MR, Rittling SR, Denhardt DT, et al. Role of osteopontin in murine Lyme arthritis and host defense against Borrelia burgdorferi. Infect Immun 2002; 70 : 1372–81. 65. Chabas D, Baranzini SE, Mitchell D, et al. The influence of the proinflammatory cytokine, osteopontin, on autoimmune demyelinating disease. Science 2001; 294 : 1731–5. 66. Vogt MH, Lopatinskaya L, Smits M, et al. Elevated osteopontin levels in active relapsing-remitting multiple sclerosis. Ann Neurol 2003; 53 : 819–22. 67. Vogt MH, Floris S, Killestein J, et al. Osteopontin levels and increased disease activity in relapsing-remitting multiple sclerosis patients. J Neuroimmunol 2004; 155 : 155–60. 68. Comabella M, Pericot I, Goertsches R, et al. Plasma osteopontin levels in multiple sclerosis. J Neuroimmunol 2005; 158 : 231–9. 69. Selvaraju R, Bernasconi L, Losberger C, et al. Osteopontin is upregulated during in vivo demyelination and remyelination and enhances myelin formation in vitro. Mol Cell Neurosci 2004; 25 : 707–21. 70. Steinman L, Youssef S, Van Venrooij N, et al. Response to comment on the influence of the proinflammatory cytokine, osteopontin, on autoimmune demyelinating disease. Science 2003; 299 : 1845b. 71. Chabas D. L’ostépontine dans la sclérose en plaques. Thèse d’immunologie. Paris : UPMC, 2003 : 116 p. 72. Oldberg A, Franzen A, Heinegard D. Cloning and sequence analysis of rat bone sialoprotein (osteopontin) cDNA reveals an Arg-Gly-Asp cell-binding sequence. Proc Natl Acad Sci USA 1986; 83 : 8819–23. |