Les peroxisome proliferator-activated receptors (PPAR) sont des facteurs de transcription activés par les acides gras et certains de leurs métabolites. Ils participent à la régulation du métabolisme et au contrôle de la différenciation de plusieurs tissus. Les isoformes α et γ ont été les plus étudiées, en particulier parce qu’elles sont les relais des effets de molécules hypolipémiantes (fibrates) ou antidiabétiques (thiazolidinediones). Récemment, il a été établi que PPARδ était également une cible thérapeutique intéressante pour le traitement du syndrome métabolique. Ainsi, chez le singe et la souris obèses, le traitement par un agoniste PPARδ normalise le profil lipidique, améliore la réponse à l’insuline et diminue l’obésité [ 1, 2].
Ces deux dernières années, il a été montré que le muscle squelettique était une cible privilégiée des agonistes de PPARδ. En effet, des arguments pharmacologiques et génétiques ont prouvé que PPARδ joue un rôle central dans la régulation du catabolisme des acides gras dans les cellules musculaires en culture. Dans les myotubes C2C12 ou L6, PPARδ contrôle directement l’expression de la plupart des protéines impliquées dans le catabolisme des lipides, et son activation conduit à l’augmentation de la β-oxydation des acides gras [2, 3].
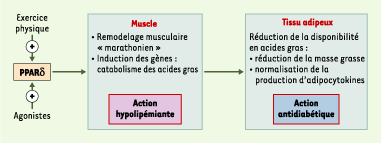
Des études réalisées in vivo, grâce à des modèles de souris transgéniques qui présentent une surexpression de PPARδ spécifique dans le muscle squelettique, ont révélé une fonction inattendue pour PPARδ dans la physiologie musculaire. La première publication a montré que cette augmentation de l’expression de PPARδ conduisait à des changements profonds de la composition en fibres des différents muscles, avec une augmentation du nombre de fibres de type oxydatif (augmentation de 2,7 fois dans le muscle tibialis anterior), alors que le nombre de fibres glycolytiques ne varie pas. Ce remodelage musculaire conduit à une augmentation des capacités oxydatives musculaires et donc du catabolisme des acides gras. Ce nouveau phénotype musculaire s’accompagne d’une très nette réduction de la masse grasse due à une diminution de la taille moyenne des adipocytes [ 4]. Ces observations ont été confirmées très récemment par un autre groupe qui montre, en outre, que la surexpression musculaire de PPARδ confère une protection très efficace contre les effets néfastes des régimes riches en lipides, comme l’obésité et la résistance à l’insuline, et augmente la résistance à la fatigue musculaire [ 5]. Ainsi, les animaux qui surexpriment PPARδ dans leurs muscles acquièrent un phénotype musculaire et métabolique similaire au phénotype « marathonien » induit par l’entraînement d’endurance de longue durée [ 6]. Cela est tout à fait inattendu, puisque ces animaux ont une activité physique qui n’est pas perturbée. Ces observations suggèrent que PPARδ est un acteur important dans le remodelage musculaire induit par l’exercice physique. La démonstration que l’expression de PPARδ est augmentée d’un facteur 3, environ, dans les muscles d’animaux témoins soumis à un exercice modéré (45 minutes de natation par jour pendant 3 semaines) est un argument fort en faveur de cette hypothèse [4].
L’ensemble de ces données indique donc que PPARδ joue un rôle important dans la physiologie musculaire. D’une part, son activation par des agonistes synthétiques conduit à une augmentation de l’expression des protéines impliquées dans le catabolisme des acides gras. D’autre part, le facteur de transcription joue probablement un rôle majeur dans les mécanismes d’adaptation du muscle à l’entraînement à l’exercice d’endurance, qui se traduit par une augmentation de la capacité intrinsèque du muscle à consommer des acides gras.
La découverte de ces nouvelles fonctions de PPARδ dans le muscle permet d’apporter un début d’explication aux effets bénéfiques de ces agonistes synthétiques chez les animaux obèses. Il peut être proposé que, comme le fait l’exercice physique d’endurance, la suractivité de PPARδ augmente la consommation de lipides dans le muscle squelettique et diminue la disponibilité en acides gras pour la synthèse de triglycérides dans le tissu adipeux, ce qui provoque une réduction de l’adiposité et une normalisation de la production d’adipocytokines (Figure 1). Ces observations font de l’utilisation d’agonistes de PPARδ une approche thérapeutique nouvelle pour le traitement du syndrome métabolique. Toutefois, le récepteur nucléaire a un profil d’expression tissulaire large et, afin d’éviter des effets néfastes de traitements par de telles molécules, il devient urgent de connaître les fonctions de PPARδ dans d’autres tissus, comme l’intestin ou le cœur.