| |
| Med Sci (Paris). 2004 November; 20(11): 973–978. Published online 2004 November 15. doi: 10.1051/medsci/20042011973.Calcimimétiques et traitement des hyper-parathyroïdies Pablo Urena* Service de Néphrologie-dialyse, Clinique de l’Orangerie, 11, boulevard Anatole-France, 93300 Aubervilliers, France et Service d’Explorations fonctionnelles, Hôpital Bichat, 16, rue Henri-Huchard, 75018 Paris, France |
La sécrétion d’hormone parathyroïdienne (PTH) et de calcitonine est principalement réglée par la concentration de calcium extracellulaire (Ca2+ec). En 1993, l’équipe d’E.M. Brown a réalisé une des plus grandes avancées dans le domaine de la régulation de la sécrétion de ces peptides et du métabolisme minéral, le clonage du récepteur du calcium (CaR) [
1]. Pour la première fois, il a été démontré qu’un récepteur protéique pouvait fixer et être activé par une molécule inorganique, en l’occurrence le calcium. Ce clonage a permis de connaître sa structure protéique et ses voies de signalisation intracellulaire, le diagnostic précis de plusieurs maladies congénitales et acquises dues à des mutations dans le gène codant pour le CaR [
2,
3], et le développement des molécules pouvant moduler l’activité du CaR, notamment les calcimimétiques et les calcilytiques (Figure 1) (→). (→) m/s 2004, n° 11, p. 980
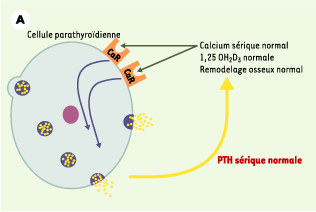
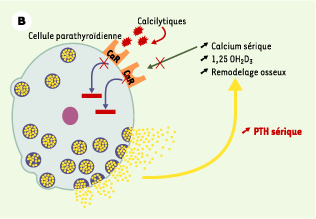
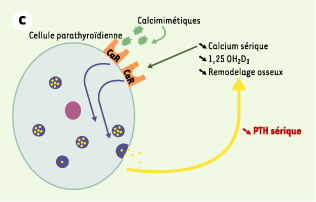
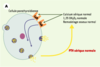 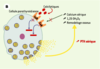 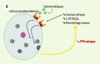 | Figure 1.
Le récepteur parathyroïdien du calcium extracellulaire (CaR). A. En situation normale, le CaR est stimulé par l’augmentation de la concentration sérique de calcium ionisé [Ca2+] ou inhibé par la diminution cette concentration. Cette régulation de l’activité du CaR par les variations de la concentration de Ca2+ permet de maintenir la sécrétion et la concentration d’hormone parathyroïdienne (PTH) dans des limites normales, ce qui résulte en un remodelage osseux approprié, une synthèse rénale de calcitriol (1,25 OH2D3) adéquate et une réabsorption tubulaire contrôlée de calcium. La concentration de Ca2+ sérique est ainsi maintenue stable dans une zone étroite. B. En cas de perte de fonction du récepteur du calcium, soit par une altération génétique (hypercalcémie hypocalciurique familiale, hypercalcémie néonatale sévère), soit par blocage par un calcilytique, la synthèse comme la sécrétion d’hormone parathyroïdienne ne sont plus contrôlées et la concentration sérique de PTH augmente. Cet excès résulte en une augmentation du remodelage osseux, de la synthèse rénale de calcitriol et de la calcémie. Le CaR ne répond pas à l’augmentation de la concentration de Ca2+ sérique et la régulation de la sécrétion de PTH par le Ca2+ est perdue. C. En cas de gain de fonction du récepteur du calcium, soit par une altération génétique (hypercalcémie hypercalciurique autosomique dominante), soit par stimulation par un calcimimétique, la synthèse et la sécrétion d’hormone parathyroïdienne sont inhibées, ce qui résulte en une diminution de la concentration sérique de PTH. Cette réduction s’accompagne d’une diminution du remodelage osseux, de la synthèse rénale de calcitriol et de la calcémie. |
Les calcimimétiques sont des molécules capables de rendre le CaR plus sensible aux effets du Ca2+ec. Il peuvent être classés en deux types : le type I, qui comprend toute molécule pouvant stimuler directement le CaR, et le type II, qui comprend les activateurs allostériques du CaR, capables de changer la conformation structurale du CaR et d’augmenter de façon stéréo-sélective sa sensibilité au Ca2+ec. Ces calcimimétiques de type II n’ont pas d’effet en l’absence de Ca2+ec. Leur site d’action sur le CaR est probablement localisé au niveau du 7e domaine transmembranaire, comme l’ont suggéré les études de mutations spontanées et de mutagenèse dirigée [
4]. Les deux types de calcimimétiques réduisent la sécrétion de PTH d’une manière dépendante de la dose administrée, ce qui présente un intérêt dans le traitement médical de diverses maladies, dont les hyperparathyroïdies (Tableau I).  | Tableau I. Indications médicales potentielles des modulateurs du récepteur du calcium |
. |
Études in vitro Plusieurs calcimimétiques de type II ont déjà été synthétisés 1, à partir d’une molécule mère, la fendiline, un ancien agent bloquant les canaux calciques. Le R-énantiomère d’une même molécule est environ 10 fois plus puissant que le S-énantiomère : dans des cellules parathyroïdiennes bovines en culture, par exemple, le NPS R-568 2 inhibe la sécrétion de PTH avec une IC 50 (IC, inhibitory concentration) de 22 nM, contre 1 μM pour le NPS S-568 [
5]. Ces produits stimulent la sécrétion de calcitonine via le CaR présent dans les cellules C de la thyroïde, mais l’ED 50 (ED, effective dose) est environ 40 fois plus grande (40 mg/kg) que celle pour l’inhibition de la sécrétion de PTH (1 mg/kg). Le NPS R-568 augmente également l’effet du calcium sur l’hydrolyse des inositides trisphosphates et la libération de calcium intracellulaire dans les cellules HEK-293 transfectées avec l’ADNc du CaR. Dans les mêmes cellules, il active aussi des canaux cationiques non sélectifs [
6]. Études chez l’animal sain Lorsque le NPS R-568 est administré par gavage chez le rat sain, il provoque une diminution rapide et dépendante de la dose (ED 50 : 1,1 ± 0,7 mg/kg) de la concentration plasmatique de PTH et, parallèlement, de calcium, avec toutefois une ED 50 supérieure pour ce dernier (10,4 ± 3,7 mg/k). À la dose de 3,3 mg/kg, la PTH atteint sa concentration plasmatique minimale à la 15 e minute ; quant à l’hypocalcémie, sa survenue intervient souvent avant la 30 e minute aux doses de 10 mg/kg à 100 mg/kg, et persistante puisqu’elle est encore importante au terme des 24 heures. Dans ces études, la binéphrectomie n’affecte ni la cinétique, ni le degré de l’hypocalcémie, ce qui suggère un effet hypocalcémiant du calcimimétique non pas via l’activation du CaR tubulaire rénal, mais essentiellement via la suppression de la sécrétion de PTH. Dans le même sens, une parathyroïdectomie pratiquée chez ces animaux prévient, à calcémie maintenue normale par une perfusion continue de calcium, l’effet hypocalcémique du calcimimétique [
7]. Études chez le volontaire sain Le calcimimétique NPS R-568 a été testé chez une trentaine de femmes ménopausées, réparties au hasard en deux groupes, l’un recevant des doses croissantes (de 10 mg/jour à 400 mg/j) de NPS R-568 par voie orale, l’autre un placebo [
8,
9]. Une diminution de la concentration plasmatique de la PTH dépendante de la dose administrée a été observée dans le groupe traité : en moyenne, la réduction de la sécrétion de PTH 30 à 120 minutes après la prise du calcimimétique était de 34 % avec la dose de 10 mg et de 74 % avec la dose de 400 mg. Cette diminution durait jusqu’à 12 heures avec la dose de 400 mg. L’effet sur la PTH s’observait malgré une baisse soutenue de la calcémie. Aucun effet indésirable n’a été enregistré pendant cette étude, malgré une augmentation significative de la calcitoninémie aux plus fortes doses [ 8, 9]. L’effet d’un autre calcimimétique, le KRN R-568, a été étudié chez six hommes volontaires sains inclus dans une étude clinique de phase I menée au Japon, qui avait comme objectif de déterminer les effets des calcimimétiques sur la sécrétion de gastrine. Une dose unique de 25 mg à 400 mg de KRN R-568 était administrée par voie orale, à jeun et après un repas : la concentration de gastrine n’augmentait significativement que chez un sujet (de 30 pg/ml à 125 pg/ml), l’augmentation n’était que très modeste (en moyenne de 34 pg/ml à 63 pg/ml) chez les autres cinq sujets [
10]. |
Calcimimétiques en clinique Hyperparathyroïdie primaire Dans une étude contrôlée, 20 femmes post-ménopausées ayant une hyperparathyroïdie primaire ont été randomisées en deux groupes, un groupe recevant une dose unique de NPS R-568 par voie orale (de 4 mg à 160 mg), et l’autre un placebo [
11]. La dose efficace minimale de calcimimétique, égale à 20 mg, provoquait une diminution de la concentration plasmatique de PTH de 26 % ; aux doses plus élevées de 80 mg et 160 mg, la PTH baissait respectivement de 42 % et 51 %, et revenait à sa valeur initiale après 4 heures et 8 heures, respectivement. La concentration plasmatique de calcium ionisé ne diminuait que légèrement (de 1,35 mM à 1,30 mM), 4 heures après la prise de la dose la plus forte de 160 mg du calcimimétique. De la même manière, la calciurie n’augmentait d’un facteur 2,3 que 2 heures après la prise de 160 mg de NPS R-568, pour retourner à sa valeur de base 8 heures plus tard. Dans une autre étude réalisée avec le calcimimétique de deuxième génération AMG-073 (ou cinacalcet) [
12], 22 patients atteints d’hyperparathyroïdie primaire ont été randomisés en double aveugle, 11 malades recevant le calcimimétique aux doses de 30, 40 ou 50 mg/j pendant 15 jours, les autres un placebo. Le traitement par l’AMG-073 normalisait la calcémie chez tous les patients, sans avoir d’effet indésirable majeur. La concentration plasmatique de PTH baissait de 45 % 2 à 4 heures après la prise de 50 mg d’AMG-073 et se maintenait en dessous de la valeur initiale tout au long de l’étude. Cancer parathyroïdien L’efficacité et la bonne tolérance à long terme du NPS R-568 ont été démontrées chez un homme âgé de 78 ans présentant un carcinome des parathyroïdes. Lors d’une hospitalisation en réanimation, il présentait une concentration plasmatique élevée de calcium ionisé de 1,83 mM, résistante aux thérapies conventionnelles, la PTH était de 872 pg/ml et la calciurie supérieure à 20 mmol/24 h. Le traitement par NPS R-568 à la dose de 50-100 mg 4 fois/jour a permis de réduire significativement sa concentration de PTH (aux environs de 300 pg/ml) et de contrôler son hypercalcémie et son hypercalciurie pendant plus de 600 jours [
13]. Hyperparathyroïdie secondaire à l’urémie Un certain nombre de résultats ont été obtenus chez l’animal urémique [
14–
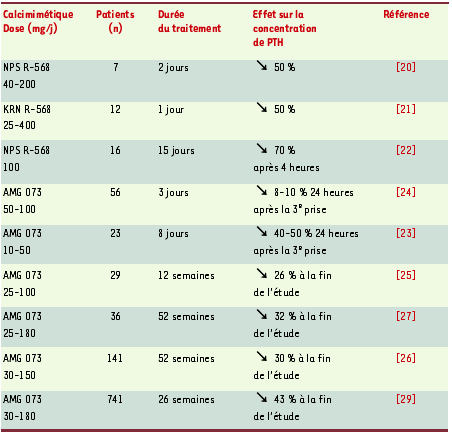
19] : le traitement par calcimimétique réduit l’hyperprolifération parathyroïdienne de 20 % à 50 % ; il diminue la concentration plasmatique de PTH de 82 % à 94% 30 minutes après son administration, indépendamment du degré d’hyperparathyroïdie, de la calcémie et de la phosphorémie ; il prévient l’hyperplasie de glandes parathyroïdes s’il est administré dès la création de l’insuffisance rénale ; enfin, il corrige les signes d’ostéite fibreuse. Il faut également noter que le traitement intermittent par le calcimimétique, dans un modèle d’ostéopathie à faible remodelage induite par l’adriamycine, restaure le volume osseux trabéculaire et l’épaisseur des travées osseuses, et augmente la densité osseuse de 14 %. En revanche, aucune amélioration n’est observée lorsqu’il est administré de façon continue par voie sous-cutanée. Ce qui suggère que la diminution quotidienne intermittente de la PTH provoquée par le calcimimétique pourrait avoir des effets anabolisants sur l’os. Chez l’homme, la première étude à démontrer l’effet aigu d’un calcimimétique sur la concentration plasmatique de PTH a été réalisée chez sept patients hémodialysés présentant une hyperparathyroïdie modérée (Tableau II) [
20]. Deux doses de NPS R-568 ont été administrées, l’une avant la séance de dialyse, l’autre 24 heures plus tard. La concentration plasmatique de PTH diminuait significativement 2 à 4 heures après l’administration du calcimimétique et se maintenait environ à 50 % de la valeur initiale 48 heures plus tard. De façon analogue, la concentration plasmatique de calcium ionisé diminuait significativement de 1,30 mM à 1,14 mM 48 heures après la prise du calcimimétique. La concentration plasmatique de calcitonine doublait 4 heures après l’administration et retournait aux valeurs de base 48 heures plus tard. Des résultats similaires ont été rapportés par un autre groupe [
21]. 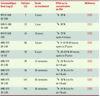 | Tableau II. Effets des calcimimétiques chez le patient urémique présentant une hyperparathyroïdie secondaire. |
Dans une autre étude, 21 patients hémodialysés présentant une hyperparathyroïdie modérée [
22] ont été randomisés en deux groupes : l’un, de 5 patients, recevant le placebo, et l’autre, de 16 patients, recevant 100 mg/j de NPS R-568 par voie orale pendant 15 jours. Dans le groupe traité, la concentration plasmatique de PTH était réduite de 66 %, 78 % et 70 %, respectivement une heure, deux heures et quatre heures après la prise et se maintenait à un niveau inférieur à la valeur de base pendant les 24 heures suivantes. Sept de ces 16 patients ont dû être retirés de l’étude en raison de l’apparition de troubles gastro-intestinaux et de signes cliniques d’hypocalcémie (calcémie ionisée inférieure à 1 mM). Un point intéressant de cette étude est la présentation des données pharmacocinétiques du NPS R-568 : après une dose unique, sa concentration plasmatique maximale n’était obtenue qu’à des temps très variables, allant de 1 à 24 heures. Le pic plasmatique, souvent observé entre 2,5 et 4,4 heures, variait également considérablement d’un sujet à l’autre, de 0,42 à 42,2 ng/ml. De plus, il existait une différence supérieure à 50 % dans la concentration maximale moyenne chez les mêmes individus d’un jour à l’autre. La biodisponibilité du NPS R-568 était très basse (< 1%) et son catabolisme, entièrement hépatique, passait par l’un des cytochromes P450 (CYP 2D6), dont la variabilité est très importante, ce qui a empêché le développement commercial de cette molécule. Trois études menées avec le calcimimétique de seconde génération AMG-073 ont été publiées [
23–
25]. Une première étude [
24] portait sur 56 patients hémodialysés présentant une hyperparathyroïdie secondaire. La randomisation était de 8:2 (AMG-073:placebo) dans le groupe recevant 5 et 10 mg/j du calcimimétique et de 6:2 dans le groupe recevant 50, 75 et 100 mg. Les patients étaient hospitalisés et traités pendant 72 heures. Les résultats ont montré que les doses de 5 et 10 mg/j n’avaient aucune efficacité sur la concentration plasmatique de PTH, que celle-ci diminuait en revanche de façon dépendante de la dose de calcimimétique à partir de 25 mg/j d’AMG-073 et que les doses de 75 et 100 mg/j diminuaient la calcémie respectivement de 8,3 % et 9,4 %. Des effets indésirables mineurs (céphalées, nausées, vomissements et étourdissements) ont été observés. La deuxième étude [23] portait sur 30 patients hémodialysés présentant une hyperparathyroïdie secondaire. La randomisation était de 23:7 (AMG-073:placebo). L’AMG-073 par voie orale a été administré en hospitalisation pendant 8 jours, aux doses de 10 mg/j (8 patients), 25 mg/j (6 patients), 50/25 mg/j (3 patients) et 50 mg/j (6 patients). La concentration plasmatique de PTH était maintenue 40 % à 50 % en dessous de sa valeur initiale avec les doses de 50/25 (50 mg un jour sur deux, 25 mg un jour sur deux) et 50 mg/j d’AMG-073. La calcémie, la phosphorémie et le produit phosphocalcique diminuaient significativement à ces mêmes doses. Des effets secondaires mineurs, similaires à ceux précedemment décrits, ont été observés. La troisième étude, à long terme, portait sur 78 patients hémodialysés présentant une hyperparathyroïdie secondaire [25]. La randomisation était de 39:39 (AMG-073:placebo). Pendant les 12 premières semaines de l’étude, la dose d’AMG-073 (de 20 mg/j initialement 30, 40 ou 50 mg/j) était ajustée toutes les trois semaines en fonction de la concentration de PTH. Ensuite, le patient restait pendant six semaines avec une dose fixe d’entretien. À la fin de l’étude, la concentration de PTH avait diminué de 26 % dans le groupe AMG-073 et augmenté de 22 % dans le groupe témoin. De manière similaire, le produit phosphocalcique diminuait de 16,9 % dans le groupe calcimimétique et augmentait de 11 % dans le groupe témoin. Une hypocalcémie transitoire et asymptomatique est survenue chez 3 des 39 patients traités, mais aucun effet indésirable majeur n’a été rapporté. Lorsque les doses d’AMG-073 augmentent aux environs de 150 à 180 mg/j, plus de 80 % des patients présentent une diminution de la concentration plasmatique de PTH de plus de 30 %, et une concentration idéale est obtenue chez plus de 50 % des patients [
26]. L’AMG-073 améliore également le métabolisme osseux : après un an de traitement, la masse osseuse augmente de 2 % au niveau du col fémoral et de 0,5 % au niveau du corps entier, alors qu’elle diminue d’environ 2 % aux deux sites chez des patients sous placebo [
27]. Ce calcimimétique semblerait également améliorer les performances cognitives et la qualité de vie, paramètres évalués par le questionnaire SF-36 [
28]. Dans une étude plus récente, l’AMG-073 a été administré pendant six mois, à la dose de 30 à 180 mg/j, à 371 patients, dialysés, présentant une hyperparathyroïdie secondaire ; ce traitement a permis de réduire de 43 % les concentrations de PTH circulante, de réduire le produit phosphocalcique de 17 % et d’atteindre une valeur cible de PTH < 250 pg/ml chez 64 % des malades [
29]. |
Par analogie avec l’action des calcimimétiques, il était logique d’imaginer pouvoir augmenter la sécrétion de PTH avec des molécules, les calcilytiques, inactivant le CaR des glandes parathyroïdes. De fait, l’administration orale quotidienne de 100 μmol/kg du calcilytique NPS 2143, pendant huit semaines, à des rates ostéopéniques préalablement ovariectomisées, augmente la sécrétion endogène de PTH et, de manière substantielle, le remodelage osseux global [
30]. Si ces résultats se confirment dans d’autres études, le traitement de l’ostéoporose pourrait être révolutionné dans un proche avenir. |
Avec le clonage du CaR et le développement des calcimimétiques, le traitement médical de l’hyperfonctionnement des glandes parathyroïdes semble être voué à un changement radical. Les essais cliniques avec les premiers calcimimétiques ont montré qu’il était possible de prévenir et de freiner l’hyperparathyroïdie secondaire à l’urémie avec une bonne efficacité et peu d’effets secondaires. Les premiers résultats, à court et à long terme, obtenus avec le calcimimétique de deuxième génération AMG-073 sont plus qu’encourageants, d’autant qu’aucun effet secondaire grave, en dehors des hypocalcémies transitoires, n’a été signalé. Ces épisodes d’hypocalcémie prédisent qu’il faudra certainement associer au traitement calcimimétique des sels de calcium et des dérivés de la vitamine D. Ces derniers seront sans doute plus faciles à gérer, car les calcimimétiques baissent également la phosphorémie et le produit phosphocalcique chez le patient dialysé, ce qui devrait limiter les risques de calcifications extrasquelettiques. Si l’on peut espérer qu’il n’y aura plus ou peu d’indications à la parathyroïdectomie chirurgicale (car ce geste sera remplacé par l’administration de calcimimétiques), il faudra être attentif car d’autres perturbations du métabolisme osseux pourraient être induites par ces produits. Les possibilités d’induire une ostéopathie adynamique ou une autre maladie osseuse à bas remodelage par une suppression trop importante de la sécrétion de PTH paraissent minimes, les calcimimétiques oraux provoquant une baisse intermittente de la PTH qui pourrait avoir un effet anabolisant sur l’os. |
Footnotes |
1. Brown EM, Gamba G, Riccardi D, et al. Cloning and characterization of an extracellular Ca2+-sensing receptor from bovine parathyroid. Nature 1993; 366 : 575–80. 2. De Luca F, Baron J. Molecular biology and clinical importance of the Ca2+-sensing receptor. Curr Opin Pediatr 1998; 10 : 435–40. 3. Pearce S, Steinmann B. Casting new light on the clinical spectrum of neonatal severe hyperparathyroidism. Clin Endocrinol 1999; 50 : 691–3. 4. Nemeth EF. Pharmacological regulation of parathyroid hormone secretion. Curr Pharm Des 2002; 8 : 2077–87. 5. Nemeth EF, Steffey ME, Hammerland LG, et al. Calcimimetics with potent and selective activity on the parathyroid calcium receptor. Proc Natl Acad Sci USA 1998; 95 : 4040–5. 6. Ye C, Kanazirska M, Quinn S, et al. Modulation by polycationic Ca2+-sensing receptor agonists of nonselective cation channels in rat hippocampal neurons. Biochem Biophys Res Commun 1996; 224 : 271–80. 7. Fox J, Lowe SH, Petty BA, Nemeth EF. NPS R-568 : a type II calcimimetic compound that acts on parathyroid cell calcium receptor of rats to reduce plasma levels of parathyroid hormone and calcium. J Pharmacol Exp Ther 1999; 290 : 473–9. 8. Heath H, Sanguinetti E, Oglesby S, Marriott T. Inhibition of parathyroid hormone secretion in vivo by NPS 5-568, a calcimimetic drug that targets the parathyroid cell-surface calcium receptor. Bone 1995; 16 : S85. 9. Lalonde RL, Gaudreault J, Karhu DA, Marriott TB. Mixed-effects modeling of the pharmacodynamic response to the calcimimetic agent R-568. Clin Pharmacol Ther 1999; 65 : 40–9. 10. Igarashi T, Ogata E, Maruyama K, Fukuda T. Effect of calcimimetic agent, KRN568, on gastrin secretion in healthy subjects. Endocrinol J 2000; 47 : 517–23. 11. Silverberg SJ, Bone HG, Marriott TB, et al. Short-term inhibition of parathyroid hormone secretion by a calcium-receptor agonist in patients with primary hyperparathyroidism. N Engl J Med 1997; 337 : 1506–10. 12. Shoback DM, Bilezikian JP, Turner SA, et al. The calcimimetic cinacalcet normalizes serum calcium in subjects with primary hyperparathyroidism. J Clin
Endocrinol Metab 2003; 88 : 5644–9. 13. Collins MT, Skarulis MC, Bilezikian JP, et al. Treatment of hypercalcemia secondary to parathyroid carcinoma with a novel calcimimetic agent. J Clin Endocrinol Metab 1998; 83 : 1083–8. 14. Wada M, Furuya Y, Sakiyama J, et al. The calcimimetic compound NPS R-568 suppresses parathyroid cell proliferation in rats with renal insufficiency. Control of parathyroid cell growth via a calcium receptor. J Clin Invest 1997; 100 : 2977–83. 15. Wada M, Ishii H, Furuya Y, et al. NPS R-568 halts or reverses osteitis fibrosa in uremic rats. Kidney Int 1998; 53 : 448–53. 16. Wada M, Nagano N, Furuya Y, et al. Calcimimetic NPS R-568 prevents parathyroid hyperplasia in rats with severe secondary hyperparathyroidism. Kidney Int 2000; 57 : 50–8. 17. Chin J, Miller SC, Wada M, et al. Activation of the calcium receptor by a calcimimetic compound halts the progression of secondary hyperparathyroidism in uremic rats. J Am Soc Nephrol 2000; 11 : 903–11. 18. Fox J, Lowe SH, Conklin RL, Nemeth EF. The calcimimetic NPS R-568 decreases plasma PTH in rats with mild and severe renal or dietary secondary hyperparathyroidism. Endocrine 1999; 10 : 97–103. 19. Ishii H, Wada M, Furuya Y, et al. Daily intermittent decreases in serum levels of parathyroid hormone have an anabolic-like action on the bones of uremic rats with low-turnover bone and osteomalacia. Bone 2000; 26 : 175–82. 20. Antonsen JE, Sherrard DJ, Andress DL. A calcimimetic agent acutely suppresses parathyroid hormone levels in patients with chronic renal failure. Kidney Int 1998; 53 : 223–7. 21. Akizawa T, Suzuki M, Tominaga Y, et al. Acute effect of calcimimetic agent (CA) on hemodialysis (HD) patients with secondary hyperparathyroidism (2HPT). J Am Soc Nephrol 1998; 9 : 561A. 22. Goodman WG, Frazao JM, Goodkin DA, et al. A calcimimetic agent lowers plasma parathyroid hormone levels in patients with secondary hyperparathyroidism. Kidney Int 2000; 58 : 436–45. 23. Goodman WG, Hladik GA, Turner SA, et al. The calcimimetic agent AMG 073 lowers plasma parathyroid hormone levels in hemodialysis patients with secondary hyperparathyroidism. J Am Soc Nephrol 2002; 13 : 1017–24. 24. Coburn J, Barri Y, Turner S, et al. Single doses of the calcimimetic AMG-073 reduce parathyroid hormone levels in a dose dependent manner in hemodialysis patients with secondary hyperparathyroidism. J Am Soc Nephrol 2000; 11 : 573A. 25. Lindberg J, Moe S, Goodman W, et al. The calcimimetic AMG-073 reduces parathyroid hormone (PTH), phosphorus and calcium x phosphorus product in secondary hyperparathyroidism. J Am Soc Nephrol 2003; 63 : 248–54. 26. Drueke T, Cunningham J, Goodman W, et al. Short-term treatment of secondary hyperparathyroidism (SHTP) with the calcimimetic agent AMG 073. J Am Soc Nephrol 2001; 12 : 764A. 27. Quarles L, Spiegel D, Curzi M, et al. The effects of one-year treatment with the calcimimetic AMG-073 on bone health in ESRD patients with secondary hyperparathyroidism (SHPT). J Am Soc Nephrol 2002; 13 : 572A. 28. Chertow G, Danese M, McCary L, Turner S. Self-reported cognitive functioning in hemodialysis patients with secondary HPT : the effect of the calcimimetic AMG-073. J Am Soc Nephrol 2002; 13 : 633A. 29. Block GA, Martin KJ, de Francisco ALM, et al. Cinacalcet for secondary hyperparathyroidism in patients receiving hemodialysis. N Engl J Med 2004; 350 : 1516–25. 30. Gowen M, Stroup G, Dodds R, et al. Antagonizing the parathyroid calcium receptor stimulates parathyroid hormone secretion and bone formation in osteopenic rats. J Clin Invest 2000; 105 : 1595–604. |