Depuis plus de 40 ans, on admet que les ADN polymérases ne contiennent que deux brins d’ADN dans leur centre actif : le brin modèle et le brin en cours de synthèse.
Nous montrons dans ce travail qu’à partir d’une amorce formant une triple hélice, il est possible de répliquer de l’ADN en double brin si une certaine instabilité est localisée à proximité du site d’initiation de la réplication. Par conséquent, les ADN polymérases peuvent accomoder transitoirement trois brins d’ADN au lieu de deux comme cela est communément admis. Les conséquences portent à la fois sur les systèmes de réparation, voire des mécanismes de réarrangements de l’ADN. Des hypothèses évolutives sur la structure des amorces permettant l’initiation de la réplication sont aussi proposées.
La longue course pour la détermination de la structure de l’ADN, débutée il y a un peu plus de 50 ans, a été marquée par des erreurs d’interprétation de modèles tels celui de Linus Pauling qui proposa une triple hélice hélicoïdale avec les groupements phosphates au centre de la molécule. En revanche, le dénouement, qui mit du temps à se faire admettre par la communauté scientifique, eut lieu avec l’aide des clichés de diffraction des rayons X effectués par Rosalind Franklin dans le laboratoire de Maurice Wilkins à Cambridge, et interprétés avec intuition et justesse par Jim Watson et Francis Crick [ 1]. Néanmoins, des triples hélices ont été mises en évidence en 1957 par Alex Rich et ses collaborateurs [ 2] à l’aide d’un simple spectrophotomètre. En effet, la titration d’oligonucléotides de taille définie a montré que, pour un brin riche en poly(A), deux brins en poly(U) pouvaient former un complexe ternaire, probablement par l’interaction du 3e brin dans le grand sillon de l’ADN formé du duplexe (A-U).
Pendant ce temps, Arthur Kornberg tentait d’élucider les mécanismes de réplication qui posaient de sérieux problèmes topologiques. Depuis l’ensemble de ses travaux, il est communément admis que des activités hélicases séparent la double hélice, et qu’une amorce, en général oligonucléotidique, s’apparie avec le simple brin. Les ADN polymérases incorporent alors à l’extrémité de l’amorce des désoxyribonucléotides monophosphates reliés par des liaisons phosphodiester complémentaires du brin à répliquer, formant ainsi une copie de la molécule en double brin initiale, permettant la transcription et la synthèse de protéines au niveau des ribosomes grâce à des adaptateurs, les ARN de transfert.
Un problème difficile à concilier avec ce modèle concernait sa réplication, et ce n’est que grâce aux travaux pionniers d’Arthur Kornberg qu’une image progressive se dégagea [ 3]. La détermination de la structure cristallographique de différentes ADN polymérases montra leur ressemblance au niveau de leur mécanisme assuré par trois acides aminés et des cations métalliques ; il en est de même pour les ARN polymérases (Figure 1) [ 4].Les ADN polymérases allongent une amorce oligonucléotidique et répliquent le simple brin modèle par l’incorporation de désoxynucléotides monophosphates complémentaires des bases exposées de l’ADN en simple brin [ 5] et, par conséquent, on admet qu’elles ne contiennent dans leur centre catalytique que le simple brin à répliquer et l’amorce en cours de synthèse.
| Figure 1.
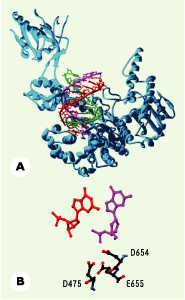
Représentation du complexe entre l’ADN polymérase du phage T7, d’après les données cristallographiques, et le complexe d’initiation comportant la triple hélice. La séquence de la triple hélice a été obtenue à partir des données cristallographiques, celles-ci étant représentées en rouge sur la figure. Le brin homologue est représenté en magenta, et le brin modèle à répliquer en vert. Les principaux acides aminés du centre catalytique sont représentés (Asp 475, Asp 654, Glu 655) ainsi que les bases terminales (didésoxyadénosine pour le brin amorce à ne pas répliquer en magenta, et en rouge pour l’extrémité 3’ de la désoyriboguanosine de l’amorce formant la triple hélice (d’après [5] avec la permission d’Oxford University Press). |
Nous avons démontré que, contrairement aux données connues, une séquence riche en poly d(G) formant une triple hélice peut servir d’amorce à la réplication dans une configuration non canonique par rapport aux données des différentes publications. En effet, cette amorce est parallèle au brin homologue, tandis qu’en règle générale elle est antiparallèle [ 6]. La réplication initiée à partir de l’amorce en triple brin avait été effectuée sur de l’ADN simple brin, conformément aux données de la littérature.
Cependant, dans une seconde étape, nous avons utilisé un ADN en double brin comme modèle et nous avons étudié sa réplication à partir de l’amorce en triple hélice. Contrairement à ce qui est connu depuis 40 ans, nous avons démontré que la réplication a lieu si une certaine instabilité est localisée à proximité du complexe d’initiation de la réplication, même à 5 nucléotides en amont de ce complexe de réplication [ 7].
Ces observations nouvelles signifient que les ADN polymérases peuvent rompre les liaisons hydrogènes formant les paires de bases situées en amont du complexe de réplication, et ne nécessitent donc pas toujours une activité hélicase de déroulement des brins. Elles démontrent pour la première fois que les ADN polymérases peuvent accomoder transitoirement 3 brins d’ADN dans leur centre catalytique, contre 2 dans les conditions communément admises [7].
Ces résultats montrent aussi que si une ADN polymérase est associée à une séquence capable de former une triple hélice, elle peut s’associer à une séquence homologue, et envahir un ADN double brin si une certaine instabilité est présente à proximité du site d’initiation ; celle-ci peut être due à une variation de la superhélicité de l’ADN, ou liée à une mutation, ou à l’action de protéines.
Ce nouveau mécanisme pourrait aussi rendre compte de réarrangements génomiques, sans coupure de brins ; il pourrait être à l’origine de la dernière étape de la recombinaison homologue lors de la phase de réplication.
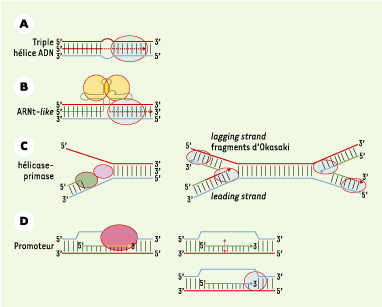
Concernant l’évolution des amorces de réplication, un schéma récapitule les différentes étapes où, contrairement à ce qui est couramment admis, l’ADN en triple hélice - moins stable que la complémentarité avec l’ARN, mais celui-ci étant beaucoup plus instable biochimiquement - pourrait avoir initié la réplication dans des systèmes anciens, comme l’indique la Figure 2.
| Figure 2.
Évolution possible du système d’initiation de la réplication dans différents systèmes biologiques. A. Modèle proposé pour l’initiation de la réplication à partir d’une triple hélice. B. Compte tenu de la stabilité supérieure de l’ARN capable de déplacer l’ADN, notre schéma prévoit dans une deuxième étape l’initiation de la réplication à partir d’une triple hélice ARN. Il est cependant généralement admis que le monde à ARN a précédé celui du monde à ADN, et certaines structures en forme d’ARNt (extrémité de certains ARN viraux, ou initiation de la réplication de l’ADN mitochondrial des mammifères) pourraient débuter après synthèse d’une amorce rappelant les structures en forme d’ARNt. Ces structures sont néanmoins moins stables biochiquement que l’ADN. C. Le système actuel le plus évolué implique la séparation de brins au moyen d’une activité hélicase, séparant chaque brin sur lequel se fixe l’amorce oligonucléotique. L’activité primase permet de former des fragments d’Okazaki pour la réplication du brin complémentaire de polarité 3’ vers 5’ (lagging strand). D. Bien que les données actuelles ne soient pas certaines, il est possible qu’à partir d’un promoteur, une RNase libère une extrémité 2’ 3’ OH capable d’être allongée par les ADN polymérases. |