La sténose hypertrophique du pylore est un accident relativement fréquent chez le nourrisson de race blanche (1,5/1 000 naissances), à prédominance masculine nette (4 :1). C’est la cause la plus fréquente de chirurgie au cours de la première année de vie. L’hypertrophie musculaire qui en est responsable ne se développe que dans les semaines qui suivent la naissance et les troubles sont très vite améliorés par une pyloromyotomie. Des études familiales ont, depuis longtemps, fait suspecter une composante génétique [ 1]. Ce spasme du pylore avec défaut de relaxation avait, par ailleurs, fait envisager un déficit en monoxyde d’azote (NO) dont le rôle comme médiateur de relaxation au niveau du tube digestif est connu. Les premiers arguments indirects en faveur de ce déficit remontent à 1992 [ 2]. L’hypothèse a été confirmée plus récemment par un premier travail effectué sur des biopsies chirurgicales prélevées chez six nourrissons et comparées à des prélèvements témoins effectués à différents niveaux du tube digestif. De fait, les auteurs ont montré dans les prélèvements de sténose une diminution significative du transcrit de la NO-synthase neuronale (NOS1 ou nNOS) [ 3].
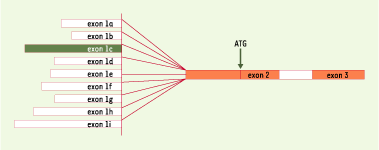
À la même époque, les études de structure et de régulation de ce gène nNOS avaient montré sa régulation extrêmement complexe, l’expression, hétérogène en raison d’épissages alternatifs du transcrit, étant fonction des tissus et du stade de développement [ 4]. Un travail majeur, fruit d’une collaboration entre l’Université de Toronto (Canada) et l’Université Emory d’Atlanta (Georgia, USA), mettait en évidence la très grande diversité de traduction de la nNOS humaine [ 5]. Cette régulation, d’une complexité exceptionnelle, s’effectue à différents niveaux. Un premier niveau est l’usage alternatif de promoteurs multiples, ce qui affecte la localisation de l’initiation de transcription, et donc la séquence et la structure de l’ARNm. C’est ainsi que neuf variants d’un premier exon non traduit ont été mis en évidence, tous épissés au même exon 2, porteur du codon ATG initiateur de la traduction (Figure 1). La spécificité tissulaire est attestée par l’observation du groupement des variants en fonction des tissus où ils s’expriment ; un groupe associe ceux qui sont exprimés dans les muscles squelettiques, l’autre ceux dont l’expression est enrichie dans les neurones. Un deuxième niveau de régulation se situe au niveau de la maturation de l’ARN. Deux anomalies d’épissage, au moins, ont été constatées : d’une part, l’existence d’un exon surnuméraire de 89 nt entre l’exon 1 non traduit et l’exon 2, et, d’autre part, une délétion fréquente dans un exon 2 de taille inhabituelle (1145 nt), entre deux introns également très étendus. Cette dernière délétion, spécifique de tissu et du promoteur, devrait se traduire par des modifications de structure au niveau protéique. Un troisième niveau de variabilité, enfin, concerne la traduction, puisque les séquences leader non traduites varient entre 489 et 1033 nt. Ces longueurs, supérieures à la moyenne, et leur diversité, avaient fait supposer que l’extrémité 5’ du transcrit pourrait intervenir de façon importante dans la régulation de la traduction, expliquant ainsi les différences observées dans les expériences de traduction in vitro avec un gène rapporteur luciférase. Une telle complexité de régulation de ce gène de 240 kb devait forcément retentir sur la fonction de la protéine : l’hypothèse avait été émise selon laquelle les inégalités de longueur de l’exon 1 devaient altérer des sites de fixation protéique, et sans doute retentir sur des voies de signalisation. La production d’une protéine à partir d’ARNm variables, qui ont utilisé divers promoteurs d’efficacité différente, devait aussi intervenir sûrement dans la physiopathologie et la réponse tissulaire.
Au cours d’un travail légèrement postérieur, en effet, une équipe allemande, de Munich, mettait en évidence la présence de variants d’épissage dans des prélèvements effectués à différents niveaux du tube digestif [ 6]. C’est ce même groupe de chercheurs qui a récemment poursuivi l’étude de l’expression de la NO-synthase neuronale dans la sténose hypertrophique du pylore chez le nourrisson et démontré le mécanisme moléculaire à l’origine de cette maladie [ 7]. Les auteurs ont d’abord identifié une réduction de l’ordre de 88 % des transcrits de la NO-synthase dans des échantillons de pylore sténosé en comparaison avec des pylores normaux (p < 0,001). Le déficit quantitatif en ARNm, la diminution relative des neurones exprimant la nNOS qui s’ensuit, entraînent une hypertrophie et une hyperplasie des muscles lisses. L’étape suivante a été la détermination des promoteurs utilisés chez les patients et chez des témoins. Chez ces derniers, deux variants de l’exon 1, 1c et 1f, ont des taux d’expression similaires, alors que dans les cas de sténose hypertrophique, l’effondrement des transcrits, s’il est global, porte majoritairement sur l’exon 1c, variant prédominant en particulier dans les neurones. La séquence de cet exon 1c a été entreprise, et comparée à celle de l’exon 1c de 72 ADN témoins. Trois mutations différentes ont été identifiées chez trois patients différents. Mais, surtout, une mutation au niveau du promoteur (-84G’A) a été observée chez 10/16 patients (2 fois à l’état homozygote, 10 fois à l’état hétérozygote), alors qu’elle n’existe chez aucun témoin (p = 0,014).
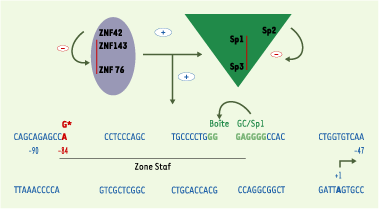
Pour essayer de relier ce polymorphisme aux troubles fonctionnels, les auteurs sont revenus à une étude fonctionnelle de différents promoteurs de la nNOS qu’ils avaient faite antérieurement dans des lignées cellulaires [ 8]. L’exon 1c quantitativement majoritaire avait été cloné et séquencé, le promoteur minimal, riche en GC et dénué de boîte TATA identifié. Les auteurs avaient, de plus, mis en évidence, en amont de ce promoteur minimal, entre - 90 et - 47, une zone paraissant importante par son extrême conservation dans l’évolution des espèces (homologie de 100 % du rat à l’homme). La séquence nucléotidique de cette zone, appelée Staf, montrait son implication dans la fixation coopérative de plusieurs facteurs de transcription, membres de la famille Sp1 et ZNF (Figure 2). Différentes mutations de cette séquence consensus modifiaient le taux d’expression observé : abolition complète quand la boîte GC, fixant Sp1, était mutée, réduction d’environ 53 % par mutation du motif Staf. Or, c’est dans cette zone que les auteurs ont constaté, en cas de sténose du pylore, le polymorphisme -84G’A. L’hypothèse physiopathologique, quoique dans l’incertitude de l’événement initial, est alors celle d’une réduction massive du transcrit prédominant (exon 1c) qui, malgré une augmentation relative d’un exon 1f vicariant, entraîne une diminution globale de l’expression de nNOS et de la libération de NO. L’hypertrophie musculaire, le défaut de relaxation des sphincters, apparaissent comme des conséquences de ce déficit en NO, et, sans doute, de la cascade de signalisation NO/cGMP/cGMP-kinase. Par l’utilisation d’un promoteur de substitution, le gène nNOS serait-il capable progressivement d’exprimer une quantité suffisante d’ARNm pour une évolution favorable ? La survenue de troubles digestifs au cours de la première enfance, à une période où une nutrition satisfaisante est requise, rend actuellement l’option chirurgicale sûrement préférable.
| Figure 2. Interactions protéines-protéines au niveau du promoteur minimal du gène NOS-1. Le promoteur minimal du gène nNOS-1 (localisé entre -90 et 47 par rapport au site d’initiation de la transcription de l’exon 1c) est porteur d’un site de fixation (boîte GC) pour les facteurs de transcription de la famille Sp1. Parmi ceux-ci, seuls Sp1, Sp3 et Sp4 sont capables d’interagir avec le site de fixation. Sp1 et sp3 ont un effet d’activation de la transcription additif, alors que Sp2 agit plutôt en réprimant l’effet de Sp1. Le deuxième groupe de protéines activatrices est celui des facteurs ZNF : ZNF42, ZNF76, ZNF143. Alors que ZNF76 potentialise les effets activateurs de Sp1 et Sp3, ZNF143 présente un effet additif à celui de Sp1, effet non observé avec Sp3. ZNF42 aurait un effet répresseur sur la transactivation, relayé par ZNF76, ZNF143 et Sp1. La mutation trouvée en –84 interférerait avec ces interactions. |