| |
| Med Sci (Paris). 2004 August; 20(8-9): 737–740. Published online 2004 August 15. doi: 10.1051/medsci/2004208-9737.Boîtes quantiques en biologie : progrès récents Benoît Dubertret* ESPCI, Laboratoire d’Optique physique, CNRS UPR A0005, 10, rue Vauquelin, 75005 Paris, France MeSH keywords: Biologie, Boîtes quantiques |
Les boîtes quantiques (quantum dots ou QD) sont des cristaux de semi-conducteurs de forme sphérique dont les dimensions ne dépassent pas quelques nanomètres. Comme nous l’avons déjà discuté dans médecine/sciences [
1], ces QD ont des propriétés optiques hors du commun (très bonne résistance au photoblanchiment et possibilité de visualiser plusieurs couleurs simultanément) qui en font des sondes fluorescentes très intéressantes pour certaines applications en biologie. L’interface QD-biologie est un domaine relativement jeune qui se développe rapidement. Nous en donnons ici un aperçu des progrès récents. On distinguera deux types de travaux : ceux qui sont effectués avec des QD disponibles commercialement et ceux qui développent des applications de QD non commerciaux.
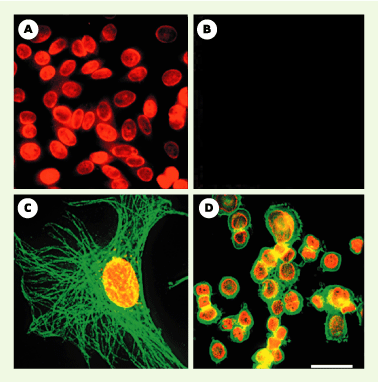
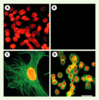 | Figure 1.Détection d’antigènes nucléaires et double marquage. A. Antigènes nucléaires dans le noyau de cellules épithéliales humaines marquées avec des anticorps anti-nucléaires (AAN), des immunoglobulines (IgG)-biotine anti-IgG humaines et des Qdots® 630 liés à de la streptavidine. B. Lorsque des IgG humaines normales sont utilisés à la place des AAN, aucun marquage n’est observé. C. Noyau d’une cellule 3T3 marqué avec des AAN, des IgG-biotine anti-IgG humaines et des Qdots® 630-streptavidine (rouge). Les microtubules sont marqués avec de l’anticorps anti-a-tubuline de souris et des Qdots® 535-streptavidine (vert). D. Her2 sur la surface de cellules SK-BR-3 marquées en vert avec des anticorps anti-Her2 et des Qdots® 535-IgG. Les antigènes nucléaires sont marqués avec des AAN, des IgG-biotine anti-IgG humaines et des QD 630-streptavidine (rouge). Jeux de filtres : longueur d’onde d’excitation 480 ± 20 nm/longueur d’onde d’émission 535 ± 10 nm et longueur d’onde d’excitation 560 ± 27,5 nm/longueur d’onde d’émission 635 ± 10 nm ont été utilisées pour détecter les QDots® 535 et 630 ; longueur d’onde d’excitation 460 SP/longueur d’onde d’émission 500 LP ont également été utilisées pour l’observation. Étalon : 50 mm pour A, B et D ; 10 mm pour C. SP : short pass ; LP : long pass (images reprises de [
2] avec la permission de X.Y. Wu). |
|
Utilisation de QD commerciaux Deux start-up américaines (Quantum Dot Corporation® et Evident Technology®) se partagent pour l’instant le marché des QD solubles dans l’eau. Quantum Dot Corporation® (la première sur le marché fin 2002) utilise des copolymères bloc amphiphiles formés d’acides polyacryliques modifiés avec des chaînes alkyle C8 pour encapsuler les QD et y accrocher des macromolécules. Ces QD (appelés Qdots®) ont été utilisés dans plusieurs travaux. Ainsi, dans le cancer du sein, X.Y. Wu et al. [2] ont montré que les Qdots® liés à la streptavidine ou aux immunoglobulines pouvaient être utilisés pour la détection spécifique de Her2 à la surface de cellules fixées ou de cellules vivantes. Ils les ont également utilisés pour le marquage de microtubules ou de fibres d’actine dans le cytoplasme, et la détection d’antigènes nucléaires dans le noyau. Dans ces expériences, la comparaison avec les fluorophores[1] organiques est extrêmement favorable aux QD qui résistent bien mieux au photoblanchiment et sont plus « brillants ». Cette « brillance » est liée à une excellente section efficace d’absorption (rapport entre l’énergie absorbée et le flux d’énergie reçu) comparée à celle des fluorophores organiques et à un bon rendement quantique (rapport entre le nombre de photons absorbés et le nombre de photons émis ; ce rapport est de l’ordre de 40 % pour les QD solubles dans l’eau). Quelques mois plus tard, M.Dahan et al. [
3] ont utilisé les Qdots® modifiés avec de la streptavidine pour suivre, individuellement, les déplacements de récepteurs de glycine (RGly) et analyser leur mouvement latéral dans la membrane de cellules vivantes pour des périodes variant de quelques millisecondes à quelques minutes. Les constantes de diffusion des RGly marqués avec des QD diffèrent en fonction de la localisation des RGly (synaptique, périsynaptique ou extrasynaptique). L’entrée par diffusion des RGly marqués avec des Qdots® dans la synapse a été observée en fluorescence et confirmée par microscopie électronique de transmission. L’observation de QD individuels a fait l’objet de nombreux travaux en physicochimie. Ce travail confirme qu’avec les QD solubles dans l’eau, il est également possible de suivre des molécules individuelles. Dans ce domaine aussi, les QD offrent de nombreux avantages par rapport aux fluorophores organiques classiques, mais une des limitations importantes vient du clignotement intrinsèque de l’émission fluorescente des QD. Récemment cependant, une équipe américaine a montré que l’ajout d’une petite quantité de b-mercaptoéthanol à une solution de Qdots® réduisait considérablement, voire supprimait, le clignotement des QD [
4]. L’hypothèse la plus probable étant que les petites molécules de b-mercaptoéthanol diffusent au travers de la couche de polymères entourant le QD et se fixent par leur soufre à leur surface (voir [4] pour plus de détails). Dans les systèmes où l’on peut utiliser des concentrations de 1 mM de b-mercaptoéthanol, il serait donc possible de suivre individuellement des QD sans être gêné par les problèmes de clignotement. Les Qdots® ont également été utilisés pour étudier la famille de récepteurs transmembranaires à activité tyrosine kinase (RTK) erbB/HER [
5], responsables des réponses cellulaires à l’EGF (epidermal growth factor). En attachant des molécules d’EGF biotinylées sur des QD-streptavidine, on peut observer en fluorescence dans des cellules vivantes les premières étapes de la signalisation via les RTK, une fois les EGF-QD liés aux récepteurs. Cette activation se traduit par une internalisation rapide des QD dans les endosomes dont la dynamique peut ensuite être suivie. Grâce à la bonne photostabilité des QD-streptavidine-EGF, les auteurs ont pu identifier une nouvelle forme de transport rétrograde vers le corps de la cellule lorsque les QD-streptavidine-EGF sont accrochés à un récepteur erbB1 exprimé sur un filopode. En comparant le taux et l’importance de l’endocytose des QD-EGF liés aux récepteurs erbB1 avec ceux de protéines fluorescentes jaunes monomériques liées au récepteur erbB2 et ceux de la citrine monomérique liée au récepteur erbB3, D.S. Lidke et al. ont pu montrer que erbB2 mais pas erbB3 formait des hétérodimères avec erbB1 après stimulation avec l’EGF [5]. |
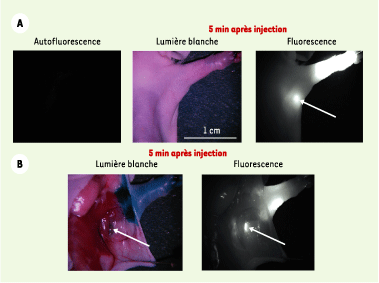
Développement de nouveaux QD pour une application biologique Ce domaine de recherche est encore très jeune et beaucoup de travail reste à faire pour trouver les QD, la technique d’encapsulation et la chimie de surface optimum pour chaque application. Ainsi, l’équipe de M. Bawendi a mis au point des QD de type II (CdTe/CdSe) émettant dans l’infrarouge proche aux alentours de 850 nm. La fenêtre de longueur d’onde 700 nm-900 nm, encore appelée fenêtre thérapeutique, correspond à une plage de longueurs d’onde optimisée pour l’imagerie biomédicale (faible absorption et fluorescence endogène faible). Avec une source laser de 5 mW/cm2 à 770 nm, des QD solubles dans l’eau (rayon hydrodynamique entre 15 et 20 nm) et une injection intradermique de 400 pmole de QD dans un porc de 35 kg, le chirurgien est capable de suivre en temps réel la diffusion des QD dans le système lymphatique et leur agglutination dans un ganglion sentinelle (profondeur moyenne sous la peau de 1 cm). Les auteurs [
6] montrent que l’ablation d’un ganglion sentinelle est grandement améliorée grâce à cette technique (Figure 2). La dose de QD injectée dans le porc pour cette expérience correspond à 9,9 mg/kg de cadmium. D’après les au-teurs, cette dose est inférieure de 300 fois à la dose de cadmium qui, injectée de façon journalière, cause des problèmes de toxicité rénale chez la souris.
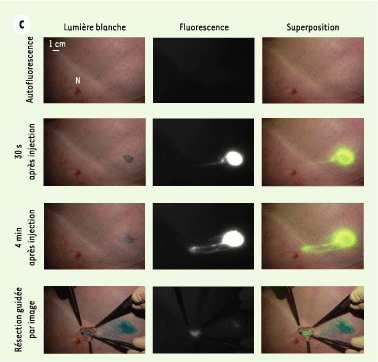
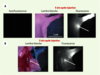 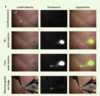 | Figure 2.Localisation des ganglions lymphatiques chez le porc et la souris à l’aide de QD émettant dans l’infrarouge proche. A. Dix pmoles de QD ont été injectés dans la patte gauche d’une souris par voie intradermique. À gauche, image d’auto fluorescence avant l’injection ; au centre image en lumière blanche cinq min après l’injection ; à droite, image en fluorescence 5 min après l’injection. Une flèche indique l’endroit pressenti de la localisation du ganglion sentinelle auxiliaire. Les images de fluorescence ont le même temps d’exposition et ont subi la même normalisation. B. Images de la même souris qu’en A 5 min après la réinjection de 1 % de bleu isosulfan. À gauche, image couleur, à droite, image en fluorescence. Le bleu isosulfan et les QD sont localisés dans le même nœud lymphatique (flèche). C. Images du champ chirurgical d’un porc ayant reçu 400 pmoles de QD dans l’aisselle droite par voie intradermique. Quatre séries d’images sont montrées séquentiellement de haut en bas : avant l’injection (autofluorescence), 30 s après l’injection, 4 min après l’injection et pendant la dissection. Chaque série d’images comprend une image en lumière blanche (à gauche), une image en fluorescence (centre), et une superposition des deux images (droite). Pour la construction de l’image superimposée, la fluorescence a été pseudo-colorée en vert. Les temps d’exposition et les normalisations des images sont identiques. Un téton (N) est indiqué (images reprises de [ 6] avec la permission de J.V. Frangioni). |
Un autre travail effectué avec des QD non commerciaux concerne l’utilisation de nanocristaux dans des applications de FRET (fluorescence resonance energy transfer) (‹) avec un fluorophore organique. (‹) m/s 2001, n° 12, p. 1322
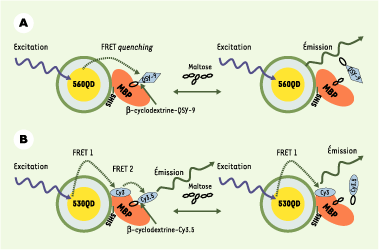
Pour démontrer les potentiels des QD dans cette application, I.L.Medintz et al. [
7] utilisent des « QD cœur/coque » (CdSe/ZnS) solubilisés dans l’eau avec de l’acide dihydrolipoïque (ce qui revient à avoir des QD avec une couverture d’acide carboxylique) qu’ils recouvrent ensuite de protéines (modifiées avec 5 histidines en carboxyterminal) ayant une bonne affinité pour le maltose (MBP) obtenues de Escherichia coli (Figure 3A). Lorsque les QD recouverts de MBP sont mis en présence de b-cyclodextrine (b-CD) conjuguée à un fluorophore (le QSY9, jouant le rôle d’accepteur), le b-CD vient se loger sur le site d’accrochage du maltose induisant une diminution de la fluorescence du QD par transfert d’énergie. Avec 10 MBP-b-CD par QD, les QD perdent 50 % de leur fluorescence. Les QD retrouvent toute leur fluorescence lorsqu’un excès de maltose (qui peut déplacer le b-CD) est ajouté en solution. Un système plus complexe de FRET en deux étapes a également été mis en place (Figure 3B). Dans ce cas, les molécules MBP-5 histidines ont été conjuguées avec un colorant (le Cy3) avant d’être assemblées autour des QD (environs 10MPB-Cy3 molécules par QD). Ensuite un b-CD couplé à un Cy3,5 est introduit en solution et vient se loger sur le site d’accrochage du maltose. Les mesures de fluorescence sur ce système modèle indiquent que 75 % de l’énergie émise par le QD est absorbée par les Cy3 et 20 % de l’énergie reçue par les Cy3,5 provient de l’émission des QD, soit directement (6 %), soit indirectement (14 %) par l’intermédiaire des 10 colorants Cy3 avoisinants.
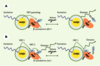 | Figure 3.Développement de nouveaux quantum dots. A. Schéma du nanosenseur MBP-QD560. Chaque QD (émettant à 560 nm) est entouré par 10 MBP en moyenne ; une seule MBP est représentée par souci de clarté. La formation du complexe QD-MBP-b-CD-QSY9 (maximum d’absorption à 565 nm) se traduit par un quenching de l’émission des QD. L’ajout de maltose produit un départ du b-CD-QSY9 du complexe qui se traduit par une augmentation de la fluorescence du QD. B. Schéma du nanosenseur de maltose QD530-MBP-Cy3-b-CD-Cy3,5. Un QD émettant à 53 nm est entouré d’environ dix MBP (une seule MBP est représentée par souci de clarté). Chaque MBP est marquée sur la cystéine 95 avec un Cy3 (maximum d’absorption 556 nm, maximum d’émission 570 nm). Le complexe est complété avec des b-CD-Cy3,5 qui viennent s’accrocher de façon spécifique dans la poche ayant une bonne affinité pour le maltose. L’émission du QD produit par FRET une excitation du Cy3 logé sur le MBP. Le Cy3 quant à lui excite par FRET le Cy3,5 du b-CD. L’ajout de maltose déplace le b-CD-Cy3,5, ce qui se traduit par une augmentation de l’intensité d’émission du Cy3 (adapté de [ 7] avec la permission de H. Matoussi et J.M. Mauro). |
|
Footnotes |
1. Dubertret B. Un nouveau marqueur flurescent pour l’imagerie in vivo. Med Sci (Paris) 2003; 19 : 532–4. 2. Wu XY, Liu HJ, Liu J, et al. Immunofluorescent labeling of cancer marker Her2 and other cellular targets with semiconductor quantum dots. Nat Biotechnol 2003; 21 : 41–6. 3. Dahan M, Levi S, Luccardini C, et al. Diffusion dynamics of glycine receptors revealed by single-quantum dot tracking. Science 2003; 302 : 442–5. 4. Hohng S, Ha T. Near-complete suppression of quantum dot blinking in ambient conditions. J Am Chem Soc 2004; 126 : 1324–5. 5. Lidke DS, Nagy P, Heintzmann R, et al. Quantum dot ligands provide new insights into erbB/HER receptor-mediated signal transduction. Nat Biotechnol 2004; 22 :198–203. 6. Kim S, Lim YT, Soltesz EG, et al. Near-infrared fluorescent type II quantum dots for sentinel lymph node mapping. Nat Biotechnol 2004; 22 : 93–7. 7. Medintz IL, Clapp AR, Mattoussi H, et al. Self-assembled nanoscale biosensors based on quantum dot FRET donors. Nat Mater 2003; 2 : 630–8. |