Le terme autophagie englobe un ensemble de mécanismes cataboliques aboutissant à la dégradation de constituants cellulaires par le lysosome [ 1]. La découverte de la macro-autophagie, une des formes majeures de l’autophagie, est contemporaine de celle du lysosome par Christian de Duve [ 2]. La macro-autophagie, active à un niveau basal dans la plupart des cellules (prise en charge du renouvellement des protéines à durée de vie longue et de certains organites comme la mitochondrie), est stimulée en situation de stress ; ce processus représente un mécanisme de survie cellulaire et d’adaptation, par le recyclage - notamment des acides aminés - et l’élimination des macromolécules et des structures cellulaires altérées [ 3].
La découverte des gènes ATG (autophagy related genes), au milieu des années 1990, chez la levure Saccharomyces cerevisiae (pour revue, voir [ 4]) a été importante non seulement pour la dissection en termes moléculaires de la macro-autophagie mais aussi pour comprendre son importance en physiologie et physiopathologie [3]. Sur le plan cellulaire, la macro-autophagie débute par la formation d’une vacuole, l’autophagosome, qui séquestre de façon non sélective les constituants du cytoplasme. L’autophagosome est délimité par plusieurs feuillets lipidiques (en général quatre) dont l’origine est encore mal connue. Plusieurs compartiments cellulaires (réticulum endoplasmique, appareil de Golgi et réseau trans-golgien) et la membrane plasmique concourent probablement à la formation de l’autophagosome. Une quinzaine de protéines Atg, pour la plupart conservées de la levure à l’homme, sont nécessaires à sa biogenèse. À l’exception d’Atg9, ces protéines ne possèdent pas de domaine transmembranaire. Les protéines Atg, recrutées dans le cytoplasme, s’associent de façon transitoire avec la membrane pré-autophagosomale et à celle de l’autophagosome.
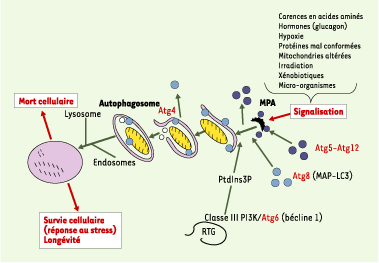
La formation de l’autophagosome repose essentiellement sur deux systèmes de conjugaison, similaires à l’ubiquitinylation et la sumoylation des protéines [ 5] (Figure 1). Le premier conjugué, formé des protéines Atg5-Atg12, permet le recrutement du deuxième qui résulte de la conjugaison en carboxyterminal de la protéine Atg8 (MAP-LC3 chez les mammifères) par la phosphatidyléthanolamine (PE). Le complexe Atg5-Atg12 est recyclé vers le cytosol avant la formation complète de l’autophagosome. La protéine Atg4 hydrolyse la liaison entre Atg8 et la PE. En conséquence de cette hydrolyse, seule une fraction du complexe Atg8-PE reste associée à la membrane interne de l’autophagosome constituant un marqueur spécifique de cet organite. La protéine Atg6 qui interagit avec la phosphatidylinositol 3-phosphate kinase (PI3K) de type III sur la membrane du réseau trans-golgien (Figure 1) est nécessaire à la formation de l’autophagosome, de même que le phosphatidylinositol 3-phosphate (PtdIns3P), produit de l’activité de la PI3K de type III [ 6]. Les rôles intimes d’Atg6 et du PtdIns3P dans la formation de l’autophagosome restent encore à élucider.
| Figure 1. Macroautophagie. Le conjugué protéique Atg5-Atg12, recruté à partir du cytoplasme, permet la conjugaison d’Atg8 (MAP-LC3) et de la phosphatidyléthanolamine sur la membrane pré-autophagosomale (MPA). La formation de l’autophagosome nécessite aussi la production de phosphatidylinositol 3-phosphate (PtdIns3P) par la phosphatidylinositol 3-phosphate kinase (PI3K) type III localisée probablement sur la membrane du réseau trans-golgien (RTG) où elle interagit avec la protéine bécline 1 (Atg6). Après formation de l’autophagosme, la plupart des protéines Atg sont recyclées vers le cytosol, à l’exception notable d’une fraction Atg8-phosphatidyléthanolamine, qui est un marqueur de l’autophagosome, insensible à la déconjugaison réalisée par Atg4 du fait de sa topologie membranaire. Après fusion avec des endosomes (précoces et/ou tardifs), le matériel séquestré dans l’autophagosome est digéré dans le lysosome (y compris la copule protéique du complexe Atg8-phosphatidyléthanolamine intravacuolaire). La macroautophagie est stimulée par divers signaux qui sont transduits le long de voies de signalisations dont la voie PI3K de type I/PKB/mTOR pour aboutir à la membrane autophagosomale. L’articulation exacte entre la signalisation et le déclenchement de la formation de l’autophagosome reste à mieux définir. |
La recherche de nouveaux partenaires de la protéine antiapoptotique bcl-2, par le criblage d’une banque d’ADNc de cerveau de souris, a conduit à l’identification de la bécline 1 (en anglais, beclin : becl du fait de son interaction avec bcl-2, le suffixe in en raison de la structure coiled-coil de la protéine) [ 7]. Cette protéine est, chez les organismes pluricellulaires, l’orthologue de la protéine Atg6 de levure [ 8].
Le gène beclin 1 est localisé sur le chromosome 17 (17q21) proche du locus du gène BRCA1, gène de susceptibilité aux cancers du sein et de l’ovaire [ 9]. Des délétions mono-alléliques du gène beclin 1 sont observées dans 40 % à 70 % des cancers spontanés du sein et de l’ovaire. Sa réintroduction dans des lignées cellulaires de carcinome mammaire réduit leur prolifération et leur pouvoir tumorigène ex vivo et in vivo après transplantation chez la souris athymique [8]. Son invalidation arrête précocement le développement embryonnaire chez la souris [ 10, 11]. En revanche, les souris beclin 1+/-, qui sont viables, développent plus fréquemment des tumeurs spontanées et induites dans de nombreux organes. De ces études, il ressort que beclin 1 est un gène suppresseur de tumeur et agit par un mécanisme d’haplo-insuffisance. Enfin, il a été montré que l’invalidation, par des ARN interférents, de l’expression de la bécline 1 diminuait la longévité de Caenorhabditis elegans [ 12]. L’invalidation d’autres produits des gènes ATG a un effet identique sur la longévité de ce nématode. La fonction d’élimination des macromolécules et organites endommagés, probablement par peroxydation, pourrait expliquer l’effet positif de la macro-autophagie sur la longévité [ 13, 14].
Un paradoxe de la macro-autophagie tient au fait que ce mécanisme d’adaptation et de survie est aussi associé à la mort cellulaire. Sur des bases morphologiques, la mort autophagique ou mort cellulaire programmée de type II a été distinguée, depuis de nombreuses années, de la mort apoptotique ou mort cellulaire programmée de type I au cours du développement des organismes pluricellulaires [ 15]. La découverte des gènes ATG fournit maintenant un support moléculaire au rôle de la macro-autophagie au cours du développement (études réalisées chez C. elegans, la drosophile, la souris) par sa capacité de remodelage tissulaire [14, 16]. La mort autophagique intervient aussi dans des circonstances autres que celles du développement, notamment dans divers contextes pathologiques et de stress. Elle est très probablement impliquée dans la mort des cellules de Purkinje dans un modèle murin de dégénérescence du cervelet due à des mutations dans le récepteur du glutamate d2, les souris Lurcher [ 17, 18]. Dans les cellules cancéreuses, la mort autophagique a été décrite en réponse à de nombreuses thérapies antitumorales [ 19]. Néanmoins, la distinction entre apoptose et mort autophagique n’est pas toujours aisée car des caractéristiques apoptotiques et autophagiques peuvent être observées dans la même cellule. Au cours de la mort par apoptose, des vacuoles autophagiques sont aussi fréquemment observées dans les cellules. Le rôle de la macro-autophagie dans ce contexte semble variable. En effet, différentes situations ont été observées où la macro-autophagie est soit un phénomène protecteur vis-à-vis de l’apoptose soit un événement proapoptotique [19]. De même, des acteurs de l’apoptose (les caspases) peuvent intervenir dans le déroulement d’une mort de type autophagique [ 20]. Cette relation moléculaire entre acteurs de l’apoptose et mort autophagique a récemment été soulignée par une étude montrant que l’inhibition de l’activité basale de certaines caspases (caspase-8) entraîne la cellule vers une mort autophagique interrompue par l’invalidation de l’expression des gènes ATG7 et beclin 1 [ 21]. En outre, ce travail suggère une grande prudence envers les propositions thérapeutiques visant à bloquer l’activité des caspases pour inhiber l’apoptose dans des pathologies où celle-ci est néfaste, car la cellule peut alors déclencher une mort autophagique. Une part de la complexité de la relation entre macro-autophagie et mort cellulaire tient probablement au fait que les deux phénomènes partagent des communautés moléculaires dont les spécificités propres nous échappent encore. Certaines voies de signalisation impliquées dans la survie cellulaire, comme la voie de signalisation comprenant la PI3K de type I, les kinases akt/PKB et mTOR le sont aussi dans le contrôle de l’autophagie [6]. Ce chevauchement entre les contrôles de l’autophagie et de l’apoptose a été récemment prolongé par l’implication d’acteurs reconnus de l’apoptose, le céramide [ 22], TRAIL (TNF-related apoptosis inducing ligand) et l’un de ses récepteurs [ 23], dans le contrôle de l’autophagie. De plus, comme cela a été décrit plus haut, la bécline 1 interagit avec des protéines de la famille de bcl-2 [7, 9].
La découverte récente des bases moléculaires de la macro-autophagie a mis en lumière son implication non seulement au cours de la progression tumorale [ 24], ou dans la mort neuronale associée à de nombreuses maladies neurodégénératives (maladies de Parkinson, d’Alzheimer et de Huntington) [ 25], mais aussi dans certaines formes de myopathies [ 26], dans la réponse immune innée et sa subversion par certains micro-organismes [ 27].
Malgré les avancées récentes dans la connaissance de ses contrôles moléculaires, nombre d’interrogations subsistent quant à la macro-autophagie, notamment sur l’origine de la membrane de l’autophagosome, les bases moléculaires de sa sélectivité vis-à-vis de certains organites, comme la mitochondrie, ses liens avec la prolifération et la croissance cellulaire et particulièrement les mécanismes expliquant le basculement de sa fonction vitale vers sa fonction fatale.