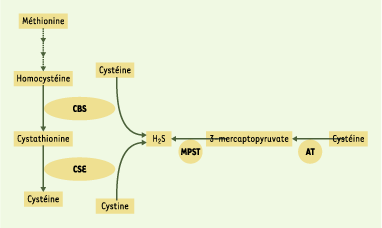
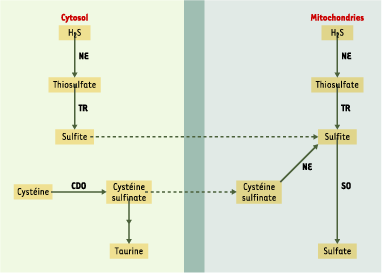
1.
Goodwin LR, Francom D, Dieken FP, et al. Determination of sulfide in brain tissue by gas dialysis/ion chromatography : Post-mortem studies and two case reports. J Anal Toxicol 1989; 13 : 105–9.
2.
Warenycia MW, Goodwin LR, Benishin CG, et al. Acute hydrogen sulfide poisoning : Demonstration of selective uptake of sulfide by the brainstem by measurement of brain sulfide levels. Biochem Pharmacol 1989; 38 : 973–81.
3.
Savage JC, Gould DH. Determination of sulfides in brain tissue and rumen fluid by ion-interaction reversed-phase high-performance liquid chromatography. J Chromatogr 1990; 526 : 540–5.
4.
Baranano DE, Ferris CD, Snyder SH. Atypical neural messengers. Trends Neurosci 2001; 24 : 99–106.
5.
Stipanuk MH, Beck PW. Characterization of the enzymic capacity for cysteine desulphhydration in liver and kidney of the rat. Biochem J 1982; 206 : 267–77.
6.
Stipanuk MH, De la Rosa J, Hirschberger LL. Catabolism of cyst(e)ine by rat renal cortical tubules. J Nutr 1990; 120 : 450–8.
7.
Coloso RM, Stipanuk MH. Metabolism of cyst(e)ine in rat enterocytes. J Nutr 1989; 119 : 1914–24.
8.
Abe K, Kimura H. The possible role of hydrogen sulfide as an endogenous neuromodulator. J Neurosci 1996; 16 : 1066–71.
9.
Watanabe M, Osada J, Aratani Y, et al. Mice deficient in cystathionine bêta-synthase : Animal models for mild and severe homocyst(e)inemia. Proc Natl Acad Sci USA 1995; 92 : 1585–9.
10.
Eto K, Ogasawara M, Umemura K, et al. Hydrogen sulfide is produced in response to neuronal excitation. J Neursci 2002; 22 : 3386–91.
11.
Kimura H. Hydrogen sulfide as a neuromodulator. Mol Neurobiol 2002; 26 : 13–9.
12.
Wang R. Two’s company, three’s a crowd : can H2S be the third endogenous gaseous transmitter. FASEB J 2002; 16 : 1792–8.
13.
Kimura H. Hydrogen sulfide induces cyclic AMP and modulates the NMDA receptor. Biochem Biophys Res Commun 2000; 267 : 129–33.
14.
Dello Russo C, Tringali G, Ragazzoni E, et al. Evidence that hydrogen sulfide can modulate hypothalamo-pituitary-adrenal axis function : in vitro and in vivo studies in the rat. J Neuroendocrinol 2000; 12 : 225–33.
15.
Navarra P, Dello Russo C, Mancuso C, et al. Gaseous neuromodulators in the control of neuroendocrine stress axis. Ann NY Acad Sci 2000; 917 : 638–46.
16.
Eto K, Asada T, Arima K, et al. Brain hydrogen sulfide is severely decreased in Alzheimer’s disease. Biochem Biophys Res Commun 2002; 293 : 1485–8.
17.
Hosoki R, Matsuki N, Kimura H. The possible role of hydrogen sulfide as an endogenous smooth muscle relaxant in synergy with nitric oxide. Biochem Biophys Res Commun 1997; 237 : 527–31.
18.
Zhao W, Zhang J, Lu Y, Wang R. The vasorelaxant effect of H(2)S as a novel endogenous gaseous K(ATP) channel opener. EMBO J 2001; 20 : 6008–16.
19.
Taoka S, Banerjee R. Characterization of NO binding to human cystathionine beta-synthase : possible implications of the effects of CO and NO binding to the human enzyme. J Inorg Biochem 2001; 87 : 245–51.
20.
Chadefaux B, Rethore MO, Raoul O, et al. Cystathionine bêta synthase : Gene dosage effect in trisomy 21. Biochem Biophys Res Commun 1985; 128 : 40–4.
21.
Chadefaux B, Ceballos I, Hamet M, et al. Is absence of atheroma in Down syndrome due to decreased homocysteine levels ? Lancet 1988; 2 : 741.
22.
Kamoun P. Mental retardation in Down syndrome : a hydrogen sulfide hypothesis. Med Hypoth 2001; 57 : 389–92.
23.
Belardinelli MC, Chabli A, Chadefaux B, Kamoun P. Urinary sulfur compounds in Down’s Syndrome. Clin Chem 2001; 47 : 1500–1.
24.
Kamoun P, Belardinelli MC, Chabli A, et al. Endogenous hydrogen sulfide overproduction in Down’s syndrome. Am J Med Genet 2003; 116A : 310–1.
25.
Yamanashi T, Tuboi S. The mechanism of the L-cystine cleavage reaction catalyzed by rat liver gamma-cystathionase. J Biochem 1981; 89 : 1913–21.
26.
Stipanuk MH. Metabolism of sulfur-containing aminoacids. Ann Rev Nutr 1986; 6 : 179–209.
27.
Koj A, Frendo J, Wojczak I. Subcellular distribution and intramitochondrial localization of three sulfurtransferases in rat liver. FEBS Lett 1975; 57 : 42–66.
28.
Ubuka T, Yuasa S, Ishimoto Y, Shimomura M. Desulfuration of L-cysteine through transamination and transsulfuration in rat liver. Physiol Chem Phys 1977; 9 : 241–6.
29.
Ogasawara Y, Isoda S, Tanabe S. Tissue and subcellular distribution of bound and acid-labile sulfur, and the enzymic capacity for sulfide production in the rat. Biol Pharm Bull 1994; 17 : 1535–42.
30.
Nagahara N, Ito T, Kitamura H, Nishino T. Tissue and subcellular distribution of mercaptopyruvate sulfurtransferase in the rat : confocal laser fluorescence and immunoelectron microscopic studies combined with biochemical analysis. Histochem Cell Biol 1998 : 110; 243–50.
31.
Sorbo B. On the formation of thiosulfate from inorganic sulfide by liver tissues and heme compounds. Biochim Biophys Acta 1958; 27 : 324–9.
32.
Ubuka T, Ohta J, Yao WB, et al. L-cysteine metabolism in a mercaptopyruvate pathway and sulfate formation in rat liver mitochondria. Amino Acids 1992; 2 : 143–55.
33.
Westley J. Rhodanese and the sulfane pool. In : Jacoby WB, ed. Enzymatic basis of detoxication, vol. 2. New York : Academic Press, 1980 : 245–62.
34.
Beauchamp Jr RO, Bus JS, Popp JA, et al. A critical review of the literature on hydrogen sulfide toxicity. Crit Rev Toxicol 1984; 13 : 25–97.
35.
Kangas J, Savolainen H. Urinary thiosulphate as an indicator of exposure to hydrogen sulphide vapour. Clin Chim Acta 1987; 164 : 7–10.