Les cellules effectrices de l’immunité innée (cellules présentatrices d’antigènes, cellules natural killer [NK], polynucléaires neutrophiles) ont pour mission de détecter et d’écarter le danger dû à un pathogène avant que les effecteurs de l’immunité adaptative n’aient eu le temps de répondre spécifiquement. Cette mission est remplie par plusieurs familles de couples ligands-récepteurs, parmi lesquels les PRR (pattern recognition receptor), qui regroupent les récepteurs Toll-like (TLR). Ces PRR reconnaissent des motifs moléculaires exprimés par de nombreux agents infectieux, ou pathogen-associated mo-lecular patterns (PAMP). Ainsi, les macrophages et les cellules dendritiques reconnaissent ces PAMP comme des structures « étrangères », et déclenchent une réponse de l’hôte sous forme de l’activation de l’expression de cytokines et de molécules de costimulation, précédant la réponse immunitaire adaptative. Ce sont donc des récepteurs activateurs.
Seconde catégorie, le récepteur du mannose, les récepteurs scavenger, le récepteur du fragment Fc des immunoglobulines, ou les récepteurs du complément, sont plus spécialisés dans la phagocytose et l’élimination des agents susceptibles de déclencher une réponse inflammatoire.
Troisième catégorie, des récepteurs appartenant à la superfamille des immunoglobulines (Ig-SF), et à celle des lectines, capables de reconnaître des molécules endogènes ubiquitaires comme l’acide sialique, les molécules du CMH-I, CD47, CD200, sont aussi exprimés par les cellules de l’immunité innée. Ce sont des récepteurs « inhibiteurs », dont le domaine intracytoplasmique contient des motifs inhibiteurs (ITIM, immunoreceptor tyrosine based inhibition motif) qui recrutent des phosphatases (ciblant les tyrosines) empêchant ainsi le développement de toute réponse inflammatoire. Aussi, à l’état basal, le système immunitaire inné reçoit-il en permanence des signaux off. Mais dès lors qu’un agent infectieux est détecté, ces signaux off sont débordés par les signaux on induits par la mise en jeu des PRR.
Les gènes codant pour ces récepteurs inhibiteurs sont groupés dans des régions géniques qui comprennent également des gènes codant pour des isoformes activatrices de ces récepteurs. Ces dernières sont dépourvues de domaine de signalisation et doivent donc s’associer à des protéines adaptatrices (dont DAP12) contenant des motifs activateurs (ITAM, immunoreceptor tyrosine based activation motif), pour recruter des protéines tyrosine kinases entraînant ainsi l’activation cellulaire.
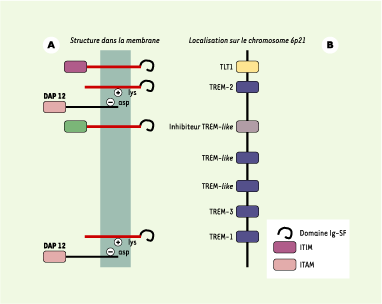
Au sein de l’Ig-SF, la famille TREM (triggering receptors expressed on myeloid cells) comprend au moins deux récepteurs activateurs, TREM-1 et TREM-2, et un récepteur inhibiteur, TLT1 [ 1, 2] (Figure 1).
| Figure 1. Organisation des protéines transmembranaires (A) et des gènes codant pour les molécules TREM sur le chromosome 6 humain (B). À gauche, les récepteurs TREM sont schématisés avec leurs adaptateurs : DAP-12 dans le cas de TREM-1 et TREM-2. TREM-3 est un pseudo-gène. À droite, le cluster de gènes sur le chromosome 6. Les gènes codant pour le complexe majeur d’histocompatibilité sont situés au-delà du gène codant pour TLT-1. |
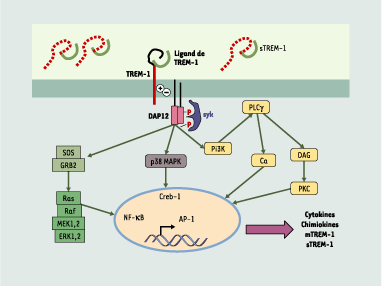
TREM-1 et TREM-2 sont des glycoprotéines transmembranaires composées d’un unique domaine extramembranaire de type Ig, d’une région transmembranaire possédant un résidu chargé de type lysine, et d’une courte portion intracytoplasmique. L’engagement des TREM, une fois ceux-ci associés à DAP12, conduit à la mise en jeu de plusieurs voies de signalisation (impliquant ZAP-70 et Syk) induisant la mobilisation des réserves calciques et l’activation de complexes transcriptionnels (Figure 2). TREM-1 joue un rôle dans la réponse inflammatoire, alors que TREM-2 est impliqué dans la régulation des cellules dendritiques, des ostéoclastes et de la microglie.
Un transcrit variant de TREM, issu d’un épissage alternatif, a été détecté (TREM-1sv) [ 3]. Cet ARNm variant, s’il est traduit, coderait pour une protéine ne possédant ni domaine transmembranaire ni domaine cytoplasmique et qui pourrait, si elle était effectivement sécrétée, moduler l’activation de TREM-1 et se comporter, en quelque sorte, comme un leurre. La région génique codant pour TREM comprend également un gène codant pour un récepteur inhibiteur (TLT1), le produit de ce gène contenant un motif ITIM dans son domaine cytoplasmique [ 4].