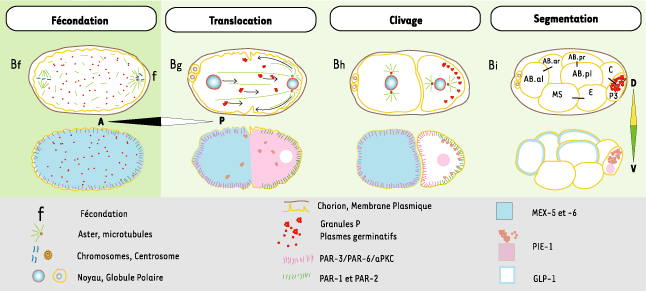
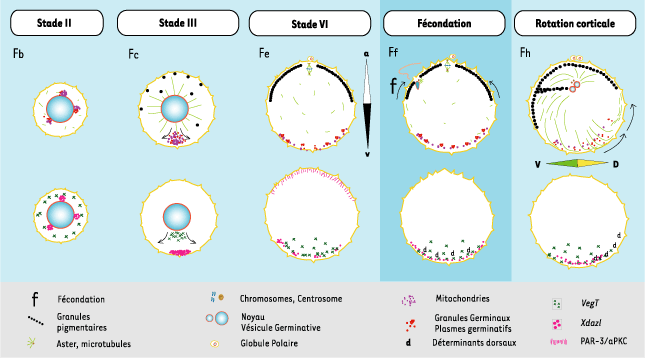
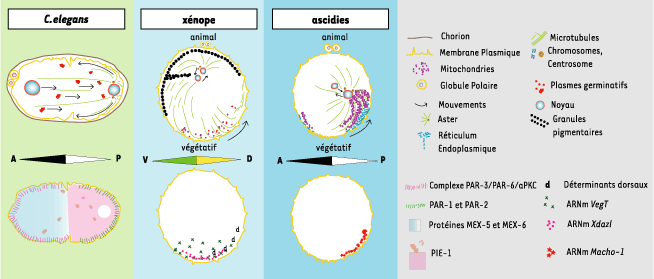
1.
Riechmann V, Ephrussi A. Axis formation during Drosophila oogenesis. Curr Opin Genet Dev 2001; 11 : 374–83.
2.
Huynh JR. Cell polarity and oocyte determination in Drosophila melanogaster. J Soc Biol 2003; 197 : 9–15.
3.
Gilbert SF. Developmental biology. Sunderland, Massachusetts : Sinauer associates Inc, 2000 : 749.
4.
Wolpert L. Principles of development. New York : Oxford University Press Inc, 2002 : 542.
5.
Prodon F, Prulière, G, Chenevert, J, Sardet, C. Établissement et expression des axes embryonnaires : comparaisons entre différents organismes modèles. Med Sci (Paris) 2004; 20 (sous presse).
6.
Gilbert S. Biologie du développement. Paris : De Boeck, Université, 1996.
7.
Wolpert l. Biologie du développement. Les grands principes. Paris : Dunod, 1996.
8.
Wodarz A. Establishing cell polarity in development. Nat Cell Biol 2002; 4 : E39–44.
9.
Pellettieri J, Seydoux G. Anterior-posterior polarity in C. elegans and Drosophila. PARallels and differences. Science 2002; 298 : 1946–50.
10.
Felix MA, Labouesse M, Ségalat L. Caenorhabditis elegans, un organisme modèle en biologie. Paris : Dunod, 2002 : 208.
11.
Pourquié O. Biologie du développement. Paris : Hermann, 2002.
12.
Van Eeden F, St Johnston D. The polarisation of the anterior-posterior and dorsal-ventral axes during Drosophila oogenesis. Curr Op Gen Dev 1999; 9 : 396–404.
13.
Shulman JM, Benton R, St Johnston D. The Drosophila homolog of C. elegans PAR-1 organizes the oocyte cytoskeleton and directs oskar mRNA localization to the posterior pole. Cell 2000; 101 : 377–88.
14.
Bolivar J, Huynh JR, Lopez-Schier H, et al. Centrosome migration into the Drosophila oocyte is independent of BicD and egl, and of the organisation of the microtubule cytoskeleton. Development 2001; 128 : 1889–97.
15.
Navarro C, Lehmann R, Morris J. Oogenesis : setting one sister above the rest. Curr Biol 2001; 11 : R162–5.
16.
Mahajan-Miklos S, Cooley L. Intercellular cytoplasm transport during Drosophila oogenesis. Dev Biol 1994; 165 : 336–51.
17.
Tomancak P, Piano F, Riechmann V, et al. A Drosophila melanogaster homologue of Caenorhabditis elegans par-1 acts at an early step in embryonic-axis formation. Nat Cell Biol 2000; 2 : 458–60.
18.
Vaccari T, Ephrussi A. The fusome and microtubules enrich Par-1 in the oocyte, where it effects polarization in conjunction with Par-3, BicD, Egl, and dynein. Curr Biol 2002; 12 : 1524–8.
19.
Benton R, Palacios IM, Johnston DS. Drosophila 14-3-3/PAR-5 is an essential mediator of PAR-1 function in axis formation. Dev Cell 2002; 3 : 659–71.
20.
Megraw T, Kaufman TC. The centrosome in Drosophila oocyte development. Curr Top Dev Biol 2000; 49 : 385–407.
21.
Cha BJ, Serbus LR, Koppetsch BS, Theurkauf WE. Kinesin I-dependent cortical exclusion restricts pole plasm to the oocyte posterior. Nat Cell Biol 2002; 4 : 592–8.
22.
Swan A, Nguyen T, Suter B. Drosophila lissencephaly-1 functions with Bic-D and dynein in oocyte determination and nuclear positioning. Nat Cell Biol 1999; 1 : 444–9.
23.
Cha B, Koppetsch BS, Theurkauf WE. In vivo analysis of Drosophila bicoid mRNA localization reveals a novel microtubule-dependent axis specification pathway. Cell 2001; 106 : 35–46.
24.
Wilsch-Brauninger M, Schwarz H, Nüsslein-Volhard C. A sponge-like structure involved in the association and transport of maternal products during Drosophila oogenesis. J Cell Biol 1997; 139 : 817–29.
25.
Schnorrer F, Bohmann K, Nüsslein-Volhard C. The molecular motor dynein is involved in targeting swallow and bicoid RNA to the anterior pole of Drosophila oocytes. Nat Cell Biol 2000; 2 : 185–90.
26.
Ephrussi A, Lehman R. Induction of germ cell formation by oskar. Nature 1992; 358 : 387–92.
27.
Ikenishi K. Germ plasm in Caenorhabditis elegans, Drosophila and Xenopus. Dev Growth Differ 1998; 40 : 1–10.
28.
Johnstone O, Lasko P. Translational regulation and RNA localization in Drosophila oocytes and embryos. Annu Rev Genet 2001; 35 : 365–406.
29.
Filardo P, Ephrussi A. Bruno regulates gurken during Drosophila oogenesis. Mech Dev 2003; 120 : 289–97.
30.
Anderson KV. Pinning down positional informatio : dorsal-ventral polarity in the Drosophila embryo. Cell 1998; 95 : 439–42.
31.
Houchmandzadeh B, Wieschaus E, Leibler S. Establishment of developmental precision and proportions in the early Drosophila embryo. Nature 2002; 415 : 798–802.
32.
Dissing M, Giordano H, DeLotto R. Autoproteolysis and feedback in a protease cascade directing Drosophila dorsal-ventral cell fate. EMBO J 2001; 20 : 2387–93.
33.
Samuel AD, Murthy VN, Hengartner MO. Calcium dynamics during fertilization in C. elegans. BMC Dev Biol 2001; 1 : 8.
34.
Goldstein B. Embryonic polarity : a role for microtubules. Curr Biol 2000; 10 : R820–2.
35.
Lyczak R, Gomes JE, Bowerman B. Heads or tails : cell polarity and axis formation in the early Caenorhabditis elegans embryo. Dev Cell 2002; 3 : 157–66.
36.
Cuenca AA, Schetter A, Aceto D, et al. Polarization of the C. elegans zygote proceeds via distinct establishment and maintenance phases. Development 2003; 130 : 1255–65.
37.
Golden A. Cytoplasmic flow and the establishment of polarity in C. elegans 1-cell embryos. Curr Opin Genet Dev 2000; 10 : 414–20.
38.
Gonczy P. Mechanisms of spindle positioning : focus on flies and worms. Trends Cell Biol 2002; 12 : 332–9.
39.
Schubert CM, Lin R, de Vries CJ, et al. MEX-5 and MEX-6 function to establish soma/germline asymmetry in early C. elegans embryos. Mol Cell 2000; 5 : 671–82.
40.
Goldstein B. When cells tell their neighbors which direction to divide. Dev Dyn 2000; 218 : 23–9.
41.
Sardet C, McDougall A, Houliston E. Cytoplasmic domains in egg. Trends Cell Biol 1994; 4 : 166–71.
42.
Sardet C, Speksnijder J, Terasaki M, Chang P. Polarity of the ascidian egg cortex before fertilization. Development 1992; 115 : 221–37.
43.
Nishida H. Specification of developmental fates in ascidian embryos : molecular approach to maternal determinants and signaling molecules. Int Rev Cytol 2002; 217 : 227–76.
44.
Sardet C, Nishida H, Prodon F, Sawada K. Maternal mRNAs of PEM and macho 1, the ascidian muscle determinant, associate and move with a rough endoplasmic reticulum network in the egg cortex. Development 2003; 130 : 5839–49.
45.
Roegiers F, Djediat C, Dumollard R, et al. Phases of cytoplasmic and cortical reorganizations of the ascidian zygote between fertilization and first division. Development 1999; 126 : 3101–17.
46.
Roegiers F, McDougall A, Sardet C. The sperm entry point defines the orientation of the calcium-induced contraction wave that directs the first phase of cytoplasmic reorganization in the ascidian egg. Development 1995; 121 : 3457–66.
47.
Chiba S, Miki Y, Ashida K, et al. Interactions between cytoskeletal components during myoplasm rearrangement in ascidian eggs. Dev Growth Differ 1999; 41 : 265–72.
48.
Nishida H, Sawada K. Macho-1 encodes a localized mRNA in ascidian eggs that specifies muscle fate during embryogenesis. Nature 2001; 409 : 724–9.
49.
Nishikata T, Hibino T, Nishida H. The centrosome-attracting body, microtubule system, and posterior egg cytoplasm are involved in positioning of cleavage planes in the ascidian embryo. Dev Biol 1999; 209 : 72–85.
50.
Gard DL. Confocal microscopy and 3-D reconstruction of the cytoskeleton of Xenopus oocytes. Microsc Res Tech 1999; 44 : 388–14.
51.
Chang P, Perez-Mongiovi D, Houliston E. Organisation of Xenopus oocyte and egg cortices. Microsc Res Tech 1999; 44 : 415–29.
52.
Kloc M, Bilinski S, Chan AP, et al. RNA localization and germ cell determination in Xenopus. Int Rev Cytol 2001; 203 : 63–91.
53.
Kloc M, Dougherty MT, Bilinski S, et al. Three-dimensional ultrastructural analysis of RNA distribution within germinal granules of Xenopus. Dev Biol 2002; 241 : 79–93.
54.
MacArthur H, Bubunenko M, Houston DW, King ML. Xcat-2 RNA is a translationally sequestered germ plasm component in Xenopus. Mech Dev 1999; 84 : 75–88.
55.
Houston DW, King ML. Germ plasm and molecular determinants of germ cell fate. Curr Top Dev Biol 2000; 50 : 155–81.
56.
King ML, Zhou Y, Bubunenko M. Polarizing genetic information in the egg : RNA localization in the frog oocyte. BioEssays 1999; 21 : 546–557.
57.
Xanthos JB, Kofron M, Wylie C, Heasman J. Maternal VegT is the initiator of a molecular network specifying endoderm in Xenopus laevis. Development 2001; 128 : 167–80.
58.
Zhang J, Houston DW, King ML, et al. The role of maternal VegT in establishing the primary germ layers in Xenopus embryos. Cell 1998; 94 : 515–24.
59.
Cheer A, Vincent JP, Nuccitelli R, Oster G. Cortical activity in vertebrate eggs. I : the activation waves. J Theor Biol 1987; 124 : 377–404.
60.
Larabell CA, Torres M, Rowning BA, et al. Establishment of the dorso-ventral axis in Xenopus embryos is presaged by early asymmetries in beta-catenin that are modulated by the Wnt signaling pathway. J Cell Biol 1997; 136 : 1123–6.
61.
Marrari Y, Terasaki M, Arrowsmith V, Houliston E. Local inhibition of cortical rotation in Xenopus eggs by an anti-KRP antibody. Dev Biol 2000; 224 : 250–62.
62.
Marrari Y, Clarke EJ, Rouviere C, Houliston E. Analysis of microtubule movement on isolated Xenopus egg cortices provides evidence that the cortical rotation involves dynein as well as kinesin related proteins and is regulated by local microtubule polymerisation. Dev Biol 2003; 257 : 55–70.
63.
Marikawa Y, Elinson RP. Relationship of vegetal cortical dorsal factors in the Xenopus egg with the Wnt/beta-catenin signaling pathway. Mech Dev 1999; 89 : 93–102.
64.
Miller JR, Rowning BA, Larabell CA, et al. Establishment of the dorsal-ventral axis in Xenopus embryos coincides with the dorsal enrichment of dishevelled that is dependent on cortical rotation. J Cell Biol 1999; 146 : 427–37.
65.
Stricker SA. Comparative biology of calcium signaling during fertilization and egg activation in animals. Dev Biol 1999; 211 : 157–76.
66.
Goldstein B, Hird SN. Specification of the anteroposterior axis in Caenorhabditis elegans. Development 1996; 122 : 1467–74.
67.
Nishida H. Cell fate specification by localized cytoplasmic determinants and cell interactions in ascidian embryos. Int Rev Cytol 1997; 176 : 245–306.
68.
Beckhelling C, Perez-Mongiovi D, Houliston E. Localised MPF regulation in eggs. Biol Cell 2000; 92 : 245–53.
69.
Perez-Mongiovi D, Beckhelling C, Chang P, et al. Nuclei and microtubule asters stimulate maturation/M phase promoting factor (MPF) activation in Xenopus eggs and egg cytoplasmic extracts. J Cell Biol 2000; 150 : 963–74.
70.
Lane J, Allan V. Microtubule-based membrane movement. Biochim Biophy Acta 1998; 1376 : 27–55.
71.
Addinall SG, Mayr PS, Doyle S, et al. Phosphorylation by cdc2-CyclinB1 kinase releases cytoplasmic dynein from membranes. J Biol Chem 2001; 276 : 15939–44.
72.
Woodruff RI, Telfer WH. Electrophoresis of proteins in intercellular bridges. Nature 1980; 286 : 84–6.
73.
Terasaki M, Runft LL, Hand AR. Changes in organization of the endoplasmic reticulum during Xenopus oocyte maturation and activation. Mol Biol Cell 2001; 12 : 1103–16.
74.
Child CM. Patterns and problems of development. Chicago, 1941.
75.
Horstadius S. Experimental embryology of echinoderms. London : Clarendon Press, 1973.
76.
Akiyama T, Okada M. Spatial and developmental changes in the respiratory activity of mitochondria in early Drosophila embryos. Development 1992; 115 : 1175–82.
77.
Coffman JA, Davidson EH. Oral-aboral axis specification in the sea urchin embryo. I. Axis entrainment by respiratory asymmetry. Dev Biol 2001; 230 : 18–28.
78.
Sardet C, Prodon F, Dumollard R, et al. Structure and function of the egg cortex from oogenesis through fertilization. Dev Biol 2002; 241 : 1–23.
79.
Grill SW, Gonczy P, Stelzer EH, Hyman AA. Polarity controls forces governing asymmetric spindle positioning in the Caenorhabditis elegans embryo. Nature 2001; 409 : 630–3.
80.
Benink HA, Mandato CA, Bement WM. Analysis of cortical flow models in vivo. Mol Biol Cell 2000; 11 : 2553–63.
81.
Kloc M, Zearfoss NR, Etkin LD. Mechanisms of subcellular mRNA localization. Cell 2002; 108 : 533–44.
82.
Jansen RP. mRNA localization : message on the move. Nat Rev Mol Cell Biol 2001; 2 : 247–56.
83.
Palacios IM. RNA processing : splicing and the cytoplasmic localisation of mRNA. Curr Biol 2002; 12 : R50–2.
84.
Grieder NC, De Cuevas M, Spradling AC. The fusome organizes the microtubule network during ooctyte differentiation in Drosophila. Development 2000; 127 : 4253–64.
85.
Alarcon VB, Elinson RP. RNA anchoring in the vegetal cortex of the Xenopus oocyte. J Cell Sci 2001; 114 : 1731–41.
86.
Macdonald P. Diversity in translational regulation. Curr Opin Cell Biol 2001; 13 : 326–31.
87.
Jankovics F, Sinka R, Erdelyi M. An interaction type of genetic screen reveals a role of the Rab11 gene in oskar mRNA localization in the developing Drosophila melanogaster oocyte. Genetics 2001; 158 : 1177–88.
88.
Rappleye CA, Paredez AR, Smith CW, et al. The coronin-like protein POD-1 is required for anterior-posterior axis formation and cellular architecture in the nematode Caenorhabditis elegans. Genes Dev 1999; 13 : 2838–51.
89.
Bretscher MS. Expression and changing distribution of the human transferrin receptor in developing Drosophila oocytes and embryos. J Cell Sci 1996; 109 : 3113–9.
90.
Lipschutz JH, Lingappa VR, Mostov KE. The excocyst affects protein synthesis by acting on the translocation machinery of the endoplasmic reticulum. J Biol Chem 2003; 278 : 20954–60.
91.
Betley JN, Frith MC, Graber JH, et al. A ubiquitous and conserved signal for RNA localization in chordates. Curr Biol 2002; 12 : 1756–61.
92.
Ohno S. Intercellular junctions and cellular polarity : the PAR-aPKC complex, a conserved core cassette playing fundamental roles in cell polarity. Curr Opin Cell Biol 2001; 13 : 641–8.
93.
Nakaya M, Fukui A, Izumi Y, et al. Meiotic maturation induces animal-vegetal asymmetric distribution of aPKC and ASIP/PAR-3 in Xenopus oocytes. Development 2000; 127 : 5021–31.
94.
Ahringer J. Control of cell polarity and mitotic spindle positioning in animal cells. Curr Opin Cell Biol 2003; 15 : 73–81.
95.
Riechmann V, Gutierrez GJ, Filardo P, et al. Par-1 regulates stability of the posterior determinant Oskar by phosphorylation. Nat Cell Biol 2002; 4 : 337–42.
96.
Sun TQ, Lu B, Feng JJ, et al. PAR-1 is a Dishevelled-associated kinase and a positive regulator of Wnt signalling. Nat Cell Biol 2001; 3 : 628–36.
97.
Nüsslein-Volhard C, Wieschaus E. Mutations affecting segment number and polarity in Drosophila. Nature 1980; 287 : 795–801.
98.
Kemphues K. PARsing embryonic polarity. Cell 2000; 101 : 345–8.