| |
| Med Sci (Paris). 2004 March; 20(3): 317–324. Published online 2004 March 15. doi: 10.1051/medsci/2004203317.Interactivité entre p73 et p53 dans les cancers : un modèle, le neuroblastome Sétha Douc-Rasy,*1 David Goldschneider,1 Karine Million,1 and Jean Bénard2 1CNRS UMR 8126 2CNRS UMR 8126 et Unité de Génétique des Tumeurs, Service de Génétique. Institut Gustave Roussy, 39, rue Camille Desmoulins, 94805 Villejuif Cedex, France |
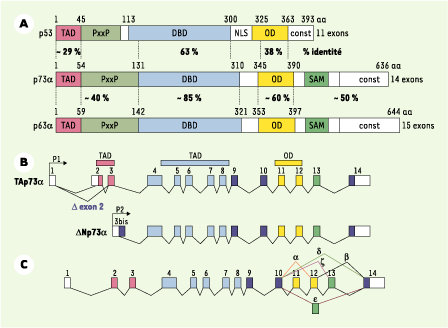
Homologies structurales et régulation des membres de la famille p53 Le gène p53 se caractérise par un transcrit représentant ses 11 exons, traduit en une protéine unique [
1] (Figure 1A). Il existe aussi une isoforme tronquée à l’extrémité amino-terminale, exprimée de manière transitoire dans certaines conditions de croissance cellulaire [
2]. En revanche, les gènes p73 [
3] et p63 [
4] codent pour une combinaison d’isoformes protéiques liée à l’utilisation de deux promoteurs alternatifs, P1 ou P2, dans la partie amino-terminale (Figure 1B) et à un épissage de l’ARN en 3’ du gène (Figure 1C). Deux types de transcrits codent pour des isoformes longues (TA) et amino-terminales tronquées (ΔN) (Figure 1B). Les transcrits TAp73 et TAp63 sont sous le contrôle de P1, alors que ceux de ΔNp73 et ΔNp63 sont sous le contrôle de P2, situé dans l’intron 3 (Figures 1B, 2A) [
5]. Compte tenu de la diversité au niveau carboxy-terminal et de la régulation amino-terminale, il existe de nombreux transcrits et protéines possibles pour chaque gène.
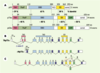 | Figure 1. Structure des gènes de la famille p53, domaines fonctionnels des isoformes. A. Homologies existant entre p63, p73 et p53 au niveau des différents domaines ; TAD (transactivation domain) ; PxxP : motif impliqué dans l’apoptose ; DBD (DNA binding domain) ; NLS (nuclear localizing signal) ; OD (oligomerization domain). Le domaine SAM (sterile alpha motif domain), impliqué dans des interactions protéines-protéines, est présent dans certaines isoformes p73 et p63, mais absent dans p53 ; const : exon constitutif. B. L’expression de p73a est sous le contrôle du promoteur P1 (isoforme longue TA) ; l’isoforme ΔN démunie de TAD est sous le contrôle du promoteur P2, situé dans l’intron 3. C. Différents variants résultent des épissages alternatifs de la région carboxy- terminale de p73 (α, β, d, e, et z). |
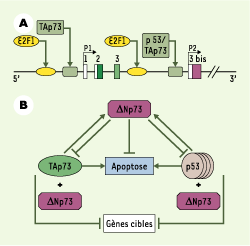
Une façon de classer les différentes isoformes de p63/p73 est de déterminer si elles présentent ou non les deux activités caractéristiques de p53, la transactivation et l’induction d’apoptose. à l’instar de p53, dans des expériences de transfection transitoire, les isoformes TA p63/p73 produites transactivent les gènes cibles associés aux points de contrôle du cycle cellulaire ou à la réparation de l’ADN. L’expression de ces gènes cibles varie quantitativement selon les isoformes : ainsi, TAp73b présente des propriétés de transactivation supérieures à celles de TAp73a [5]. L’année 2002 a été marquée par la mise en évidence de boucles de régulation transcriptionnelle entre p53, TAp75 et ΔNp73 (Figure 2B). En se fixant aux séquences consensus de P2, TAp73 active directement la transcription de ΔNp73 endogène [
6]. La protéine p53 active elle aussi l’expression transcriptionnelle de ΔNp73 endogène et la traduction [
7]. Confirmant cette donnée, des expériences d’immunoprécipitation de la chromatine réalisées à partir des cultures in vitro de cellules soumises à des dommages n’entraînant pas d’apoptose (ajout de petites doses de doxorubicine) ont montré que la protéine p53 se lie et active le promoteur P2 contrôlant ΔNp73. Celle-ci est capable d’inhiber l’activation de P2 par p53 [
8]. Ainsi, la boucle de rétrocontrôle de TAp73 et de p53 par leur propre cible ΔNp73 règle la survie et la mort cellulaires.
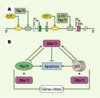 | Figure 2.Contrôle différentiel des promoteurs de TAp73 et ΔNp73. A. Le promoteur P1 contrôle la transcription de TAp73, l’isoforme la plus longue, et le promoteur P2 celle de l’isoforme ΔNp73, qui débute à partir de l’exon 3bis. Les sites de fixation de E2F1 (E2F transcription factor 1) sont présents dans P1 et P2, alors que les sites de fixation de p53 sont présents seulement dans P2. La séquence cible consensus de p53 est RRRCWWGYYYRRRCWWGYYY, alors que la séquence cible de p73 dans P2 est GGGCAAGCTGAGGCCTGCCC [ 6] (R : purine ; Y : pyrimidine, W : adénine ou thymidine). B. Modèle de régulation transcriptionnelle de TAp73 et ΔNp73. La surexpression de p53 ou de TAp73 induit l’expression de son antagoniste ΔNp73. Cette isoforme va inhiber la fonction apoptotique de p53 ou de TAp73. L’association de l’isoforme ΔNp73 avec les protéines p53 ou TAp73 réprime la transcription des gènes cibles. |
Outre la présence spécifique d’un domaine SAM (sterile alpha motif domain) du côté carboxy-terminal, p73 diffère de p53 par sa sensibilité à la dégradation par MDM2 (mouse double minute 2 homolog). La protéine p53, dont la demi-vie est réglée par l’ubiquitinylation, subit une dégradation par le protéasome après fixation sur MDM2 (alors que la formation du complexe MDM2-p14ARF contribue à la stabilité de p53) [
9]. Comme p53, les protéines p73a et p73b se fixent à MDM2 par leur partie amino-terminale, ce qui inhibe leurs fonctions de transcription et d’apoptose, mais n’entraîne pas une dégradation de p73 [
10]. à ce jour, l’ubiquitinylation de p73 n’a pu être montrée, mais une p73a modifiée par une conjugaison à SUMO (small ubiquitin-related modifier) est plus rapidement dégradée par le protéasome qu’une p73 non modifiée [
11]. De manière surprenante, MDM2 accroît l’activité transcriptionnelle de p63 et son niveau protéique [
12]. Pour résumer, ΔNp73 et MDM2 participent à deux boucles de régulation négative contrôlant p53 et TAp73, plaçant ainsi tout stimulus de mort cellulaire sous haute surveillance. Pour p63 et p73, la régulation d’expression génique répond au concept de « deux-gènes-en-un », les isoformes TA et ΔN agissant respectivement comme gène suppresseur de tumeur et oncogène [
13,
14]. En utilisant des fibroblastes sensibilisés à l’apoptose sous l’action d’E1A (adenovirus E1A oncogene) on a pu mettre en évidence qu’une apoptose dépendante de p53 requiert la fonctionnalité de p63 et de p73 [
15]. Cependant, sous l’influence de stimulus particuliers, les voies de signalisation spécifiques de p63 et p73 pourraient être activées indépendamment de p53. |
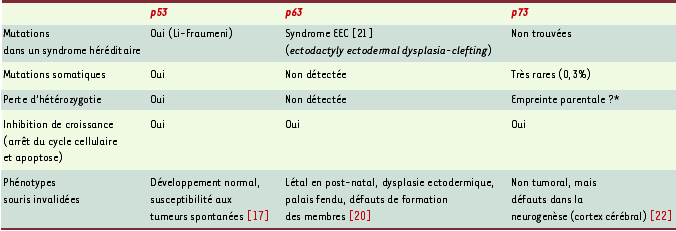
Membres de la famille p53 : développement et différenciation tissulaire Si les souris nullizygotes pour p53 (p53−/−) sont viables, avec peu d’anomalies de développement à l’exception d’un défaut de fermeture du tube neural [
16], elles développent fréquemment des tumeurs [
17]. Lors de l’embryogenèse, p53 joue un rôle essentiel dans la différenciation et l’apoptose des cellules progénitrices et des neurones post mitotiques [
18] alors que pendant la vie adulte, p53 est impliquée dans l’apoptose induite par des dommages génotoxiques [
19]. La situation est toute autre pour p63 et p73 : si les souris p63−/− et p73−/− ne « font » pas de tumeurs spontanées, elles présentent en revanche des défauts de développement concernant des tissus spécifiques (Tableau I).
 | Tableau I. Membres de la famille p53 et leur implication comme suppresseurs de tumeurs. |
Les souris p63−/− naissent vivantes, atteintes de déformations sévères des membres et d’altérations de nombreux épithéliums (cutané, mammaire, urétral et prostatique) et meurent après la naissance [
20]. Des mutations du gène p63 ont été identifiées chez l’homme dans des familles atteintes du syndrome ectodactylie-dysplasie et fentes labiales, dont le phénotype est proche de celui des souris p63−/− [
21]. Pour p73, c’est le système nerveux qui est impliqué. Les souris p73−/− présentent des malformations du cerveau avec hydrocéphalie, dysgénésie de l’hippocampe, de la couche infrapyramidale du gyrus denté en particulier, ainsi que du plexus choroïde, se traduisant par une hypertension intracrânienne [
22]. Par ailleurs, l’isoforme ΔNp73 protège de l’apoptose les neurones sympathiques murins cultivés in vitro et privés de NGF (nerve growth factor) [
23]. Enfin, le gène p73 est impliqué lors du développement du cortex cérébral humain, et son expression est associée à celle de la Reeline, une glycoprotéine de la matrice extracellulaire nécessaire à la migration neuronale, sécrétée par les cellules de Cajal-Retzius [
24]. ΔNp73a maintiendrait la survie des cellules Cajal-Retzius lors de leur migration nécessaire au développement du néocortex. L’absence de ΔNp73 pourrait expliquer la dysgénésie des structures cérébrales et les défauts neuronaux des souris p73−/−. Le groupe de C. Davrinche à Toulouse (France) a montré que le cytomégalovirus, dont les effets sont délétères in utero, induit une survie anormale des cellules neuronales via une accumulation de l’isoforme ΔNp73 [
25]. Les souris p73−/− présentent également des troubles cognitifs et comportementaux importants, des troubles de la reproduction et des infections chroniques. Selon les chercheurs qui ont les premiers identifié p73 (D. Caput, M. Kaghad et F. McKeon), p73 pourrait participer à un système primitif de signalisation, intégrant le processus d’homéostasie cellulaire des vertébrés, et jouant le rôle de capteur et de contrôle de signaux intra et extracellulaires [5, 22]. |
ΔNp73 et oncogenèse du neuroblastome Durant l’oncogenèse, la perte d’hétérozygotie d’un gène suppresseur de tumeur est généralement associée à une mutation de l’autre l’allèle. Dans les tumeurs humaines, le gène p53 [1] répond parfaitement à ce modèle d’invalidation en « deux coups » proposé par Knudson pour le gène Rétinoblastome. Contrairement à un grand nombre de cancers, le gène p53 est très rarement muté dans le neuroblastome. Mais, même si elle est intacte, la protéine p53 est non fonctionnelle du fait de sa localisation cytoplasmique [
26] ou de sa conformation inappropriée [
27]. Par ailleurs, un grand nombre de cancers (neuroblastome, mélanome, sein, côlon…) présentent une perte d’hétérozygotie localisée en 1p36-33, locus du gène p73. Aussi, à peine cloné et localisé par FISH (fluorescent in situ hybridization) dans ce locus [3], p73 a-t-il été considéré comme un possible gène suppresseur de tumeur. La recherche de mutations dans plus de 1 300 cancers (sein, colo-rectal, mélanome, neuroblastome) a montré une très faible incidence de mutations (0,3 %, de type faux-sens) [13], écartant cette hypothèse. L’analyse de 100 tumeurs neuroblastiques (TN) révèle une mutation de p73 dans sa partie carboxy-terminale dans seulement deux d’entre elles [
28]. En dépit de cette absence de mutation, l’hypothèse de l’empreinte génomique parentale, répondant ainsi au modèle de Knudson, pouvait aussi être formulée : le gène p73, invalidé sur l’un de ses allèles par perte d’hétérozygotie, pourrait ne pas s’exprimer sur l’autre allèle, car soumis à empreinte génomique. En fait, excepté une expression monoallélique relevée dans les cancers inflammatoires du sein [
29], une expression biallélique de p73 est retrouvée dans la plupart des cancers [
30], excluant ainsi cette hypothèse. L’absence de mutation de p73 dans les TN a conduit à étudier les variations de l’expression du gène en fonction de l’histologie de ces tumeurs (Figure 3). Toutes les TN expriment un grand nombre de transcrits produits à partir de P1 et P2. Néanmoins, les TN indifférenciées expriment en grande quantité des transcrits partiellement ou totalement dépourvus de TAD, du fait de l’utilisation de P2 ou d’un épissage alternatif de l’exon 2. Ce dernier variant de transcription (Dexon2p73), placé sous le contrôle de P1, agit en tant qu’inhibiteur dominant négatif de p53 [
31]. Il s’exprime plus souvent dans les TN indifférenciées (7/11) que dans les TN en voie de différenciation ou différenciées (3/9) [
32]. Un travail postérieur au nôtre et portant sur d’autres tumeurs a confirmé une augmentation du niveau d’expression de ΔNp73 [
33]. Les transcrits ΔNp73 sous le contrôle de P2 s’expriment quant à eux dans des TN non apoptotiques, un niveau élevé de transcrits constituant un facteur pronostique péjoratif, indépendamment de l’âge, du stade et de l’amplification de l’oncogène N-myc [
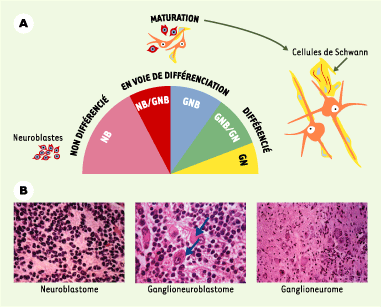
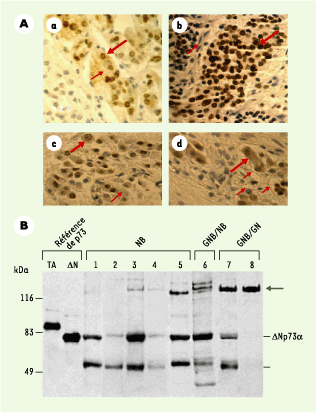
34]. Le rapport des transcrits TA/(ΔNp73 + Δexon2p73), s’il était élevé, serait corrélé à une activité apoptotique dans les TN et, s’il était faible, à une absence d’apoptose. Un anticorps reconnaissant les deux isoformes (TAp73 et ΔNp73) révèle une localisation nucléaire de la protéine p73 dans les TN indifférenciées, et un marquage périnucléaire et cytoplasmique dans les TN les plus différenciées (Figure 4A). Les mêmes observations ont pu être faites après induction de la lignée SH-SY5Y par les facteurs neurotrophiques FGF1 (fibroblast growth factor 1) ou NGF [32]. Par ailleurs, l’immunohistochimie révèle que p53 est hyperexprimée et localisée dans le cytoplasme des TN indifférenciées, en accord avec les observations antérieures d’une inactivation de p53 par séquestration cytoplasmique [26]. En revanche, p53 disparaît très notablement dans les TN en voie de différenciation et n’est plus visible dans les TN totalement différenciées [32]. Ces observations suggèrent une altération du transport nucléocytoplasmique de p73 comme élément important lors du blocage de la différenciation sympathique. Seule l’isoforme ΔNp73 est exprimée dans les TN indifférenciées, traduisant une grande stabilité de cette isoforme (Figure 4B). Fait intéressant, dans une TN totalement différenciée (ganglioneurome), nous n’avons pas détecté en Western blot la forme ΔNp73, mais une forme protéique (possiblement un complexe) de poids moléculaire plus élevé (Figure 4B) [32] dont la nature reste à élucider. Par ailleurs, en comparaison des tissus sains correspondants, de nombreuses tumeurs épithéliales présentent un niveau d’expression du transcrit ΔNp73 significativement augmenté [33].
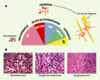 | Figure 3. Classification histologique des tumeurs neuroblastiques. A. De gauche à droite : NB (neuroblastome), formé de petites cellules (neuroblastes malins) non différenciées ; NB/GNB et GNB (ganglioneuroblastome), formés de cellules sympathiques différenciantes plus grosses, et de quelques cellules de Schwann ; GNB/GN et GN (ganglioneurome), formés de grosses cellules ganglionnaires sympathiques totalement différenciées, prolongées par des extensions neuritiques, et entourées de cellules de Schwann. B. Caractères histologiques des coupes de tumeurs neuroblastiques colorées à l’hématoxyline-éosine. De gauche à droite : tumeur immature ou neuroblastome à stroma schwannien pauvre ; ganglioneuroblastome (les flèches indiquent les cellules différenciées) à stroma schwannien riche ; ganglioneurome à stroma schwannien dominant. |
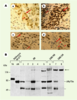 | Figure 4.Immunohistochimie et Western blots de p73 dans des tumeurs neuroblastiques. A. Immunohistochimie à l’aide d’un anticorps reconnaissant les deux isoformes (TAp73 et ΔNp73) de p73. a : médullo-surrénale normale ; à noter un marquage intense au niveau de la membrane nucléaire interne (grosse flèche rouge) associé à un marquage faible, mais significatif, du cytoplasme (petite flèche rouge) des cellules chromaffines. Les cellules corticosurrénales de la zone réticulaire ne sont pas marquées. b : neuroblastome indifférencié au stroma pauvre ; marquage homogène des noyaux des neuroblastes (grosse flèche rouge) et absence de marquage dans les cellules de Schwann (petite flèche rouge). c : ganglioneuroblastome de type nodulaire au diagnostic ; neuroblastes à différents états de maturation ganglionnaire, les plus différenciés marqués au niveau de la membrane interne nucléaire (grosse flèche rouge). d : ganglioneurome après maturation ganglionnaire sympathique, consécutive à une chimiothérapie (adriamycine/vincristine), du ganglioneuroblastome présenté en c ; grosses cellules ganglionnaires complètement différenciées avec noyau positif et cytoplasme abondant (grosse flèche rouge) émettant des neuropiles (prolongements cytoplasmiques, neuronaux et gliaux, répartis entre les cellules nerveuses) (petites flèches rouges). B. Isoformes protéiques de p73 de tumeurs neuroblastiques. Analyse par Western blot de lysats cellulaires totaux incubés en présence d’un anticorps polyclonal anti-p73 (Sanofi Recherches, Toulouse, France). Les tumeurs sont présentées selon leur type histologique : de gauche à droite, NB (neuroblastome), GNB/NB (tumeur en voie de différenciation), GNB/GN (tumeur ganglionnaire mature). Deux premières colonnes de gauche, isoformes de référence (TAp73 et ΔNp73) issues de la lignée SK-N-AS transfectée par les plasmides recombinants correspondants. Canal 8 : présence d’une espèce de haut poids moléculaire (130-150 kda) (flèche) et absence de l’isoforme ΔNp73 pour une tumeur neuroblastique mature. L’espèce protéique de poids moléculaire d’environ 50 kDa correspond vraisemblablement à un produit de dégradation de p73. (Reproduit d’après [ 32] avec la permission de Am J Pathol.) |
Nos résultats suggèrent qu’un lien pourrait exister entre l’accumulation de ΔNp73 et l’exclusion nucléaire de p53 dans les TN indifférenciées. TAp73 pourrait être impliquée dans la différenciation sympathique, alors que ΔNp73 s’opposerait à la différenciation par un effet dominant négatif. Cette hypothèse repose actuellement sur le fait qu’après transfection de l’ADNc de TAp73 dans les neuroblastes murins N1E-115, une différenciation neuronale est observée, alors que la co-transfection de TA et de ΔNp73 n’entraîne pas cette différenciation [
35]. Si p73 ne possède pas les caractères d’un gène suppresseur de tumeur de type p53, la régulation de sa transcription et de sa traduction apparaît associée à la pathogénie des TN. L’équilibre existant entre les différentes isoformes protéiques, aux activités biologiques divergentes, pourrait participer non seulement aux processus d’apoptose, mais aussi à la différenciation sympathique (Figure 5).
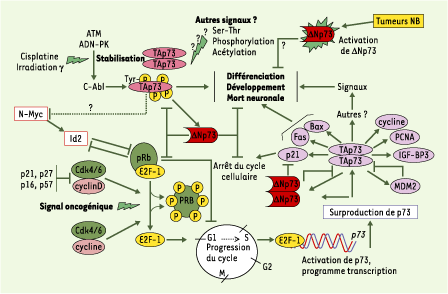
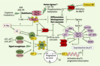 | Figure 5.Voies possibles de transduction du signal impliquant p73 dans la réponse des neuroblastes au stress génotoxique. Modèle hypothétique présentant les voies de signalisation possibles dans les réponses au stress génotoxique impliquant les 2 isoformes majeures de p73. Dans le neuroblastome, p53 n’est pas mutée, mais non fonctionnelle. Dans un souci de clarté, p53 ne figure pas sur le schéma, mais selon une étude récente [ 15], p53 de type sauvage et TAp73 peuvent coopérer d’une façon efficace dans la réponse apoptotique aux stimulus. Le schéma propose 2 voies possibles. Partie supérieure du schéma : en réponse aux lésions de l’ADN causées par la chimiothérapie (doxorubicine ou Cisplatine) ou les radiations g, à l’instar de p53, l’isoforme TAp73a est activée par stabilisation ou modifications post-traductionnelles (acétylation ou phosphorylation). à la différence de p53 qui est activée par phosphorylation via ATM (ataxia telangiectasia-mutated) et les autres kinases, TAp73 - par son résidu Tyr99 - est phosphorylée par c-Abl (proto-oncogène c-abl ou Abelson), lui-même préalablement activé par ATM, ce qui conduit à l’apoptose ou à la différenciation. Partie inférieure du schéma : à la suite d’un signal oncogénique, la protéine pRb (protéine du rétinoblastome) est phosphorylée par les cyclines-Cdk libérant ainsi le facteur de transcription E2F1 (E2F transcription factor 1). Ce dernier stimule la progression du cycle en transactivant de manière pléiotropique un ensemble de gènes dont celui de TAp73 (isoforme longue) et ΔNp73 (isoforme tronquée en aminoterminal). La surproduction de la protéine TAp73, à son tour, active des gènes cibles dont certains sont impliqués dans la mort neuronale et l’arrêt du cycle cellulaire, d’autres dans le développement ou la différenciation neuronale ; ΔNp73 agit alors aussi comme dominant négatif des activités biologiques de TAp73 et de p53 ; c’est le rôle que nous proposons dans les tumeurs neuroblastiques. L’expression de Rb peut être réprimée par Id2, protéine connue comme inhibant la différenciation, elle-même induite par l’hyperexpression de l’oncoprotéine N-MYC. Enfin, les protéines p21waf1, p27Kip1, p57Kip2 et p16INK4 peuvent être activées par TAp73 et déclencher l’arrêt du cycle cellulaire en inhibant les complexes cycline/cdk. Notons que la relation directe entre N-MYC et p73 est inconnue à ce jour. De même, l’inhibition de la différenciation par ΔNp73 dans les tumeurs neuroblastiques (NB) reste à démontrer. Bax (Bcl2-associated X protein) ; Fas (protéine Fas ou CD95) ; PCNA (proliferating cell nuclear antigen) ; IGF-BP3 (insulin-like growth factor binding protein 3) ; Mdm2 (mouse double minute 2 homolog). |
Dans les TN, l’inactivation de la p53 sauvage résulterait soit de sa localisation cytoplasmique, soit d’une conformation inapte à la tétramérisation rendant la protéine inefficace comme facteur de transcription. Une protéine Parc (p53-associated parkin-like cytoplasmic protein) servant d’ancrage pour p53 dans le cytoplasme a été identifiée [
36]. L’interférence par ARN anti-Parc libère p53 du complexe, lui permettant de migrer dans le noyau. Une stratégie de sensibilisation des TN à la chimiothérapie apparaît ainsi possible, sans que l’on sache si Parc interagit également avec p73 et ses isoformes. Récemment, par l’étude des gènes cibles de p53 dans des lignées humaines de TN, nous avons pu mettre en évidence une régulation différentielle entre p53 et p73. Si p53 et TAp73 participent à l’apoptose des neuroblastes malins ayant une p53 sauvage, p73 participe au développement et à la différenciation des neuroblastes dont la p53 est mutée. Fait remarquable, certains gènes cibles connus comme étant des acteurs de la différenciation neuronale sont aussi activés par ΔNp73 via p53 [
37,
38]. |
Les TN fournissent un des premiers exemples d’interactivité fonctionnelle entre p53 et son homologue p73 : TA et ΔNp73 joueraient un rôle de « rhéostat » des fonctions de p53. Pour le tissu neuronal, l’expression conjuguée de p53 et p73 débouche sur un « partage » de fonctions : celles qui sont communes aux processus cellulaires essentiels (apoptose, arrêt du cycle cellulaire, sénescence) et celles qui sont spécifiques au tissu neuronal (développement, différenciation). Beaucoup reste à faire pour identifier les déterminants de ce partage. Sur le plan clinique, le rapport des isoformes ΔNp73/TA peut constituer un index de la gravité des TN et pourrait présenter un intérêt pronostique et thérapeutique. |
Les auteurs remercient l’Institut Gustave Roussy, SANOFI Recherches, La Ligue contre le Cancer-Comité du Cher, l’Association pour la Recherche sur le Cancer et l’Université Paris XI (Bonus Qualité Recherche) pour leur support financier. Ils sont très reconnaissants à Daniel Caput pour son intérêt constant pour leurs travaux et pour ses discussions stimulantes.
|
1. Soussi T, May P. Structural aspects of the p53 protein in relation to gene evolution : second look. J Mol Biol 1996; 260 : 623–37. 2. Courtois S, Verhaegh G, North S, et al. DeltaN-p53, a natural isoform of p53 lacking the first transactivation domain, counteracts growth suppression by wild-type p53. Oncogene 2002; 44 : 6722–8. 3. Kaghad M, Bonnet H, Yang A, et al. Monoallelically expressed gene related to p53 at 1p36, a region frequently deleted in neuroblastoma and other human cancers. Cell 1997; 90 : 809–19. 4. Yang A, Kaghad M, Wang Y, et al. p63, a p53 homolog at 3q27-29, encodes multiple products with transactivating death-inducing and dominant negative activities. Mol Cell 1998; 2 : 305–16. 5. Yang A, Kaghad M, Caput D, McKeon F. On the shoulders of giants : p63, p73 and the rise of p53. Trends Genet 2002; 18 : 90–5. 6. Nakagawa T, Takahashi M, Ozaki T, et al. Autoinhibitory regulation of p73 by ΔNp73 to modulate cell survival and death through a p73-specific target element within the ΔNp73 promoter. Mol Cell Biol 2002; 22 : 2575–85. 7. Kartasheva N, Contente A, Lenz-Stöppler C, et al. p53 induces the expression p73 delta N, establishing an autoregulatory feedback loop. Oncogene 2002; 21 : 4715–22. 8. Vossio S, Palescandolo E, Pediconi N, et al. DeltaN-p73 is activated after DNA damage in a p53-dependent manner to regulate p53-induced cell cycle arrest. Oncogene 2002; 21 : 3796–803. 9. Larsen CJ. The ARF-p53 pathway : a line of defense against oncogenic signals. Bull Cancer 1998; 85 : 9–19. 10. Zeng X, Chen L, Jost CA, et al. Mdm2 suppresses p73 function without promoting p73 degradation. Mol Cell Biol 1999; 19 : 3257–66. 11. Minty A, Dumont X, Kaghad M, Caput D. Covalent modification of p73alpha by SUMO-1. Two-hybrid screening with p73 identifies novel SUMO-1 interacting proteins and a SUMO-1 interaction motif. J Biol Chem 2000; 275 : 36316–23. 12. Calabro V, Gelsomina M, Parisi T, et al. The human MDM2 oncoprotein increases the transcriptional activity and the protein level of the p53 homolog p63. J Biol Chem 2002; 277 : 2674–81. 13. Stiewe T, Pützer BM. Role of p73 in malignancy tumor suppressor or oncogene ? Cell Death Differ 2002; 9 : 237–45. 14. Jost CA, Marin MC, Kaelin WG. p73 is a human p53-related protein that can induce apoptosis. Nature 1997; 389 : 191–4. 15. Flores ER, Tsai KY, Crowley D, et al. p63 and p73 are required for p53-dependent apoptosis in response to DNA damage. Nature 2002; 416 : 560–4. 16. Sah VP, Attardi LD, Mulligan GJ, et al. A subset of p53-deficient embryos exhibit exencephaly. Nat Genet 1995; 10 : 175–80. 17. Donehower LA, Harvey M, Slagle BL, et al. Mice deficient for p53 are developmentally normal but susceptible to spontaneous tumours. Nature 1992; 356 : 215–21. 18. Miller FD, Pozniak CD, Walsh GS. Neuronal life and death : an essential role for the p53 family. Cell Death Differ 2000; 7 : 800–88. 19. Lowe S, Ryley H, Jacks T, Houssman D. p53-dependent apoptosis modulates the cytotoxicity of anticancer agents. Cell 1993; 74 : 957–67. 20. Mills AA, Zheng B, Wang XJ, et al. p63 is a p53 homologue required for limb and epidermal morphogenesis. Nature 1999; 398 : 708–13. 21. Celli J, Duijf P, Hamel BC, et al. Heterozygous germline mutations in the p53 homolog p63 are the cause of EEC syndrome. Cell 1999; 99 : 143–53. 22. Yang A, Walker N, Bronson R, et al. p73-deficient mice have neurobiological, pheromonal and inflammatory defects but lack spontaneous tumors. Nature 2000; 404 : 99–103. 23. Pozniak CD, Radinovic S, Yang A, et al. An anti-apoptotic role for the p53 family member, p73, during developmental neuron death. Science 2000; 289 : 304–6. 24. Meyer G, Perez-Garcia CG, Abraham H, Caput D. Expression of p73 and Reelin in the developing human cortex. J Neurosci 2002; 22 : 4973–86. 25. Allart S, Martin H, Détraves C, et al. Human cytomegalovirus induces drug resistance and alteration of programmed cell death by accumulation of ΔN-p73. J Biol Chem 2002; 277 : 29063–8. 26. Moll UT, LaQuaglia M, Bénard J, Riou G. Wild-type p53 protein undergoes cytoplasmic sequestration in undifferentiated neuroblastomas but not in differentiated tumors. Proc Natl Acad Sci USA 1995; 92 : 4407–11. 27. Wolff A, Technau A, Ihling C, et al. Evidence that wild-type p53 in neuroblastoma cells is in a conformation refractory to integration into the transcriptional complex. Oncogene 2001; 20 : 1307–17. 28. Naka M, Ozaki T, Takada N, et al. Functional characterization of naturally occurring mutants (P405R and P425L) or p73alpha and p73beta found in neuroblastoma and lung cancer. Oncogene 2001; 14 : 3568–72. 29. Ahomadegbe JC, Tourpin S, Kaghad M, et al. Loss of heterozygosity, allele silencing and decreased expression of p73 gene in breast cancer : prevalence of alterations in inflammatory breast cancers. Oncogene 2000; 19 : 5413–8. 30. Yan H, Yuan W, Velculescu VE, et al. Allelic variation of human gene expression. Science 2002; 297 : 1143. 31. Fillippovich I, Sorokina N, Gatei M, et al. Transactivation deficient p73alpha (p73 Deltaexon2) inhibits apoptosis and competes with p53. Oncogene 2001; 2 : 514–22. 32. Douc-Rasy S, Barrois M, Echeynne M, et al. DeltaN-p73alpha accumulates in human neuroblastic tumors. Am J Pathol 2002; 160 : 631–9. 33. Zaika A, Slade N, Erster S, et al. DeltaNp73, a dominant-negative inhibitor of wild-type p53 and TAp73, is up-regulated in human tumors. J Exp Med 2002; 196 : 765–80. 34. Casciano I, Mazzocco K, Boni L, et al. Expression of DeltaNp73 is a molecular marker for adverse outcome in neuroblastoma patients. Cell Death Differ 2002; 9 : 229–30. 35. De Laurenzi V, Raschella G, Barcaroli D, et al. Induction of neuronal differentiation by p73 in a neuroblastoma cell line. J Biol Chem 2000; 27 : 15226–31. 36. Nikolaev AY, Li M, Puskas N, et al. Parc : a cytoplasmic anchor for p53. Cell 2003; 112 : 29–40. 37. Goldschneider D, Blanc E, Raguenez G, et al. Forced p73 expression induces nuclear accumulation of endogenous p53 protein. Cancer Lett 2003; 197 : 99–103. 38. Goldschneider D, Blanc E, Raguenez G, et al. Differential response of p53 target to p73 overexpression in SH-SYSY neuroblastoma cell line. J. Cell Sci 2004; 117 : 293–301. |