| |
| Med Sci (Paris). 2004 March; 20(3): 298–303. Published online 2004 March 15. doi: 10.1051/medsci/2004203298.Apoptose et syndromes coronariens aigus Alain Tedgui* and Ziad Mallat Inserm U.541, Hôpital Lariboisière, 75475 Paris Cedex 10, France |
Caractérisée par la formation de lésions focales (plaques) dans l’intima des artères coronaires, l’athérosclérose est une maladie inflammatoire locale [
1] (‹).
(‹) m/s 2004, n° 2, p. 175
La rupture ou l’érosion de la plaque d’athérosclérose instable constitue le mécanisme commun à tous les syndromes coronariens aigus. Les manifestations cliniques aiguës de la maladie athéroscléreuse, quelle qu’en soit la localisation, sont essentiellement dues à la formation d’un thrombus luminal au contact d’une plaque, obstruant plus ou moins complètement la lumière artérielle [
2] (‹).
(‹) m/s 2004, n° 3, p. 291
Le thrombus se développe au contact de la plaque lorsque l’endothélium qui la couvre est dénudé (érosion superficielle, 40 % des cas) ou lorsque la plaque s’est rompue (rupture profonde, 60 % des cas), exposant ainsi du matériel lipidique thrombogène au sang circulant. Une plaque est dite instable, ou vulnérable, lorsqu’elle est particulièrement sujette à la rupture ou à l’érosion [2]. La composition de la plaque est un facteur déterminant de cette vulnérabilité : son contenu en lipides, en macrophages, en cellules musculaires lisses (CML) et en collagène conditionne grandement sa stabilité [
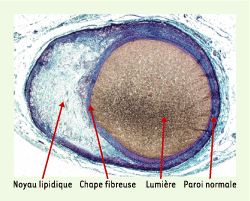
3]. La présence d’un pool lipidique important diminue nettement la résistance physique de la plaque, et les macrophages, par leur capacité à dégrader la matrice extracellulaire, ajoutent à cette vulnérabilité. En revanche, les CML, en synthétisant la matrice extracellulaire, contribuent à la formation d’une chape fibreuse solide et à la stabilisation de la plaque, avec maintien d’un calibre luminal normal (Figure 1).
 | Figure 1. Plaque stable dans une artère coronaire fixée sous pression, avec chape fibreuse épaisse et remodelage excentrique permettant le maintien d’un calibre luminal normal (collection du Pr S. Glagov). |
|
Rupture de la plaque d’athérosclérose La rupture complique principalement (mais non exclusivement) les plaques présentant un noyau lipidique large occupant plus de 40 % du volume total de la plaque, et une chape fibreuse fine riche en macrophages et pauvre en CML. Elle est le résultat du déséquilibre entre les contraintes hémodynamiques auxquelles la chape fibreuse est soumise et sa solidité intrinsèque, qui détermine sa résistance à la fracture. La rupture de plaque est plus fréquemment observée chez les hommes, les patients hypercholestérolémiques, et les sujets dont le décès a été consécutif à un stress physique ou psychique [
4]. Rôle de l’inflammation La présence de signes généraux d’inflammation est un marqueur de risque important de la survenue d’accidents ischémiques graves [
5]. En outre, localement, les zones de rupture de plaque sont caractérisées par la présence de cellules inflammatoires activées [
6] (‹).
(‹) m/s 2004, n° 2, p. 175
La réaction inflammatoire locale pourrait influencer la stabilité de la plaque par ses effets potentiels sur la thrombogénicité de la lésion et sur la matrice extracellulaire. Réponse inflammatoire et remodelage matriciel Les cytokines pro-inflammatoires stimulent l’activité de métalloprotéinases matricielles (MMP) responsables de la dégradation des protéines de la matrice extracellulaire [
7]. Plusieurs MMP sont présentes dans les plaques, mais l’importance relative de chacune d’entre elles dans l’amincissement de la chape fibreuse doit encore être précisée. Par ailleurs, la production des collagènes de types I et III par les CML est fortement inhibée par l’interféron (IFN)-g, ce qui conduit à l’appauvrissement de la plaque d’athérosclérose en tissu de soutien extracellulaire et à sa fragilisation. Les données actuelles montrent que les cytokines pro-inflammatoires impliquées dans la progression et la déstabilisation de l’athérosclérose sont celles qui favorisent l’activité de l’IFN-g, et agissent à la fois sur les lymphocytes et les macrophages. Le rôle de l’IFN-g a été évalué chez des souris qui, déficientes en apolipoprotéine E (apoE−/−), développent spontanément des plaques d’athérosclérose. Si ces animaux sont également rendus déficients en IFN-g ou en récepteur de l’IFN-g, la taille des plaques est nettement réduite ; on observe une diminution de leur richesse en cellules inflammatoires et une forte augmentation de leur contenu en collagène [
8,
9]. En outre, la quantité d’interleukine (IL)-18, un inducteur de la production d’IFN-g présent dans les plaques carotides humaines, est positivement corrélée à l’instabilité clinique (présence d’accident vasculaire cérébral) et anatomique (présence d’ulcération) de la lésion [
10]. L’injection à des souris apoE−/− d’IL-18 ou d’IL-12, une autre cytokine pro-inflammatoire nécessaire à l’induction de la production d’IFN-g, augmente significativement la taille des plaques, qui deviennent alors très riches en cellules inflammatoires et présentent un phénotype instable [9,
11]. D’autres voies inflammatoires, comme celle impliquant l’interaction entre le récepteur CD40 et son ligand, sont également importantes pour la progression et l’instabilité des plaques [
12]. Équilibre inflammatoire, remodelage matriciel et rupture de plaque La réponse inflammatoire est modulée par des cytokines dites anti-inflammatoires [
13]. Plus particulièrement, trois protéines jouent un rôle critique dans la régulation de l’équilibre inflammatoire dans la plaque et dans la survenue d’accidents ischémiques : l’interleukine IL-10, le transforming growth factor-b (TGF-b) et l’IL-18BP (inhibiteur endogène de l’IL-18). La modulation de l’activité de chacune d’entre elles pourrait faire l’objet de retombées thérapeutiques. L’expression de l’IL-10 dans les plaques humaines est associée à une baisse significative des signes d’inflammation locale. Un déficit en IL-10 chez les souris conduit quant à elle à une accélération considérable de la progression des plaques expérimentales [
14], et les patients admis pour angor instable présentent des concentrations sanguines d’IL-10 plus faibles que les patients admis pour angor stable [
15]. L’inhibition de l’activité du TGF-b dans les plaques conduit, quant à elle, à une progression et à une déstabilisation de ces plaques, ce qui suggère la place importante de cette cytokine dans l’évolution de la maladie, et permet d’entrevoir les bénéfices potentiels découlant d’une stimulation de son activité [
16]. L’administration d’IL-18BP à des souris permet de réduire considérablement le développement des plaques expérimentales et induit la transformation des plaques instables (riches en cellules inflammatoires et pauvres en collagène) en lésions stables (moins inflammatoires, riches en CML et en collagène) [
17]. Une stratégie visant à inhiber l’activité de l’IL-18 pourrait donc limiter les complications de l’athérosclérose. |
Apoptose et inflammation L’apoptose est un événement important dans le développement de la plaque d’athérosclérose. Elle touche tous les types cellulaires, et plus particulièrement les macrophages. La distribution de l’apoptose dans la plaque est hétérogène : elle est ainsi plus fréquente dans les régions riches en cellules produisant des cytokines pro-inflammatoires [
18]. Cette association étroite suggère que les zones de rupture de plaque, connues pour leur richesse en cellules inflammatoires, pourraient exposer un nombre important de cellules et de corps apoptotiques au niveau de la lumière artérielle, avec des conséquences possibles sur la thrombogénicité de la plaque. De nombreux arguments sont en faveur d’un lien entre l’apoptose et l’inflammation. Plusieurs études ont permis de montrer que l’inflammation pouvait participer au déclenchement de l’apoptose, à la fois in vitro et in vivo. Mais tout aussi intéressante est l’hypothèse que l’apoptose peut être à l’origine d’une réaction immuno-inflammatoire dans la plaque d’athérosclérose. Le dogme de la mort « propre » par apoptose, récemment remis en cause, ne s’applique ainsi probablement pas à la mort par apoptose survenant dans la plaque d’athérosclérose humaine. Des études récentes menées in vitro suggèrent l’existence d’anomalies dans le processus d’élimination des cellules apoptotiques du tissu athéromateux. Les phospholipides oxydés, ainsi que les anticorps dirigés contre eux, inhibent par compétition la reconnaissance et la phagocytose des cellules apoptotiques par les macrophages [
19]. Il est donc fort probable que la capacité d’élimination des cellules apoptotiques est réduite dans les macrophages de la plaque d’athérosclérose, qui baignent alors dans un environnement riche en phospholipides oxydés, caractéristique de toutes les plaques d’athérosclérose. Apoptose et thrombogénicité de la plaque La plaque est riche en facteur tissulaire (FT) activé, surtout présent au niveau du noyau lipidique [
20] et déterminant majeur du déclenchement de la coagulation. L’activation du facteur tissulaire dépend de la présence de microparticules apoptotiques, qui apparaissent dès lors responsables de la thrombogénicité de la plaque. L’exposition précoce de phosphatidylsérine (PS) sur la face externe de leur membrane plasmique est l’une des caractéristiques des cellules apoptotiques. La phosphatidylsérine est nécessaire à l’assemblage des complexes de la coagulation, dotés d’une grande efficacité catalytique (‹).
(‹) m/s 2004, n° 2, p. 189
Dans les cellules exprimant constitutivement le facteur tissulaire, l’activité de celui-ci est considérablement augmentée après l’induction de l’apoptose et ce, sans augmentation de sa quantité : l’accroissement d’activité est dû à la redistribution de la phosphatidylsérine à la surface de la membrane. Dans les cellules musculaires lisses artérielles humaines, la production de thrombine, à l’origine de la formation de fibrine, est plus importante si les cellules proviennent de plaques coronariennes ou carotidiennes humaines plutôt que d’artères normales. Dans ce cas également, le potentiel pro-coagulant des cellules athéroscléreuses est lié au nombre élevé de cellules en apoptose [
21], et donc à l’exposition de PS à leur surface : en effet, la production de thrombine est également accrue dans les cellules endothéliales apoptotiques en culture [
22]. Les activités procoagulantes dépendantes de la phosphatidylsérine (FT + thrombine) observées à la surface des cellules apoptotiques en culture sont également détectables dans le surnageant, où elles sont portées par les microparticules membranaires émanant des cellules en apoptose [
23]. L’ensemble de ces observations réalisées in vitro suggère fortement que les cellules, de même que les microparticules apoptotiques, jouent un rôle probablement important dans le déclenchement et la propagation des états thrombotiques in vivo. L’événement essentiel responsable du déclenchement de la coagulation après une lésion vasculaire est l’externalisation de molécules de facteur tissulaire à la surface de l’adventice, de la média ou de l’endothélium altéré : la thrombogénicité du matériel athéromateux carotidien est, ainsi, directement liée à sa richesse en facteur tissulaire. Dans un travail récent, une association a été montrée entre l’expression du facteur tissulaire et les zones d’apoptose dans des plaques d’athérome carotidiennes, suggérant que le facteur tissulaire était libéré pendant la mort cellulaire, probablement lié à des microparticules apoptotiques : de fait, la plaque d’athérome humaine contient un nombre important de microparticules apoptotiques qui, en exprimant une quantité élevée de facteur tissulaire activé à leur surface, sont directement responsables de la forte activité pro-coagulante du noyau lipidique [
24]. L’apoptose semble, plus précisément, jouer un rôle critique dans la formation du thrombus après rupture de la plaque d’athérome, une étude récente sur des plaques coronariennes humaines montrant une localisation des cellules en apoptose préférentiellement au contact du thrombus responsable de la mort subite des patients [
25]. |
Thrombose sur zone d’érosion de la plaque d’athérome R. Virmani et al. [2] ont montré que la rupture de la plaque n’est pas l’unique voie finale conduisant à la thrombose artérielle au contact d’une plaque d’athérome ; l’érosion superficielle de l’endothélium luminal d’une plaque fibreuse est également un facteur important prédisposant à la thrombose artérielle, aux accidents coronariens aigus et à la mort subite : 40 % des thromboses artérielles sur plaque d’athérome seraient ainsi associées à une érosion superficielle, et 60 % à une rupture. Selon R. Virmani et al.., et contrairement aux résultats obtenus par A.C. van der Wal et al.. [
26], l’érosion superficielle de la plaque d’athérome ne serait pas liée à la présence d’infiltrats inflammatoires. Par ailleurs, alors que les ruptures de plaque sont plus fréquentes chez les hommes, les sujets hypercholestérolémiques et les patients décédés à la suite d’un effort, l’érosion de plaque est plus souvent retrouvée chez les femmes, les fumeurs et les patients décédés en dehors d’un contexte de stress [4]. Différents mécanismes physiopathologiques pouvant favoriser la thrombose après une érosion endothéliale ont été évoqués par le groupe de R. Virmani, parmi lesquels l’adhérence et l’agrégation plaquettaire, ainsi que l’enrichissement en protéoglycanes, versicane et hyaluronane [
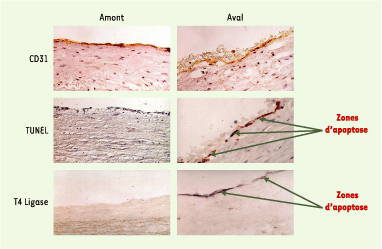
27] ; toutefois, le mécanisme de la thrombose sur érosion de plaque reste encore en partie un mystère. Rôle de l’apoptose des cellules endothéliales Il est probable que l’apoptose - en particulier celle des cellules endothéliales luminales - est à l’origine de la formation d’un thrombus sur érosion, même en l’absence de rupture de la plaque. Les propriétés pro-adhésives et pro-coagulantes des cellules endothéliales en apoptose pourraient être responsables de la formation de thrombus plus ou moins importants à la surface de ces cellules, et être éventuellement responsables de la survenue de microemboles après détachement des cellules apoptotiques du tissu sous-jacent. L’analyse de plaques d’athérome provenant d’endartériectomie carotidienne, coupées longitudinalement dans le sens du flux sanguin, a montré que l’apoptose des cellules endothéliales luminales, qui survient dans 60 % environ des plaques, est étroitement liée à la direction du flux : elle est ainsi sept fois plus importante en aval de la sténose maximale, où les forces de cisaillement sont basses, qu’en amont de la sténose, où les forces de cisaillement sont normales (Figure 2) [
28]. Ces résultats fournissent la première validation in vivo, chez l’homme, des effets des forces de cisaillement sur la survie et la mort par apoptose des cellules endothéliales. Ils suggèrent par ailleurs un rôle important de l’apoptose des cellules endothéliales dans le mécanisme d’érosion et de thrombose de la plaque d’athérome (Figure 3).
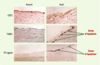 | Figure 2. Distribution de l’apoptose des cellules endothéliales en amont et en aval de la sténose maximale d’une plaque d’athérosclérose carotidienne humaine. Les cellules endothéliales (positives pour l’antigène spécifique CD31) sont présentes en amont et en aval de la plaque, mais l’apoptose, mise en évidence par les méthodes TUNEL ou T4 ligase, se retrouve préférentiellement en aval. |
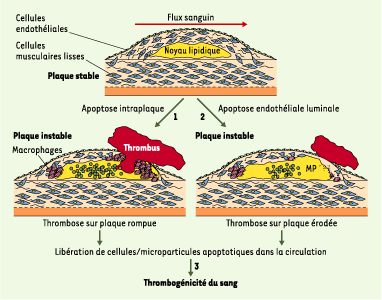
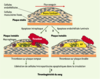 | Figure 3. Rôles potentiels de l’apoptose dans l’instabilité de la plaque d’athérosclérose. 1. La formation et l’accumulation de microparticules (MP [billes vertes]) apoptotiques pro-coagulantes au sein du noyau lipidique (jaune)sont les déterminants majeurs de la formation d’un thrombus à la surface luminale, lorsque les facteurs sanguins de la coagulation se retrouvent à leur contact après rupture de la plaque. 2. L’apoptose des cellules endothéliales dans les zones à bas flux, situées en aval de la sténose, leur confère un potentiel pro-coagulant qui peut expliquer la formation d’un thrombus dans ces zones même en l’absence de rupture. De plus, ces cellules apoptotiques peuvent se décoller de la surface luminale et les débris être incorporés dans le thrombus, d’où l’apparence anatomique d’« érosion ». 3. Les cellules apoptotiques donnent naissance à des microparticules relarguées dans la circulation. Le fort potentiel pro-coagulant de ces microparticules apoptotiques circulantes peut rendre compte de la thrombogénicité (« vulnérabilité ») du sang. |
Rôle des microparticules pro-coagulantes circulantes Le processus d’apoptose et d’activation cellulaire se déroulant au contact de la lumière vasculaire peut être une source importante d’embolies périphériques. Une concentration circulante significativement accrue en microparticules pro-coagulantes est observée chez les patients admis pour angor instable ou pour infarctus du myocarde, en comparaison avec des patients en angor stable ou indemnes de maladie coronarienne [
29]. Il existe alors une prédominance significative des microparticules circulantes d’origine endothéliale et plaquettaire. Ces observations complètent les données montrant des concentrations élevées de facteur tissulaire circulant chez les patients en angor instable et suggèrent, comme des résultats antérieurs [
30], que le facteur tissulaire circulant est porté par des microparticules membranaires (le facteur tissulaire est une protéine transmembranaire non sécrétée) qui lui confèrent un environnement phospholipidique anionique favorable à son activation. Ces microparticules consituent un vecteur important du facteur tissulaire activé et pourraient jouer un rôle critique dans le déclenchement et la croissance du thrombus dans la lumière artérielle. Les microparticules circulantes sont au moins un reflet fiable de la présence d’une complication thrombogène d’une plaque athéroscléreuse, quelle que soit sa localisation, et pourraient être un indice pronostique des récidives ischémiques. De plus, les microparticules circulantes pourraient être le vecteur de la dissémination du potentiel procoagulant, favorisant la formation d’un thrombus sur un site athéroscléreux à distance du foyer d’origine. |
Les données expérimentales obtenues in vitro et in vivo sur des plaques d’athérome de différentes origines plaident en faveur d’un rôle déterminant des processus inflammatoire et apoptotique dans le développement, la progression et les complications de l’athérothrombose, quelle qu’en soit la localisation. L’apoptose et la production exagérée de microparticules apoptotiques, du fait des propriétés antigéniques et inflammatoires de ces dernières, semblent intervenir dans l’induction et la pérennisation de la réaction immuno-inflammatoire caractéristique de la plaque d’athérosclérose. En outre, du fait de leur potentiel pro-coagulant, elles sont un élément déterminant de la formation du thrombus à l’origine des accidents ischémiques aigus. Enfin, les microparticules circulantes sont de puissants vecteurs des potentiels pro-coagulant et pro-inflammatoire, capables de disséminer à distance du foyer initial. Elles pourraient rendre compte de la « vulnérabilité » du sang, sans laquelle l’instabilité de la plaque reste cliniquement silencieuse [
31]. Il n’est en effet pas rare d’observer des plaques d’athérosclérose présentant des signes anatomiques de rupture et de thrombus inclus dans la plaque, mais sans thrombus luminal. De fait, après formation d’un thrombus initial au niveau de la plaque rompue, encore faut-il que la coagulabilité (« vulnérabilité ») du sang soit suffisante pour que le thrombus luminal croisse jusqu’à devenir oblitérant. Ces connaissances nouvelles devraient permettre d’orienter les stratégies diagnostiques vers la détection de la mort cellulaire pour identifier les plaques instables, par exemple, et les stratégies thérapeutiques vers la réduction de l’inflammation et de la mort cellulaire, afin de diminuer les complications de l’athérosclérose. |
1. Libby P. Inflammation in atherosclerosis. Nature 2002; 420 : 868–74. 2. Virmani R, Kolodgie FD, Burke AP, et al. Lessons from sudden coronary death : a comprehensive morphological classification scheme for atherosclerotic lesions. Arterioscler Thromb Vasc Biol 2000; 20 : 1262–75. 3. Burke AP, Kolodgie FD, Farb A, et al. Morphological predictors of arterial remodeling in coronary atherosclerosis. Circulation 2002; 105 : 297–303. 4. Burke AP, Farb A, Malcom GT, et al. Plaque rupture and sudden death related to exertion in men with coronary artery disease. JAMA 1999; 281 : 921–6. 5. Libby P, Ridker PM, Maseri A. Inflammation and atherosclerosis. Circulation 2002; 105 : 1135–43 6. Meuwissen M, Piek JJ, van der Wal AC, et al. Recurrent unstable angina after directional coronary atherectomy is related to the extent of initial coronary plaque inflammation. J Am Coll Cardiol. 2001; 37 : 1271–6. 7. Galis ZS, Khatri JJ. Matrix metalloproteinases in vascular remodeling and atherogenesis : the good, the bad, and the ugly. Circ Res 2002; 90 : 251–62. 8. Gupta S, Pablo AM, Jiang X, et al. IFN-gamma potentiates atherosclerosis in ApoE knock-out mice. J Clin Invest 1997; 99 : 2752–61. 9. Whitman SC, Ravisankar P, Daugherty A. Interleukin-18 enhances atherosclerosis in apolipoprotein E−/− mice through release of interferon-gamma. Circ Res 2002; 90 : E34–8. 10. Mallat Z, Corbaz A, Scoazec A, et al. Expression of interleukin-18 in human atherosclerotic plaques and relation to plaque instability. Circulation 2001; 104 : 1598–603. 11. Lee TS, Yen HC, Pan CC, Chau LY. The role of interleukin 12 in the development of atherosclerosis in ApoE-deficient mice. Arterioscler Thromb Vasc Biol 1999; 19 : 734–42. 12. Schonbeck U, Libby P. CD40 signaling and plaque instability. Circ Res 2001; 89 : 1092–103. 13. Tedgui A, Mallat Z. Anti-inflammatory mechanisms in the vascular wall. Circ Res 2001; 88 : 877–87. 14. Mallat Z, Besnard S, Duriez M, et al. Protective role of interleukin-10 in atherosclerosis. Circ Res 1999; 85 : E17–24. 15. Smith DA, Irving SD, Sheldon J, et al. Serum levels of the antiinflammatory cytokine interleukin-10 are decreased in patients with unstable angina. Circulation 2001; 104 : 746–9. 16. Mallat Z, Gojova A, Marchiol-Fournigault C, et al. Inhibition of transforming growth factor-b signaling accelerates atherosclerosis and induces an unstable plaque phenotype in mice. Circ Res 2001; 89 : 930–4. 17. Mallat Z, Corbaz A, Scoazec A, et al. Interleukin-18/interleukin-18 binding protein signalling modulates atherosclerotic lesion development and stability. Circ Res 2001; 89 : E41–5. 18. Tedgui A, Mallat Z. Apoptosis as a determinant of atherothrombosis. Thromb Haemost 2001; 86 : 420–6. 19. Chang MK, Bergmark C, Laurila A, et al. Monoclonal antibodies against oxidized low-density lipoprotein bind to apoptotic cells and inhibit their phagocytosis by elicited macrophages : evidence that oxidation-specific epitopes mediate macrophage recognition. Proc Natl Acad Sci USA 1999; 96 : 6353–8. 20. Toschi V, Gallo G, Lettino M, et al. Tissue factor modulates thrombogenicity of human atherosclerotic plaques. Circulation 1997; 95 : 594–9. 21. Flynn PD, Byrne CD, Baglin TP, et al. Thrombin generation by apoptotic vascular smooth muscle cells. Blood 1997; 89 : 4378–84. 22. Bombeli T, Karsan A, Tait JF, Harlan JM. Apoptotic vascular endothelial cells become procoagulant. Blood 1997; 89 : 2429–42. 23. Aupeix K, Hugel B, Martin T, et al. The significance of shed membrane particles during programmed cell death in vitro, and in vivo, in HIV-1 infection. J Clin Invest 1997; 99 : 1546–54. 24. Mallat Z, Hugel B, Ohan J, et al. Shed membrane microparticles with procoagulant potential in human atherosclerotic plaques : a role for apoptosis in plaque thrombogenicity. Circulation 1999; 99 : 348–53. 25. Kolodgie FD, Narula J, Burke AP, et al. Localization of apoptotic macrophages at the site of plaque rupture in sudden coronary death. Am J Pathol 2000; 157 : 1259–68. 26. van der Wal AC, Becker AE, van der Loos CM, Das PK. Site of intimal rupture or erosion of thrombosed coronary atherosclerotic plaques is characterized by an inflammatory process irrespective of the dominant plaque morphology. Circulation 1994; 89 : 436–40. 27. Kolodgie FD, Burke AP, Farb A, et al. Differential accumulation of proteoglycans and hyaluronan in culprit lesions : insights into plaque erosion. Arterioscler Thromb Vasc Biol 2002; 22 : 1642–8. 28. Tricot O, Mallat Z, Heymes C, et al. Relation between endothelial cell apoptosis and blood flow direction in human atherosclerotic plaques. Circulation 2000; 101 : 2450–3. 29. Mallat Z, Tedgui A. Current perspective on the role of apoptosis in atherothrombotic disease. Circ Res 2001; 88 : 998–1003. 30. Giesen PL, Rauch U, Bohrmann B, et al. Blood-borne tissue factor : another view of thrombosis. Proc Natl Acad Sci USA 1999; 96 : 2311–5. 31. Naghavi M, Libby P, Falk E, et al. From vulnerable plaque to vulnerable patient : a call for new definitions and risk assessment strategies (part I). Circulation 2003; 108 : 1664–72. |