L’hémoglobine (Hb) est un tétramère dont les deux chaînes α et β sont codées par des gènes situés sur des chromosomes différents. Une coordination est nécessaire pour assurer un équilibre stœchiométrique parfait entre les deux processus de synthèse. L’excès de l’une ou de l’autre chaîne se traduira, en effet, par un syndrome thalassémique plus ou moins sévère. Les chaînes β en excès forment des homotétramères β4 (HbH), inaptes au transport de l’oxygène, mais solubles; les chaînes α, en revanche, ont tendance à précipiter dans la cellule sous forme monomérique, entraînant une cascade physiopathologique dont l’étape finale est la dénaturation de la protéine et la destruction cellulaire prématurée, phénomènes largement responsables des troubles observés au cours des β-thalassémies [1]. Les études de synthèse de l’Hb ont montré qu’en raison d’unléger excès de synthèse des chaînes d’α-globine par rapport aux chaînes de β-globine, il ne se forme pas spontanément d’HbH. Le mécanisme évitant les désordres dus à l’excès de chaînes α a fait l’objet d’hypothèses non vérifiées, dont l’existence d’une protéine « chaperon » assurant leur stabilisation. L’article publié dans Nature par deux équipes de l’Université de Philadelphie (PA, USA) semble apporter une réponse à cette question non résolue [2].
Les auteurs sont partis de l’hypothèse que cette protéine stabilisatrice devaitavoir, comme les chaînes de globine etles enzymes de la synthèse de l’hème,une spécificité érythroïde,etdevait donc êtrecontrôlée par GATA-1, facteur de transcription à doigts de zinc indispensable à la spécification de la lignée érythroïde [3]. Le criblage des gènes dont la synthèse était induite par GATA-1 leur a permis d’isoler un ARNm transcrità partir d’un gène appelé EDRF (erythroid differentiation-related factor) qu’ils proposent d’appeler plutôt AHSP (α-haemoglobin stabilizing factor). L’ARN murin de ce gène EDRF/AHSP code pour une protéine de 102 acides aminés, très conservée à travers les espèces, abondante et de spécificité érythroïde rigoureuse, très diminuée dans les cultures de cellules GATA-1. Les auteurs ont ensuite mis en évidence une liaison spécifique de la protéine AHSP avec l’α-globine monomérique, et pas avec la β-globine. Le complexe AHSP/α-globine est stable, réparti de façon homogène dans le cytoplasme, et ne précipite pas, même après oxydation. Il ne se dissocie qu’en présence d’hémoglobine β, chaîne ayant fixé l’hème, permettant alors la formation de l’HBA α2β2. L’étape suivante a été l’étude fonctionnelle de AHSP in vivo. Chez les souris AHSP−/− par délétion du gène, on observe des troubles importants du développement, mais surtout un nombre important de réticulocytes, des anomalies morphologiques des érythrocytes, la présence d’inclusions d’Hb dénaturée, une demivie abrégée des érythrocytes, symptômes qui ne sont pas sans rappeler ceux d’une forme mineure de β-thalassémie et qui s’expliquent facilement par un excès d’hémoglobine α libre dans les précurseurs, normalement maintenue sous contrôle par la présence d’AHSP.
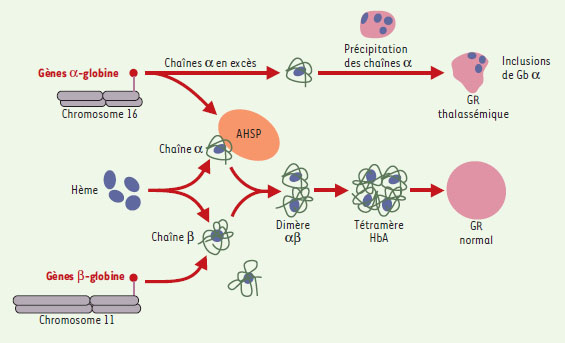
Ces mécanismes de physiologie moléculaire ont des conséquences médicales. Le groupe très hétérogène des thalassémies compte certainement parmi les maladies génétiques les plus fréquentes dans le monde. Ce qui caractérise une β-thalassémie, c’est un déficit notable en chaînes β, d’où l’anémie, mais également un excès relatif de chaînes α qui contribue aux lésions cellulaires et à l’hémolyse qui s’ensuit. Le travail actuel, joint à ce que l’on sait des β-thalassémies, permet de proposer un schéma physiopathologique (Figure 1) [4]. À l’état normal, les chaînes de globine sont synthétisées indépendamment sur les chromosomes 16 et 11, et le léger excès de chaînes α est stabilisé par AHSP qui joue ici un rôle de chaperon. La chaîne β, d’une part, et le complexe α/AHSP, d’autre part, fixent chacun une molécule d’hème, s’associent en dimères, puis en tétramères, donnant au globule rouge sa morphologie et sa teneur en Hb. AHSP relargué fixera une nouvelle molécule de chaîne αpour la présenter aux chaînes β. Dans le scénario d’une β-thalassémie, l’excès de chaînes α, modéré à l’état normal, est important et excède les capacités de AHSP. Ces chaînes, à l’état libre, précipitent, entraînant leur cortège de lésions cellulaires, microcytose, inclusions, spicules… Y a-t-il là l’explication de certains syndromes thalassémiques marqués par une discordance entre lésions moléculaires et expression phénotypique? Pourrait-on envisager qu’en provoquant une surexpression de AHSP, on améliore un syndrome thalassémique grave?
| Figure 1. Schématisation du rôle de la protéine AHSP. Les chaînes d’α- et de β-globine sont codées par des gènes situés sur deux chromosomes différents. La chaîne α en léger excès forme alors un complexe avec la protéine AHSP. Ce complexe, ainsi que la chaîne β, fixent chacun une molécule d’hème, puis s’associent en dimère αβ, puis en tétramère d’HbA, en libérant AHSP qui va jouer le rôle de chaperon sur une autre chaîne α. En cas de thalassé-mie, l’excès de chaînes α déborde les capacités de chaperon d’AHSP. Ces chaînes monomères précipitent en entraînant les lésions cellulaires classiquement observées. GR: globule rouge. |