La dengue - ou grippe des tropiques -représente à l’heure actuelle la principale arbovirose (transmission du virus après réplication virale dans un vecteur arthropode) des régions tropicales qui ceinturent le globe terrestre (Figure 1A) [1]. La dengue est une maladie humaine des zones urbaines dont l’agent étiologique est un flavivirus, transmis à son hôte par piqûre du moustique domestique Aedes aegypti. Les virus DEN se classent en quatre types sérologiquement distincts (1 à 4). Aucune corrélation n’a pu être établie entre une infection par un sérotype particulier du virus de la dengue et la sévérité de la maladie [2].
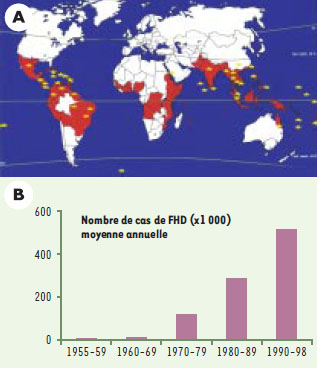
| Figure 1. La dengue : données épidémiologiques. A. Les zones d’endémie (en rouge) correspondent aux régions tropicales et subtropicales du globe terrestre, où le moustique vecteur se reproduit. Les foyers épidémiques associant des cas de fièvre hémorragique de dengue (FHD) sont représentés par des étoiles jaunes. B. Augmentation récente et aiguë du nombre de cas de fièvre hémorragique de dengue (FHD) dans le monde (données extraites d’un rapport de l’OMS, 2000). |
On dénombre plus de cent millions de cas de dengue par an, principalement en Asie, en Océanie, en Amérique du Sud et Centrale (Figure 1A). Parmi les personnes ayant contracté la maladie, plus de cinq cent mille développent les formes sévères de dengue hémorragique et plusieurs milliers, en majorité des enfants, décéderont [3, 4]. La fréquence des épidémies et leur sévérité se sont accrues de façon tout à fait préoccupante depuis les années 1960 (Figure 1B). À cette période, moins de quinze mille cas de dengue hémorragique étaient recensés en moyenne par an et dans le monde [4]. L’émergence de la dengue hémorragique a probablement pour origine la conjonction de plusieurs facteurs socio-économiques et écologiques. L’accroissement de la population urbaine ainsi que les échanges commerciaux multilatéraux ont intensifié la transmission inter-humaine du virus en favorisant la prolifération et la diffusion du moustique vecteur vers de nouvelles aires géographiques. La lutte anti-vectorielle reste peu efficace contre les flaviviroses transmises par les moustiques car elle doit associer une destruction des gîtes larvaires et des adultes. Des essais d’éradication du vecteur à grande échelle ont été tentés dans les années 1970 en Amérique du Sud [3, 5], résultant en une baisse significative de l’incidence de la dengue et de la fièvre jaune (due au virus de la fièvre jaune, autre membre du genre Flavivirus). L’effet produit n’a toutefois été que temporaire et la résurgence des populations de moustiques ayant échappé aux pesticides, ou l’émergence de moustiques résistants, ont rapidement conduit à une nouvelle colonisation des régions endémiques.
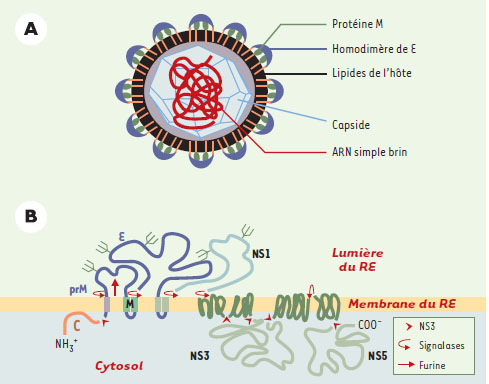
Les flavivirus sont des virus enveloppés d’environ 50 nm de diamètre, constitués d’une nucléocapside formée par la protéine C associée à un ARN génomique de polarité positive de 11 000 bases (Figure 2) [1, 5, 6]. La nucléocapside est entourée d’une bicouche lipidique issue du réticulum endoplasmique dans laquelle sont ancrées la protéine de membrane M et la protéine d’enveloppe E. L’ARN génomique possède un seul cadre de lecture ouvert codant pour l’ensemble des protéines virales, comprenant les trois protéines structurales et sept protéines non structurales. La protéine E, qui comprend une séquence requise lors de la fusion de la particule virale avec les membranes cellulaires, permet l’attachement du virus à la surface de la cellule cible. Ce processus pourrait être initialement assuré par une interaction avec les glycosaminoglycanes de type héparane sulfate présents dans la membrane plasmique [2]. L’existence de récepteurs spécifiques de nature protéique a été suggérée par différentes études sans que leur identité n’ait été formellement établie. La structure des flavivirus a récemment été déterminée par reconstruction du virus de la dengue de type-2 à partir d’images de cryomicroscopie électronique [7]. L’intégration de données radiocristallographiques acquises pour la protéine E du virus de l’encéphalite européenne transmise par les tiques a permis de proposer une organisation moléculaire des protéines structurales au sein de la particule virale, ce qui pourrait à terme faciliter le développement rationnel de molécules anti-virales.
| Figure 2. Carte d’identité du virus de la dengue. A. Structure du virus de la dengue, de la famille Flaviviridae,genre Flavivirus. Il en existe quatre serotypes : DEN-1,2,3,4. B. Le genome viral, un ARN monocatenaire de polarite positive - 11 000 bases environ - comprend un seul cadre de lecture ouvert codant pour trois proteines structurales, C, prM/M, E, et sept proteines non structurales : NS1, NS2a/b, NS3, NS4a/b, NS5. La replication est cytoplasmique et l’assemblage du virion se fait au sein du reticulum endoplasmique (RE) (assemblage schematise par les fleches et les tetes de fleche rouges). |
L’infection par le virus de la dengue reste généralement inapparente. Dans le cas d’une infection symptomatique [8, 9], la maladie se traduit initialement par une fièvre non différenciée, dite fièvre dengue, une semaine environ après la piqûre du moustique infecté, délai qui représente la période d’incubation. La phase fébrile peut durer 3 ou 4 jours et se termine le plus souvent par une rémission des symptômes, bien que l’asthénie puisse se prolonger plusieurs jours ou semaines. L’état général du patient peut aussi brutalement s’aggraver avec l’apparition de signes hémorragiques. La fièvre hémorragique de dengue se caractérise par l’augmentation de la perméabilité vasculaire, qui va entraîner une fuite plasmatique responsable d’une hémoconcentration nette, et par un dérèglement de l’hémostase associant une thrombocytopénie et une coagulopathie. Des épanchements séreux dans les cavités pleurales et abdominales associés à des hémorragies internes peuvent aboutir à un choc hypovolémique (syndrome de choc associé à la dengue) et, éventuellement, au décès du malade moins d’une semaine après le début des fièvres. Des atteintes hépatiques et des complications neurologiques ont été observées dans les formes sévères de dengue. Selon les épidémies, le taux de létalité peut atteindre 2 à 5 % des cas déclarés de fièvre hémorragique de dengue. Il n’existe pas de thérapie spécifique, et le traitement se limite à l’administration d’antalgiques et d’antipyrétiques et, dans le cas de formes hémorragiques, à une perfusion pour compenser la fuite plasmatique, associée à la correction des troubles hydro-électrolytiques et la relance de la diurèse [5].
La dengue demeure une maladie humaine fort mal comprise [2–4]. Les mécanismes physiopathologiques impliqués dans les formes graves de la maladie seraient d’ordre immunopathologique [10–12]. Selon l’hypothèse de l’ADE (antibody-dependent enhancement), une réponse immunitaire antivirale inappropriée serait responsable de la forme hémorragique et du syndrome de choc. Au cours d’une réinfection par le virus de la dengue, la particule virale serait reconnue par les anticorps spécifiques développés lors d’une primoinfection, mais ne serait pas neutralisée. Au contraire, ces anticorps faciliteraient l’infection des macrophages en permettant l’internalisation des complexes virus-anticorps via les récepteurs de surface pour la région constante (Fc) des immunoglobulines. Les macrophages infectés pourraient alors sécréter des cytokines pro-inflammatoires comme des interleukines (IL), IL-1, IL-6 et du TNF-α, capables d’activer à leur tour des lymphocytes T et des cellules endothéliales [11, 12]. La recherche d’une éventuelle corrélation entre le taux d’anticorps spécifiques, ou encore la production de cytokines pro-inflammatoires, et la sévérité de la maladie est jusqu’à présent restée infructueuse. Il est à noter que la surexpression de cytokines, observée chez les patients ayant développé une dengue hémorragique, reflète une réponse immune de type Th2, qui peut s’avérer délétère pour l’hôte si elle est exacerbée [12].
D’un point de vue diagnostique, l’infection par le virus de la dengue peut être confirmée par différentes méthodes [1, 3, 5]. La détection du virus se fait par amplification génique de l’ARN viral présent dans le sang des patients. Cette technique, rapide et sensible, est actuellement la seule qui permette d’établir un diagnostic pendant la phase clinique. Toutefois, son prix de revient est élevé et elle se révèle le plus souvent inadaptée aux études de terrain. Il est également possible de mettre en évidence la séroconversion des patients par la recherche des anticorps spécifiques produits au cours de l’infection, mais ces derniers apparaissent au plus tôt 4 ou 5 jours après le début des fièvres. La recherche par immunocapture de la présence d’antigènes viraux autres que la particule virale, comme la glycoprotéine non structurale NS1 circulant dans le sang des patients pendant la phase clinique, pourrait s’avérer une alternative avantageuse aux différentes techniques généralement usitées [13].
Il n’existe pas à l’heure actuelle d’immunoprophylaxie contre la dengue [1]. Envisager une vaccination contre une infection par le virus de la dengue supposerait que l’on puisse induire une réponse immune appropriée sans déclencher de phénomène d’ADE qui pourrait prédisposer le sujet vacciné à développer les formes sévères de la maladie en cas d’infection par le virus sauvage. Une approche complexe mais prometteuse consiste à vacciner les individus contre les quatre sérotypes viraux simultanément, en utilisant une combinaison de plusieurs souches virales atténuées. Différentes études cliniques sont en cours chez l’homme pour évaluer l’efficacité et l’innocuité de telles préparations [4, 5].
L’émergence de la dengue hémorragique dans les régions tropicales, l’impossibilité de pronostiquer l’évolution de la maladie chez un patient infecté par l’un des quatre sérotypes du virus de la dengue et l’absence de prophylaxie antivirale sont autant d’incitations à développer des outils performants pour lutter contre cette arbovirose tropicale, qui représente dorénavant un problème majeur de santé publique.