Au cours des dix dernières années, la recherche dans le domaine de la thérapie génique a été principalement focalisée sur l’amélioration des vecteurs viraux et non viraux pour le transfert de gènes. Toutefois, les formulations proposées pour l’introduction de « transgènes » restent encore limitées en raison de difficultés liées à leur pouvoir immunogène, à leur toxicité et à leur faible efficacité in vivo. Face à ces limitations, l’alternative était d’imaginer de nouvelles stratégies qui permettraient le transfert direct de la protéine d’intérêt dans un grand nombre de cellules [1].
Le développement de peptides ou protéines à visée thérapeutique reste limité par la faible perméabilité membranaire et par la présence, à la surface de la cellule, de protéines ou de récepteurs qui contrôlent sélectivement le transport cellulaire de molécules. Récemment, ces restrictions ont été levées par la découverte de petits domaines protéiques, appelés protein transduction domains (PTD). Ces derniers, de nature basique, sont capables de traverser les membranes biologiques indépendamment de la présence de transporteurs ou de récepteurs spécifiques à la surface des cellules, et permettent le transfert de peptides ou de protéines dans les cellules [1, 2]. Les trois domaines PTD qui ont été le mieux caractérisés et utilisés dérivent de la protéine Tat du virus de l’immunodéficience humaine (VIH-1) [3], de la troisième hélice de l’homéo-domaine d’Antennapedia (Antp) [4], et de la protéine de structure Vp22 du virus de l’herpès simplex [5]. À ce jour, le PTD de la protéine Tat constitue le système le plus efficace pour le transfert des protéines in vitro et in vivo [6, 7]. Cependant, l’utilisation des vecteurs PTD présente un certain nombre de contraintes réduisant leur exploitation in vivo. D’une part, cette approche nécessite dans tous les cas la formation d’une protéine de fusion entre la séquence PTD et la protéine d’intérêt. Cette fusion peut être obtenue soit par voie chimique (Antp et Tat), soit par clonage (Vp22 et Tat). D’autre part, leur efficacité pour la transduction de protéines de grande taille reste faible et nécessite une étape de dénatu-ration de la protéine avant la transduction, introduisant ainsi un délai avant que ne soit restaurée la forme active de la protéine dans la cellule.
Depuis plusieurs années, notre laboratoire travaille au développement d’outils peptidiques facilitant le transport cellulaire d’acides nucléiques, de peptides et de drogues [8, 9]. Récemment nous avons proposé une nouvelle stratégie pour le transfert de protéines dans les cellules, fondée sur un vecteur peptidique unique (Pep-1), permettant de s’affranchir des étapes de couplage et/ou de dénaturation des protéines d’intérêt [10]. Le choix de la séquence de Pep-1 est fondé sur le criblage d’une série de peptides amphiphatiques ayant la capacité de traverser la membrane plasmique des cellules. Contrairement aux vecteurs PTD, Pep-1 est un peptide amphiphatique primaire de 21 résidus. Il comporte trois domaines : (1) un domaine hydrophobe riche en résidus tryptophane, qui est essentiel pour la formation de complexes stables avec la protéine d’intérêt, par l’intermédiaire de liaisons non covalentes, et pour l’association avec la membrane cellulaire ; (2) un domaine hydrophile riche en résidus lysine qui favorise le transfert cellulaire ; et enfin (3) un court bras peptidique reliant les deux domaines, qui est essentiel pour l’intégrité des propriétés de Pep-1 [10]. Pep-1 piège la protéine d’intérêt dans une cage peptidique, dont le transport cellulaire est uniquement contrôlé par Pep-1 et indépendant des caractéristiques de la protéine d’intérêt. La balance hydrophobe/ hydrophile est nécessaire pour le mécanisme de translocation membranaire, et l’association du domaine hydrophile avec un ou plusieurs résidus tryptophane du domaine hydrophobe semble cruciale pour le transport de protéines. Pep-1 n’est pas toxique, est stable dans les milieux physiologiques et insensible à la présence de sérum.
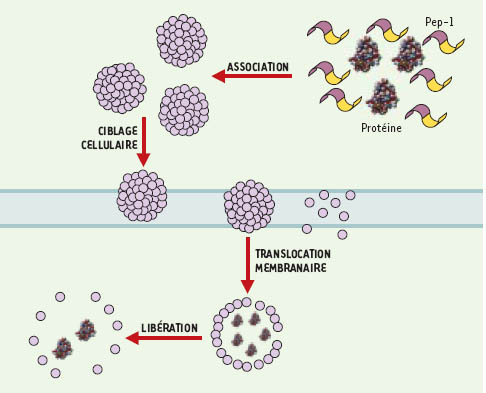
Le peptide vecteur (Pep-1) traverse rapidement la membrane plasmique et la majeure partie se localise dans le noyau, suivant un mécanisme d’internalisation indépendant des voies d’endo-cytose. Pep-1 est capable de former des complexes non covalents stables avec des protéines et des peptides de taille variable (3 kDa à 500 kDa). La caractérisation de ces complexes a permis de mettre en évidence l’existence d’un réseau de Pep-1 autour de la protéine ou du peptide d’intérêt. Cette cage peptidique stabilise le complexe dans un milieu biologique et limite la dégradation de la molécule à vectoriser. L’application de cette technologie à des séries de peptides et de protéines a démontré que les complexes Pep-1/protéine étaient rapidement internalisés (1-2 h), avec une efficacité de l’ordre de 60 à 90 % selon les lignées cellulaires. De plus, la présence de Pep-1 ne perturbe ni la localisation cellulaire de la protéine ni son activité biologique. Le mécanisme de transduction de protéines par Pep-1 comporte plusieurs étapes : la formation d’une cage peptidique autour de la protéine d’intérêt, suivie de son transport rapide à travers la membrane cellulaire et enfin la dissociation du complexe Pep-1/protéine qui intervient immédiatement après son entrée dans la cellule (Figure 1). Nous avons démontré que le mécanisme d’internalisation des complexes Pep-1/protéine était indépendant de l’état du cycle cellulaire, de la présence de récepteurs cellulaires spécifiques et des voies classiques d’endocytose, se rapprochant ainsi des mécanismes proposés pour les PTD [7]. L’utilisation de Pep-1 pour le transfert de protéines permet d’envisager des applications multiples en biologie cellulaire et en thérapeutique. Nous avons déjà appliqué Pep-1 à la vectorisation d’anticorps ou d’inhibiteurs protéiques contrôlant la progression du cycle cellulaire. Actuellement, nous focalisons notre activité sur l’identification du potentiel d’un tel vecteur in vivo.
| Figure 1.
Différentes étapes du mécanisme de transduction de protéines par Pep-1. Le mécanisme de Pep-1 comporte quatre étapes majeures : (1) la formation d’une « cage » peptidique stable autour de la protéine d’intérêt ; (2) l’interaction du complexe Pep-1/protéine avec la membrane cellulaire ; (3) suivie de son internalisation ; et enfin (4) de la libération dans le cytoplasme de la protéine d’intérêt. |
Les vecteurs peptidiques constituent des outils très prometteurs dans le domaine du transfert de molécules biologiquement actives. Ils sont facilement accessibles par voie de synthèse, ce qui rend possible la conception de multiples analogues. La stratégie mise au point avec le vecteur Pep-1 offre un puissant outil utilisable tant en recherche fondamentale que pour le criblage de protéines et de peptides potentiellement thérapeutiques. Le développement des méthodes facilitant le transfert de protéines présente plusieurs avantages. En particulier, elles permettent d’envisager l’utilisation directe de protéines ou domaines protéiques en thérapeutique sans avoir besoin de recourir à la thérapie génique ou à l’élaboration de drogues, ce qui contournerait les contraintes qui leur sont associées.