| |
| Med Sci (Paris). 2002 May; 18(5): 605–609. Published online 2002 May 15. doi: 10.1051/medsci/2002185605.A bas les barrières… d’énergie dans les canaux potassiques ! Lucie Parent,1 Rémy Sauvé,1 Simon Bernèche,1 and Benoît Roux2 1Groupe de recherche en transport membranaire, Département de physiologie, Université de Montréal, CP 6128, Succursalle Centre-ville, Montréal, Québec, H3C 3J7, Canada 2Groupe de recherche en transport membranaire, Department of Biochemistry, Weill Medical College of Cornell University, 1300 York Avenue, New York, NY 10021, États-Unis |
Les canaux ioniques sont des protéines membranaires qui catalysent le passage de 106 à 108 ions par seconde, ce qui est 1 000 à 10 000 fois supérieur au taux de passage des ions via des systèmes de transport comme les transporteurs et les co-transporteurs ioniques. Même si les canaux se distinguent par leur grande perméabilité aux ions, certains n’en demeurent pas moins très sélectifs, ce qui leur permet de discriminer des cations monovalents de taille relativement semblable comme les ions K+ et Na+. Ces deux dernières propriétés, sélectivité et conductance, sontapparemment contradictoires car le canal ionique se doit d’inter-agir fortement avec l’ion présent pour faire preuve de sélectivité, tout en assurant un niveau d’interaction suffisamment faible pour maintenir un flux important d’ions. Quelles sont les propriétés moléculaires, voire atomiques, qui permettent à ces protéines membranaires spécialisées de réconcilier sélectivité et conductance ? Ce problème fondamental, qui a fait l’objet de recherches intensives depuis des décennies, a été en partie résolu grâce aux travaux des équipes respectives de R. MacKinnon et B. Roux publiés récemment dans la revue Nature [1–3]. |
La notion de barrière d’énergie La nature du processus de diffusion des ions à travers les membranes biologiques a toujours constitué un problème clé dans l’étude des propriétés électrophysiologiques des cellules. En effet, Hodgkin et Keynes avaient déjà mis en évidence, en 1955, que le rapport des flux unidirectionnels de K+ dans l’axone géant de la seiche Sepia officinalis était plus grand que la valeur prédite pour un simple sys-tème de diffusion sans interaction entre les ions. Ils conclurent que les canaux ioniques pouvaient contenir au moins deux ions à la fois et que la diffusion devait probablement s’effectuer à la file indienne. Heckmann [4], et plus particulièrement Laüger [5], intégrèrent alors la notion debarrières d’énergie au profil de diffusion des ions dans la membrane. Selon ce modèle, les ions seraient localisés dans des sites de liaison et acquéraient occasionnellement assez d’énergie pour sauter d’un site de liaison dans un site de liaison voisin. La diffusion d’un ion dans un canal nécessiterait donc que l’ion surmonte, à chaque déplacement microscopique, une barrière d’énergie provenant des interactions avec son milieu environnant. Le calcul de la vitesse de déplacement des ions supposait toutefois des barrières d’énergie nettement plus élevées que les fluctuations d’énergie thermique associées aux mouvements des ions. A cet égard, il était communément admis que la déshydratation des ions (la perte des molécules d’eau) à leur entrée dans le canal constituait la plus haute barrière d’énergie que devait surmonter un ion pour diffuser dans un canal ionique. Ce modèle se doit toutefois d’être révisé à la lumière des résultats de MacKinnon et Roux. |
Des modèles cinétiques et moléculaires aux premières données structurales Les modèles cinétiques et moléculaires des canaux ioniques se sont développés de façon significative dans les années 1980-1990 grâce à la mise au point de la méthode du patch-clamp par Neher et Sakmann (ce qui leur valut le Prix Nobel (→) en 1991) et aux progrès fulgurants de la biologie moléculaire. Au niveau moléculaire, entre autres, les études de mutagenèse dirigée ont permis d’identifier les principaux acides aminés responsables de la sélectivité des canaux ioniques. C’est ainsi qu’il a été établi que quatre acides aminés chargés négativement (acides glutamiques) stabilisent les ions calciques dans les canaux Ca2+ [6, 7]. Dans les canaux potassiques, ce sont les acides aminés GYG (glycine-tyrosine-glycine) qui forment les éléments constitutifs du filtre de sélectivité pour les ions K+, mais on ignorait toujours la géométrie du pore ainsi que le nombre de sites de liaison pour les ions K+ dans le pore. La cristallisation du canal KcsA, en 1998, par le groupe de R. MacKinnon [8], un canal potassique présent dans la bactérie Streptomyces lividans, a représenté une véritable percée. Pour la première fois, il a été possible de visualiser l’interaction entre les ions potassiques, les molécules d’eau et les résidus carbonyles des acides aminés GYG à une résolution de 3,2 Å. La structure moléculaire indique que le canal potassique est pourvu d’une large cavité hydrophile d’un diamètre de 10 Å en contact avec le milieu cytoplasmique. Cette cavité interne se rétrécit considérablement au niveau du filtre de sélectivité (GYG) qui, lui, fait face au milieu extracellulaire. La région du filtre de sélectivité possède non seulement des dimensions qui lui permettent d’accommoder parfaitement un ion potassique déshydraté, mais la projection des groupes carbonyles des acides aminés GYG vers le milieu du canal confère à la région du pore une électronégativité nette qui stabilise les ions K+ positifs. (→) m/s 1987, n°9, p. 538 |
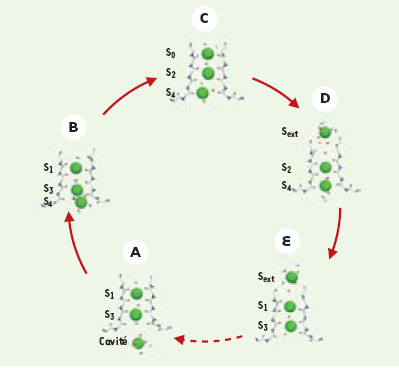
Une image saisissante de la diffusion ionique L’équipe de R. MacKinnon réussit cette année un doublé en publiant une structure atomique plus fine encore du même canal potassique. La nouvelle structure cristalline obtenue à une résolution de 2 Å [2] offre un tableau saisissant de la diffusion ionique en montrant très clairement les ions K+ qui se suivent à la file dans le canal potassique (Figure 1). Ce niveau de définition permet d’éclairer sous un angle nouveau les interactions physico-chimiques responsables de la diffusion ionique grâce à trois observations expérimentales clés : la présence de huit molécules d’eau dans la large cavité interne du canal, la présence de quatre sites de liaison distincts pour les ions potassiques dans le filtre de sélectivité et l’apparition surprise de deux sites extracellulaires de liaison pour les ions potassiques situés juste à la sortie du filtre de sélectivité. De façon remarquable, ces sites externes de liaison nommés S0 et Sexterne, avaient déjà été prédits indépendamment par l’équipe de Benoît Roux [3] à partir de calculs d’énergie libre en utilisant les coordonnées atomiques de la structure cristalline de 3,2 Å. Il existerait près de six sites de liaison distincts le long de l’axe du canal potassique (en excluant le site de liaison dans la cavité interne) dont la moitié seulement serait occupée simultanément par des ions potassiques, l’autre moitié étant occupée par des molécules d’eau.  | Figure 1. Modèle de diffusion des ions K+ à travers le pore du canal KcsA. Le canal KcsA est un tétramère, mais seules deux des quatre sous-unités sont représentées dans cette coupe longitudinale du canal ionique. Les flèches vertes indiquent que les déplacements d’ions dans le pore se produisent de façon concertée et ordonnée du milieu intracellulaire vers le milieu extracellulaire. Les dimensions atomiques des différents compartiments ont été estimées à partir de la structure cristalline. Il existe sept sites distincts de liaison pour les ions K+ le long du pore du canal. Le premier site se trouve dans la cavité du canal et possède un ion en permanence. L’ion K+ (en rouge) y est entouré de huit molécules d’eau (en bleu) géométriquement placées pour lui procurer une coordination optimale. Le filtre de sélectivité contient quatre sites, mais seuls deux de ces sites sont occupés simultanément ; les ions K+ sont toujours séparés par un site libre. Enfin, les chaînes latérales (non représentées) des acides glutamique 71 et aspartique 80 forment un site de liaison pour les ions K+ distinctement extracellulaires alors que les quatre acides aminés glycine 79 (non représentés) sont responsables d’un site de liaison intermédiaire entre le filtre de sélectivité et le milieu extracellulaire. Comme cela est discuté dans le texte, la diffusion des ions se produit sans grande dépense énergétique à une vitesse proche de la simple diffusion dans l’eau grâce à la présence de ces sept sites de liaison qui stabilisent le passage d’ions chargés dans une membrane lipidique hydrophobe. |
La résolution de la structure cristalline en présence de différentes concentrations d’ions potassiques a permis de reconstituer une image dynamique du passage des ions en conditions quasi physiologiques. Selon cette reconstitution, les ions potassiques dans la région étroite du filtre de sélectivité se répartiraient entre quatre sites distincts, par groupes de deux, dans des configurations bien précises S1, S3 ou S2, S4. Les ions potassiques seraient toujours séparés par une molécule d’eau de façon à minimiser la répulsion ion-ion dans le canal. Des calculs fondés sur ce modèle suggèrent que le passage concerté d’une configuration à une autre se ferait en moins de 1 nanoseconde (10-9 s). D’après l’analyse du groupe de MacKinnon, le passage d’un site à un autre ne devrait pas requérir beaucoup plus d’énergie que la simple diffusion des ions dans l’eau [1]. Ainsi, contrairement au modèle de Laüger, les barrières d’énergie seraient pratiquement absentes de la topologie interne du canal. La diffusion des ions dans le filtre procéderait par un mécanisme de knock-on où l’en-trée d’un ion dans le filtre de sélectivité mène à la sortie d’un des ions déjà présents au site S1 vers les sites externes S0 et S-externe. La force motrice du déplacement des ions serait déterminée par l’important gradient électrochimique d’ions potassiques de part et d’autre de la membrane ([K+] externe = 5 mM ; [K+] interne = 150 mM). C’est à ce niveau qu’intervient la large cavité aux parois hydrophobes située du côté intracellulaire. Parce qu’elle contient en permanence un seul ion potassique coordonné par huit molécules d’eau, la cavité maintient une concentration ionique d’ions potassiques estimée à ≈ 2 M : un véritable réservoir d’ions prêts à se lancer dans la région du filtre de sélectivité quand celui-ci se libère d’un autre ion dans le milieu extracellulaire. L’observation très distincte de deux nuages électroniques dans la structure cristalline suggère que les ions potassiques sont déjà stabilisés dans le milieu extracellulaire par la projection des groupements carbonyles de la chaîne amine principale des quatre résidus glycine (G79) et, plus loin encore dans la solution extracellulaire, par la projection des chaînes latérales des quatres résidus glutamate (E71) et aspartate (D80). La dernière observation étonnante issue de la structure cristalline à haute résolution concerne la nature de la sphère d’hydratation des ions potassiques présents dans la cavité interne du canal. Pour la première fois, les huit molécules d’eau qui entourent un seul ion potassique ont été détectées individuellement. Elles forment les huit coins d’un cube asymétrique qui emprisonne l’ion potassique au centre grâce à la projection des atomes d’oxygène vers l’intérieur. L’arrangement octaédrique des molécules d’eau dans la cavité interne rappelle la coordination des ions potassiques par les groupes carbonyles dans le filtre de sélectivité et pourrait signaler que la structure des canaux potassiques a évolué de façon à reproduire les conditions optimales de coordination des ions potassiques en solution aqueuse. |
Quand les calculs rejoignent les données structurales… Si les données cristallographiques du groupe de MacKinnon offrent une description détaillée de la structure du canal KcsA, celle-ci est toutefois figée dans le temps. L’approche complémentaire choisie par Bernèche et Roux [3] consiste plutôt à calculer par ordinateur l’énergie libre des ions potassiques à l’intérieur du filtre de sélectivité (Figure 2). Leurs calculs ont été entrepris bien avant que ne soient connues les coordonnées atomiques de la structure cristalline à 2 Å. En prenant comme point de départ les coordonnées atomiques de la structure cristalline à 3,2 Å, les auteurs ont calculé l’énergie libre du canal en fonction de la position de chacun des ions dans le pore. Cette approche a permis de contourner les problèmes techniques liés à une simulation de dynamique moléculaire proprement dite où les temps considérés (10-12-10-9 s) sont nettement inférieurs au temps moyen de diffusion d’un ion dans un canal (10-6-10-7s). Le profil d’énergie obtenu ici par des études de dynamique moléculaire est compatible avec la présence de six sites préférentiels d’occupation pour les ions K+ (S4, S3, S2, S1, S0 et S-externe) qui s’ajoutent au site de liaison présent dans la cavité interne. Quatre de ces sites avaient déjà été identifiés dans le filtre de sélectivité à partir de la structure cristalline (3,2 Å) du KcsA publiée en 1998 [8]. La prédiction d’un site additionnel à la limite externe du filtre de sélectivité (S0) et celle du site externe (Sexterne) où l’ion est pleinement hydraté en solution a été confirmée par l’équipe de MacKinnon dans la structure cristallographique obtenue à 2 Å. Le profil optimal d’énergie libre pour le passage des ions requiert la présence d’un ion localisé dans la cavité interne du canal qui, en se déplaçant vers le filtre de sélectivité, pousse les deux ions présents dans le filtre vers les sites voisins supérieurs, ce qui entraîne la sortie de l’ion le plus éloigné (S1) du côté extracellulaire (Figure 2). Le processus de conduction implique donc une série de transitions entre des états distincts caractérisés par la présence, respectivement, de deux ou de trois ions dans le filtre de sélectivité. Les calculs d’énergie libre démontrent également de façon directe que le processus de diffusion par knock-on se produit en l’absence de barrières très élevées (2-3 kcal/mol), un résultat somme toute remarquable considérant l’énergie élevée d’hydratation des ions K+. 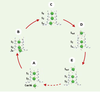 | Figure 2. Principales étapes microscopiques élémentaires qui mènent à la conduction d’un ion potassique.Les schémas dépeignent la situation physiologique dans laquelle le canal potassique conduit les ions K+ de l’intérieur vers l’extérieur. A. Le cycle de diffusion des ions commence dans une configuration qui place deux ions dans le filtre de sélectivité (S3, S1) alors qu’un seul ion est présent dans la large cavité hydrophile. B. Les ions se déplacent ensuite de façon concertée vers un état qui place d’abord trois ions dans le filtre (S4, S3, S1). C. Les ions présents dans les sites S3 et S1 progressent vers les sites S2 et S0 (site légèrement à l’extérieur du filtre de sélectivité). D. L’ion présent dans le site S0 s’échappe finalement dans le site Sexterne. E. Ce mouvement entraîne le déplacement des ions logés dans les sites S2 et S4 vers les sites S1 et S3 respectivement, le site S1 ayant été laissé vacant par l’ion qui est sorti. La flèche en pointillé signifie que l’ion externe (S-externe) doit s’éloigner du canal vers le milieu extracellulaire avant qu’un autre ion provenant du milieu intracellulaire puisse pénétrer dans la cavité. Les ions sont ainsi revenus à la configuration initiale et le cycle de diffusion peut se répéter. Les calculs de Bernèche et Roux ont démontré qu’aucune de ces étapes n’implique des variations d’énergie libre aussi importantes que celles qui sont associées aux fluctuations thermiques spontanées observées dans tout système moléculaire. Les variations de potentiel transmembranaire, mesurées pendant le potentiel d’action par exemple, suffisent à pousser les ions K+ vers l’extérieur sans que les ions aient à surmonter des barrières d’énergie significatives qui s’opposeraient aux mouvements des ions. Le canal potassique peut en conséquence conduire les ions très rapidement. |
|
… mais s’en éloignent parfois Les travaux de Bernèche et Roux complètent donc les grandes conclusions du travail expérimental de l’équipe de MacKinnon à quelques nuances près. Tout d’abord, leurs calculs confirment que la diffusion ionique dans le filtre de sélectivité se produit en dépensant un minimum d’énergie libre. L’analyse mathématique révèle que les forces de répulsion entre les ions potassiques contribuent activement aux propriétés de conduction rapide du canal ionique. De plus, la sélectivité K+/Na+ du canal est principalement déterminée par le site de liaison S2 dans le filtre : en effet, l’énergie potentielle de ce site augmente considérablement en présence d’un ion Na+. Cependant, tandis que l’équipe de MacKinnon soutient que la sélectivité du canal pour les ions potassiques provient essentiellement de contraintes géométriques conférées par un pore rigide, les calculs mathématiques soulignent que les fluctuations dynamiques des atomes d’oxygène qui tapissent la paroi du pore sont bien plus importantes que les différences entre les rayons des ions Na+ et K+. De fait, parce qu’elles augmentent l’entropie, les fluctuations dynamiques qui se produisent au niveau du filtre de sélectivité contribuent fortement à l’énergie libre des ions dans les sites de liaison. La contribution variable de ces fluctuations dynamiques d’un canal K+ à un autre pourrait expliquer le large éventail des conductances unitaires répertoriées pour les canaux potassiques dans les cellules de mammifères. Non seulement le passage des ions dans le canal ne requiert pas une grande dépense énergétique mais l’entrée des ions dans le canal se produit avec un minimum de changement dans l’énergie potentielle des ions. De fait, la présence des deux nuages électroniques à l’extérieur du canal, observée dans la structure cristalline, avait été précédemment prédite par les calculs d’énergie libre. Ainsi, Bernèche et Roux démontrent que la déshydratation des ions à l’entrée du pore pourrait être adiabatique, c’est-à-dire sans production ni dépense d’énergie. Cette conclusion est d’autant plus inattendue qu’elle remet en cause un des dogmes les plus tenaces de la théorie des canaux ioniques, c’est-à-dire que la déshydratation des ions (qui se départissent des molécules d’eau qui les recouvrent en solution pour entrer dans le canal) constitue l’étape limite de la conduction à travers les canaux ioniques. |
Ainsi, la géométrie du canal potassique qui possède une grande cavité hydrophobe en contact avec le milieu intracellulaire semble favoriser la diffusion directionnelle des cations, du milieu intracellulaire vers le milieu extracellulaire, ce qui correspond au gradient d’ions K+ en conditions physiologiques. Lorsque les concentrations d’ions K+ sont symétriques de part et d’autre du canal, les courants sontlinéaires [9], ce qui suppose que les flux ioniques entrants demeurent toutefois possibles dans cette configuration. Il reste maintenant à évaluer dans quelle mesure ce modèle moléculaire s’applique aux canaux ioniques sélectifs pour les ions sodiques ou calciques qui favorisent plutôt les flux entrants en conditions physiologiques. Dans le cas des canaux calciques plus particulièrement, on imagine mal comment une cavité interne en contact avec le milieu intracellulaire pourrait concentrer des ions calciques jusqu’à 1 à 2 M alors que le milieu intracellulaire maintient une concentration libre d’ions calciques de 0,1 µM, c’est-à-dire 10 millions de fois plus petite. Déjà, la structure quaternaire d’un canal potassique Shaker [10] et celle d’un canal sodique [11] obtenue en cryo-microscopie électronique avec une résolution plus faible de 19 à 25 Å suggère que le pore central de ces canaux n’est pas directement relié aux solutions extracellulaire et intracellulaire comme le canal KcsA. Les images reconstituées montrent plutôt une région centrale qui se divise entre quatre branches distinctes qui seraient, elles, reliées aux milieux interne et externe. Des réponses à ces questions seront sûrement apportées bientôt. Le clonage récent d’un canal sodique bactérien (Bacillus halodurans) [12], quatre fois plus petit que le canal sodique des cellules nerveuses, ouvre peut-être la porte à la première cristallisation d’un canal sodique. Avis aux électrophysiologistes et aux autres chercheurs en sciences biomédicales, tout n’est pas encore dit. |
1. Morais-Cabral JH, Zhou Y, MacKinnon R. Energetic optimization of ion conduction rate by the K selectivity filter. Nature 2001; 414 : 37–42. 2. Zhou Y, Morais-Cabral JH, Kaufman A, MacKinnon R. Chemistry of ion coordination and hydration revealed by a K channel-Fab complex at 2.0 Å resolution. Nature 2001; 414 : 43–8. 3. Berneche S, Roux B. Energetics of ion conduction through the K channel. Nature 2001; 414 : 73–7. 4. Heckmann K. Single file diffusion. Biomembranes 1972; 3 : 127–53. 5. Lauger P. Ion transport through pores: a rate-theory analysis. Biochim Biophys Acta 1973; 311 : 423–41. 6. Yang J, Ellinor PT, Sather WA, Zhang JF, Tsien RW. Molecular determinants of Ca2+ selectivity and ion permeation in L-type Ca2+ channels. Nature 1993; 366 : 158–61. 7. Parent L, Gopalakrishnan M. Glutamate substitution in repeat IV alters divalent and monovalent cation permeation in the heart Ca2+ channel. Biophys J 1995; 69 : 1801–13. 8. Doyle DA, Cabral JM, Pfuetzner RA, et al. The structure of the potassium channel: molecular basis of K+ conduction and selectivity. Science 1998; 280 : 69–77. 9. LeMasurier M, Heginbotham L, Miller C. KcsA: it’s a potassium channel. J Gen Physiol 2001; 118 : 303–14. 10. Sokolova O, Kolmakova-Partensky L, Grigorieff N. Three-dimensional structure of a voltage-gated potassium channel at 2.5 nm resolution. Structure (Camb) 2001; 9 : 215–20. 11. Sato C, Ueno Y, Asai K, et al. The voltage-sensitive sodium channel is a bellshaped molecule with several cavities. Nature 2001; 409 : 1047–51. 12. Ren D, Navarro B, Xu H, Yue L, Shi Q, Clapham DE. A prokaryotic voltage-gated sodium channel. Science 2001; 294 : 2372–5. |