| |
| Med Sci (Paris). 2002 May; 18(5): 530–532. Published online 2002 May 15. doi: 10.1051/medsci/2002185530.
Les polykystoses rénales : le gène de la forme récessive enfin identifié
Simone Gilgenkrantz 9, rue Basse, 54330 Clerey-sur-Brenon, France |
Le caractère héréditaire des polykystoses rénales (
polycystic kidney disease,
PKD), maladies génétiques fréquentes et de pronostic grave, fut évoqué dès le XIX
e
siècle. Vers 1960, la distinction entre PKD autosomiques dominantes (AD) et PKD autosomiques récessives (AR) fut clairement définie. La forme ADPKD se manifeste le plus souvent à l’âge adulte, tandis que la forme ARPKD se manifeste dans l’enfance. Entre 1994 et 1997,
médecine/sciences
n’a pas manqué de faire part à ses lecteurs des importantes découvertes qui ont permis de comprendre les mécanismes moléculaires des ADPKD. Mais, malgré les efforts déployés et la découverte du locus en 6p21-p12 en 1994, le mystère restait entier pour les formes ARPKD. Le groupe de la
Mayo Clinic
, avec Peter C. Harris, qui avait déjà participé à l’identification du gène dominant
PKD1
, vient enfin d’isoler le gène en cause dans les ARPKD.
|
Formes dominantes et polycystines
Les polykystoses rénales dominantes sont des maladies extrêmement fréquentes (affectant 1/400 à 1/1 000 personnes) dont les premières manifestations cliniques surviennent vers latroisième ou la quatrième décennie de la vie, mais avec une extrême diversité interet même intra-familiale, allant de la découverte de quelques kystes asymptomatiques à une polykystose extensive. Le développement des kystes, la fibrose interstitielle et des phénomènes apoptotiques entraînent une destruction du parenchyme rénal évoluant vers une insuffisance rénale terminale vers l’âge de 50 à 60 ans chez plus de 50 % des sujets atteints [
1
]. Il existe en outre des manifestations extra-rénales : polykystose hépatique sans gravité (et plus fréquente chez les femmes) et anomalies vasculaires cérébrales à type d’anévrisme.
(→) m/s 1994, n°6-7, p. 760
Deux locus avaient été identifiés : en 16p13.3-p13.12, répondant à 85 % des familles, et en 4q21-23 pour la plupart des autres, permettant une classification en PKD1 et PKD2 avec des tableaux cliniques identiques. Quelques rares familles semblent ne correspondre ni à l’un ni à l’autre de ces deux locus et ont été regroupées en PKD3, mais la réalité de ce groupe est incertaine [
2
].
Il aura fallu 9 ans pour que le gène principal
PKD1
soit identifié, en grande partie grâce à une translocation (16;22) dans une famille de patients atteints de polykystose rénale (→), car sa recherche était rendue difficile par la présence de copies avoisinantes.
PKD1
comporte 46 exons et code pour une protéine appelée polycystine 1. Elle appartient à une famille de protéines très conservée au cours de l’évolution (retrouvée chez l’oursin et chez
Coenorhabditis elegans
). Puis, 3 ans après sa localisation en 4q21-23, le gène
PKD2
, codant pour la polycystine 2, fut identifié. Cette dernière, de la même famille, a besoinde la polycystine 1 pour être transloquée dans la membrane plasmique. On sait à présent que les deux protéines interagissent pour former, avec d’autres protéines, un complexe formant un canal cationique perméable au calcium quirègle la morphologie et la fonction tubulaire [
3
]. Par l’étude des cellules des kystes, qui ont un caractère clonal, il semble que la mutation s’effectue en deux étapes : mutation germinale puismutation somatique (→). Celle-ci peut survenir soit dans
PKD1
, soit dans
PKD2,
quelle que soit la mutation germinale initiale (état transhétérozygote, connu chez la drosophile, mais qui n’avait pas encore été observé chez l’homme) [
4
]. Les mutations sont très variées et s’étendent sur toute la longueur des gènes. D’après des études chez le rat, il se pourrait que la tubérine, dont le gène
TSC2
est adjacent de
PKD1
, joue un rôle pour la localisation fonctionnelle de la polycystine 1 et puisse conditionner la gravité de la maladie [
5
].
(→) m/s 1997, n°3, p. 410
|
Forme récessive et fibrocystine
Les manifestations cliniques de la polykystose rénale de type récessif se situent à la période périnatale et le diagnostic peut être porté par échographie fœtale avant la naissance, en raison d’un gros rein hyper-échogène, d’un oligoamnios avec hypoplasie pulmonaire consécutive. Les kystes se développent à partir du canal collecteur alors qu’ils se développent à partir de tous les segments tubulaires dans la forme dominante. La forme récessive est constamment associée à une atteinte hépatique, dénommée fibrose hépatique congénitale, fibroadénomatose biliaire ou dysgénésie biliaire. Un diagnostic prénatal peut être réalisé [
6
]. C’est une des causes majeures de morbidité et de mortalité rénale infantile. Les nouveau-nés peuvent présenter un syndrome de Potter (avec dysmorphie faciale caractéristique). Chez 50 % des enfants qui survivent à la période néonatale, une insuffisance rénale sévère apparaît dans la première décennie de la vie. Toutefois, chez la moitié des enfants qui survivent, l’insuffisance rénale apparaîtra plus tard, après l’âge de 15 ans.
Le locus (qui semble unique) a été identifié il y a plus de sept ans, en 6p21.1-p12, et la recherche du gène fut encore plus difficile que pour les formes autosomiques dominantes.
Pour l’équipe de Peter C. Harris qui vient de l’identifier, l’obtention d’un modèle animal fut déterminante. Plusieurs modèles murins de polykystose rénale avaient été décrits, mais aucun ne correspondait au locus humain. Toutefois, récemment, un rat
pck
, atteint de polykystose rénale et de fibrose hépatique congénitale a été décrit [
7
]. La région du locus, sur le chromosome 9 murin, était synténique de la région ARPKD sur le bras court du chromosome 6 humain. Il est intéressant de constater que le recours aux programmes de prédiction des gènes a été ici à la fois utile et trompeur : 49 des 67 exons de
PKHD1
avaient été prédits, mais comme appartenant à 4 gènes, alors qu’en fait, il n’en existe qu’un seul [
8
]. Il manquait 14 exons, et les sites d’épissage sur 4 exons, ainsi que 15 exons, étaient erronés. C’est grâce à la technique RT-PCR, à partir d’ARN de rein humain adulte, qu’un unique transcrit fut obtenu. Le gène
PKHD1
(pour
polycystic kidney and hepatic disease
), d’environ 16 kb, est exprimé dans le rein, fœtal et adulte, ainsi que dans le foie et le pancréas adultes. Il comporte 67 exons et code pour une protéine appelée fibrocystine. L’implication de
PKHD1
est confirmée par la mise en évidence, chez 11 malades de familles différentes, de mutations (6 tronquantes et 12 fauxsens). Aucun des malades n’était porteur de deux mutations tronquantes, mais 8 d’entre eux étaient des hétérozygotes composites. Il est encore trop tôt pour pouvoir établir des corrélations phénotype-génotype. Dans trois familles (le locus étant bien en 6p21), aucune mutation n’a été trouvée. La présence d’un autre gène est peu probable, mais il faut à présent travailler sur de plus grandes cohortes de familles pour exclure une hétérogénéité génétique. Il est probable aussi que, dans certains groupes ethniques, en Afrique du Sud par exemple où la maladie est plus fréquente [
9
], en Espagne [
10
], ou, à plus forte raison, chez les Druzes (population à forte endogamie) [
11
], il existe des mutations communes, et des sujets homozygotes pour certaines d’entre elles, ce qui faciliterait le diagnostic prénatal moléculaire.
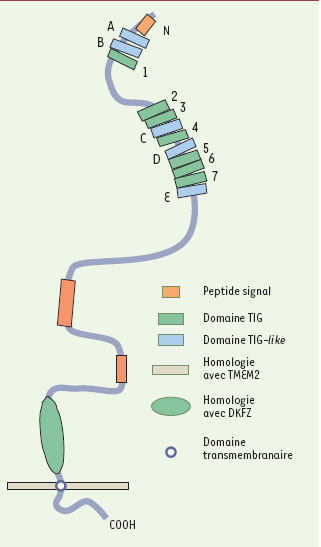
Quant à la structure et à la fonction de la fibrocystine, il est encore difficile de les définir puisqu’il s’agit d’une nouvelle protéine qui ne correspond à aucune protéine connue (
Figure 1
). Elle doit posséder un important domaine extracellulaire, avec des domaines TIG et TIG-
like
, comme les plexines et le HGFR (
hepatocyte growth factor receptor
). Il existe aussi une homologie de séquence avec TMEM2 (
transmembrane protein 2
), une protéine isolée par hasard, de fonction encore inconnue, qui possède un seul domaine transmembranaire [
12
]. L’extrémité cytoplasmique de la fibrocystine est courte et possède des sites de phosphorylation. Il est donc possible qu’il s’agisse d’un récepteur intervenant dans la différenciation des tubes collecteurs et des canaux biliaires.
 | Figure 1.
Structure présumée de la fibrocystine.
Domaines TIG et TIG-
like
et régions d’homologie avec d’autres protéines, TMEM2 et DKFZ, de fonction inconnue (d’après [
8
]).
|
|
La découverte du gène
PKHD1
va faire entrer dans une phase nouvelle les études sur l’ARPKD. La connaissance de la fonction de la fibrocystine sera très précieuse pour comprendre les mécanismes pathogéniques des polykystoses. Le modèle du rat sera aussi très utile pour l’étude des mécanismes pathogéniques au cours du développement et pour tester de nouvelles stratégies thérapeutiques [
13
].
|
1.
Pirson Y, Chauveau D, Watson ML, Zeier M, Breuning MH. La polykystose autosomique dominante : progrès cliniques et génétiques.
Med Sci
1997; 13 : 37–44.
2.
Paterson AD, Pei Y. Is there a third gene for autosomal dominant polycystic kidney disease ?
Kidney Int
1998; 54 : 1759–61.
3.
Hanaoka K, Qian F, Boletta A,
et al.
Co-assembly of polycystin-1 and -2 produces unique cation-permeable currents.
Nature
2000; 408 : 990–4.
4.
Koptides M, Mean R, Demetriou K, Pierides A, Deltas CC. Genetic evidence of a trans-heterozygous model for cystogenesis in autosomal dominant polycystic kidney disease.
Hum Mol Genet
2000; 9 : 447–52.
5.
Kleymenova E, Ibraghimov-Breskrovnaya O, Kugoh H,
et al.
Tuberin-dependent membrane localization of polycystin-1 : a functionallink between polycystic kidney disease and the
TSC2
tumor suppressor gene.
Mol Cell
2001; 7 : 823–32.
6.
Zerres K, Mucher G, Becker J,
et al.
Prenatal diagnosis of autosomal recessive polycystic kidney disease (ARPKD) : molecular genetics, clinical experience, and fetal morpholo-gy
. Am J Med Genet
1998; 76 : 137–44.
7.
Lager DJ, Qian Q, Bengal RJ, Ishibashi M, Torres VE. The pck rat: a new model that resembles human autosomal recessive polycystic kidney and liver disease.
Kidney Int
2001; 59 : 126–36.
8.
Ward CJ, Hogan MC, Rossetti S,
et al.
The genemutated in autosomal recessive polycystic kidney disease encodes a large receptor-like protein.
Nat Genet
2002; 30 : 259–69.
9.
Ramsay M, Reeders ST, Thompson PD,
et al.
Mutations for the autosomal recessive and autosomal dominant forms of polycystic kidney disease are not allelic.
Hum Genet
1988; 79 : 73–5.
10.
Martinez-Frias ML, Bermejo E, Cereijo A, Sanchez M, Lopez M, Gonzalo C. Epidemiological aspects of mendelian syndromes in a Spanish population sample. II. Autosomal recessive malformation syndromes.
Am J Med Genet
1991; 38 : 626–9.
11.
Naveh Y, Roguin N, Ludatscher R, Auslaender L, Schrame KA, Aharon M. Congenital hepatic fibrosis with congenital heart disease : a family study with ultrastructural features of the liver.
Gut
1980; 21 : 799–807.
12.
Scott DA, Drury S, Sundstrom RA,
et al.
Refining the DFNB7-DFNB11 deafness locus using intragenic polymorphisms in a novel gene,
TMEM2
.
Gene
2000; 246 : 265–74.
13.
Coffman TM. Another cystic mystery solved.
Nat Genet
2002; 30 : 247–8.
|