Les PI3-kinases sont une famille d’enzymes qui synthétisent des seconds messagers lipidiques, les D3-phosphoinositides. Ces phospho-inositides jouent un rôle majeur dans la régulation de plusieurs réponses cellulaires, notamment la prolifération et la survie [5–7]. En se liant spécifiquement à des domaines protéiques fonctionnels (domaines PH, pleckstrin homology, FYVE ou PhoX), les D3-phospho-inositides permettent l’ancrage membranaire de protéines cytosoliques, organisant ainsi de manière spatio-temporelle l’activation de grandes voies de signalisation intracellulaire [5,7]. Le taux de ces seconds messagers lipidiques est strictement contrôlé par l’équilibre entre des PI 3-kinases qui les synthétisent et des phosphatases qui les hydrolysent de façon spécifique [7]. Or, plusieurs enzymes du métabolisme des D3-phospho-inositides, notamment les PI3-kinases de classe IA, sont impliquées dans des pathologies humaines [6], et notamment le développement de cancers [5,6]. Elles interviennent en tant qu’intermédiaires dans la transmission de signaux mitogéniques et de survie, mais sont aussi indispensables à l’effet transformant de plusieurs oncogènes à activité tyrosine kinase [5,6]. Certaines tumeurs humaines sont associées à une amplification du gène codant pour une PI 3-kinase de classe IA, ou à une surexpression et une activation de cette lipide kinase [5,6]. Aucune mutation activatrice de PI3-kinase n’a encore été rapportée dans des cancers humains. Toutefois, l’oncogène rétroviral v-p3k, un orthologue actif de la PI3-kinase de classe IA, a été isolé du sarcoma virus aviaire ASV16 qui induit des hémangiosarcomes chez le poulet [5,6]. Plusieurs enzymes stimulées en aval de la PI3-kinase, notamment le proto-oncogène Akt, sont également surexprimées et/ou activées dans divers types de cancers humains [5,6]. Les PI 3-kinases de classe IA ou des protéines activées en aval pourraient donc être des cibles dans le traitement d’un certain nombre de cancers [6].
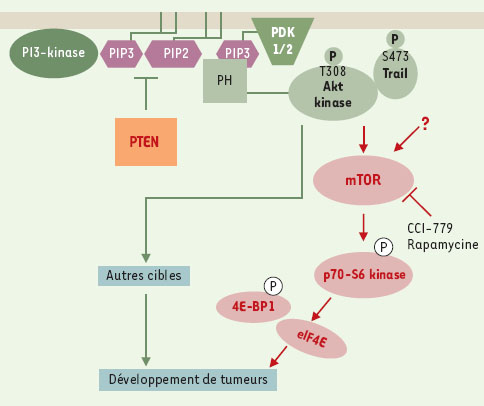
Une alternative pour activer les voies dépendantes des PI3-kinases est d’empêcher la dégradation des seconds messagers lipidiques produits par cette enzyme, notamment le phosphatidylinositol 3,4,5-trisphosphate (PtdIns[3,4,5]P3) et le phosphatidylinositol 3,4-bisphosphate (PtdIns[3,4]P2). Le gène PTEN, considéré comme un suppresseur de tumeur, code pour une enzyme à activité protéine tyrosine phosphatase et lipide phosphatase. PTEN est en quelque sorte une « anti-PI3-kinase » puisqu’elle est capable d’hydrolyser le phosphate en position 3 du PtdIns(3,4,5)P3 et du PtdIns(3,4)P2, une fonction indispensable à son activité de suppresseur de tumeur [8]. Or, des mutations germinales de PTEN, associées au développement de maladies telles que la maladie de Cowden, augmentent fortement le risque de développement de tumeurs, en particulier du sein et de la thyroïde [8–10]. De plus, des mutations somatiques de PTEN sont fréquemment associées à des cancers humains tels que les glioblastomes et les adénocarcinomes de la prostate, de l’endomètre et de l’ovaire [9]. A l’inverse, la surexpression de PTEN peut conduire à un arrêt de la prolifération cellulaire et à l’apoptose [10].
D’un point de vue moléculaire, un défaut d’activité de PTEN conduit à une accumulation intracellulaire de PtdIns (3,4,5)P3. Ce lipide va alors contribuer à l’activation de plusieurs protéines contenant des domaines PH, notamment les kinases PDK et Akt [5,7]. L’expression d’une forme active de la sérine/thréonine kinase Akt peut prévenir plusieurs des effets de PTEN, suggérant que cette kinase est l’un des effecteurs principaux de la voie PI3-kinase/PTEN dans le contrôle de la prolifération et de la survie cellulaire [10]. Cependant, bien qu’Akt apparaisse comme une cible pharmacologique de choix, il n’existe à ce jour aucun inhibiteur spécifique de cette kinase.