La maladie des exostoses multiples (HME), maladie héréditaire peu fréquente, est caractérisée cliniquement par la présence d’exostoses ou ostéochondromes se développant principalement au niveau des métaphyses des os longs. Elle affecte les enfants, de la petite enfance à la puberté, et à l’âge adulte les ostéochondromes peuvent dégénérer en chondrosarcomes (0,5 % à 5 % des cas). Transmise sur le mode autosomique dominant, la maladie des exostoses multiples se caractérise par une hétérogénéité génétique puisque les études de liaison ont abouti à l’identification de 3 locus (EXT1, EXT2 et EXT3) localisés respectivement sur les chromosomes 8q, 11p et 19p. Des études moléculaires menées à la fois chez l’humain, la souris, le nématode et la drosophile ont permis d’identifier une nouvelle famille de gènes les EXTet EXTL (EXT-like). Des pertes d’hétérozygotie à un ou plusieurs locus EXTFassociées à la formation de chondrosarcomes confèrent à ces gènes EXT une fonction suppresseur de tumeur. Deux des gènes responsables de la maladie, EXT1 et EXT2 ont été clonés et séquencés [1, 2]. Ils codent pour des protéines ubiquitaires de 746 (EXTl) et 718 (EXT2) acides aminés appelées «exostosines» dans lesquelles ont été identifiés un domaine transmembranaire de type II, un petit domaine amino-terminal cytoplasmique et une grande région carboxy-terminale globulaire. Jusqu’en 1998, le rôle précis de ces protéines est resté méconnu. Plusieurs approches récentes ont conduit à des avancées significatives. Ainsi l’existence d’une lignée de cellules Sog9 déficientes en héparanes sulfates a permis de démontrer que le gène EXTl code pour une glycosyltransfé-rase impliquée dans l’élongation des chaînes glycaniques des héparanes sulfates, une classe de protéoglycanes impliqués dans le contrôle de la croissance tumorale [3].
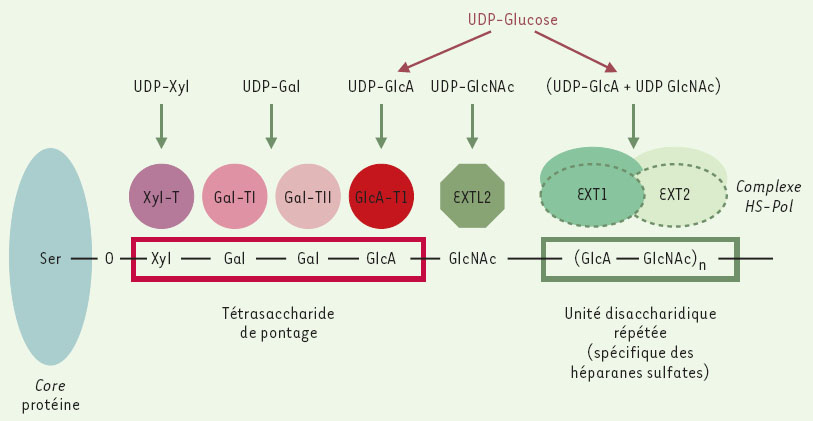
Des travaux complémentaires ont montré que la protéine codée par EXT2 est également une glycosyltransférase qui comme EXT1 possède deux activités catalytiques, une activité glucuronyl transférase (GlcA-T) et une activité N-acétylglucosaminyltransférase (GlcNAc-T) permettant la fixation alternée de résidus acide glucuronique et N-acétyl glucosamine sur un tétrasaccharide de pontage lui même relié à la core protein par un résidu sérine. Parmi les EXTL, seule la protéine EXTL2 semble impliquée dans la biosynthèse des héparanes sulfates. Grâce à son activité (α1,4N acétylglucosaminyltransférase elle transfère le premier résidu GlcNAc au tétrasaccharide de pontage de la core protein [4]. La protéine EXTL2 intervient donc en amont des protéines EXT 1 et EXT2 (Figure 1). Lorsque les protéines sont surexprimées séparément, elles sont localisées préférentiellement au niveau du réticulum endoplasmique. Pour assurer leur fonction polymérasique les deux protéines doivent former un complexe (hétéro-oligomère) qui se localise au niveau de l’appareil de Golgi, lieu de synthèse des héparanes sulfates [5]. Certains arguments supplémentaires suggèrent que les exostosines, pour être fonctionnelles, doivent appartenir à un complexe multienzymatique HS-polymérase comportant au moins une protéine chaperone et une autre glycosyltransférase. La position exacte des domaines catalytiques des deux exostosines n’a pas encore été déterminée de façon précise mais l’étude récente de cellules CHO (Chinese hamster ovarian) mutantes a permis de localiser l’activité GlcA-T au niveau de la partie centrale de la protéine codée par EXT1 [6].
| Figure 1. Enzymes et substrats impliqués dans la biosynthèse des Héparanes Sulfates (HS). L’unité’ tétrasacchari-dique de pontage est commune aux héparanes sulfates et aux chondroitines sulfates. Elle se forme par addition séquentielle de xylose (Xyl), de galactose (Gal) et d’acide glucuronique (GlcA) et fait intervenir une xylose trans-férase (Xyl-T), deux galactosyltransférases (Gal-T1 et Gal-T2) et une glucuronyltransférase (GlcA-T). L’addition du résidu de N-acétylglucosamine (GlcNAc) qui sépare le tétrasaccharide de pontage de l’unité disaccharidique répétée est assurée par une N-acétylglucosaminyltransférase codée par EXTL2. Les gènes EXTl etEXT2 codent pour deux copolymérases ayant à la fois une activité N-acétylglucosaminyltransférase et glucuronyltransférase, formant au niveau du Golgi un complexe HS-polymérase (HS-pol) qui assure l’élongation des chaînes d’héparanes sulfates. Les substrats des différents enzymes sont des monosaccharides liés de façon covalente à l’uridine diphosphate (UDP). |
Des mutations ponctuelles non sens et faux sens affectant l’un ou l’autre des deux gènes EXT ont été détectées chez plus de 80 % des patients atteints de maladie exostosante [7]. La plupart des mutations ayant pour conséquence la production de protéines tronquées, il en a été conclu qu’une haploinsuffisance d’un des gènes EXT était responsable de la formation des exostoses. Cependant, de façon inattendue, les souris invalidées pour le gène Extl sur un seul des deux allèles (Extl+/-) n’ont développé aucune exostose alors que les embryons homozygotes pour l’invalidation (Extl−/−) montraient une létalité précoce à 6,5 jours de gestation [8]. Bien que les mutations de EXT1 et EXT2 chez l’humain semblent engendrer la formation d’exostoses histologiquement indiscernables, nous avons observé dans une étude récente portant sur 42 familles que les mutations de EXT1 étaient associées aux formes les plus sévères de la maladie exostosante et que seules es exostoses résultant de mutations dans EXT1 avaient la capacité de dégénérer en chondrosar-come [7]. Ces résultats démontrent une vraie corrélation entre la maladie et le gène muté et confirment les résultats biochimiques obtenus in vitro indiquant que les deux exostosines ne sont pas capables de se remplacer et que l’exostosine 1 semble jouer un rôle majeur dans la biosynthèse des héparanes sulfates. Parallèlement aux travaux in vitro sur la lignée Sog9, des études in vivo chez un mutant de drosophile appelé toutvelu ont apporté de nouveaux éléments quant au rôle des gènes EXT. Le gène tout-velu (ttv), homologue de EXT1, code pour une protéine à domaine transmembranaire de type II impliquée dans la biosynthèse des héparanes sulfates et semble contrôler la diffusion de la protéine Hedgehog (Hh) [9]. Chez es vertébrés, Indian Hedgehog (Ihh), un des trois membres de la famille Hh, est exprimé dans la plaque de croissance du cartilage dans es chondrocytes préhy-pertrophiques et hypertrophiques où il contrôle la taille de la zone proliférative par un mécanisme impliquant le para-thyroid hormone related peptide (PTHrP) et son récepteur (PTH/PTHrPR), lui-même exprimé à la frontière des zones hypertrophique et proliférative [10,11]. L’induction de la synthèse de PTHrP par Ihh requiert une diffusion efficace de ce dernier jusqu’aux cellules cibles par un mécanisme qui implique les héparanes sulfates. Sachant que l’invalidation hétérozygote de Extl affecte la fixation de Ihh au niveau de la surface cellulaire [8], l’hypothèse a été émise qu’un défaut de synthèse des héparanes sulfates présents à la surface des chondro-cytes, suite à une mutation d’un des gènes EXT, empêchait la prolifération des chondrocytes et provoquait une différenciation prématurée de ces cellules. Ce modèle est conforté par nos observations d’une expression ectopique de col-agène de type X (spécifique des chon-niveau de certaines cellules de la zone proliférative suggérant que certains chondrocytes formant la partie cartilagineuse des exostoses se différencient de façon prématurée [12]. Cependant, la nature des cellules impliquées dans es stades les plus précoces de la formation des exostoses reste controversée. Alors que certains auteurs considèrent que les exostoses résultent d’une expansion clonale de chondrocytes porteurs d’une mutation somatique d’un des gènes EXT ou EXTL venant s’ajouter à la mutation germinale déjà présente [13], nous favorisons de notre coté l’hypothèse selon laquelle l’exostose dériverait de cellules mésenchymateuses qui prolifèreraient activement pour se différencier rapidement en chondrocytes hypertro-phiques, puis en ostéoblastes, par un mécanisme de transdifférenciation. L’obtention de souris invalidées de façon tissu-spécifique pour l’un des gènes EXT devrait faciliter notre compréhension de la genèse des exostoses et de leur possible dégénérescence en tumeurs osseuses malignes.