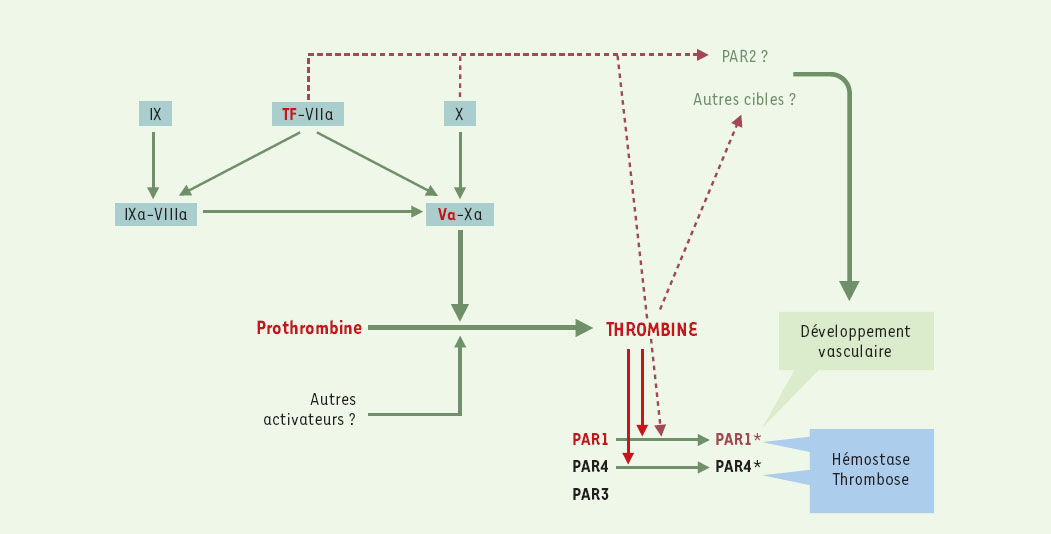
La thrombine est le produit d’une cascade finement réglée d’activation de zymogènes déclenchée par la rencontre des facteurs plasmatiques de la coaguation et du facteur tissulaire exposé auniveau d’une lésion vasculaire. La thrombine clive le fibrinogène soluble en monomères qui forment par polymérisation le réseau de fibrine insoluble. Ce processus associé à l’activation de plaquettes au contact de la matrice sous-endothéliale aboutit à la formation du caillot assurant l’hémostase. La production inappropriée de thrombine et /ou l’activation intempestive des plaquettes sont le fondement des événements thrombo-emboliques. La régulation de l’activité de la thrombine et de sa formation est donc cruciale. La thrombine a la capacité de contrôler positivement et négativement sa propre formation en activant d’une part les cofacteurs V et VIII et d’autre part la protéine C, ellemême responsable de l’inactivation de ces cofacteurs. Parmi les enzymes de la coagulation, la thrombine se caractérise par une activité cellulaire importante. En effet, elle est un puissant activateur des plaquettes et de multiples études ont montré qu’elle induit des signaux dans la plupart des cellules étudiées in vitro.
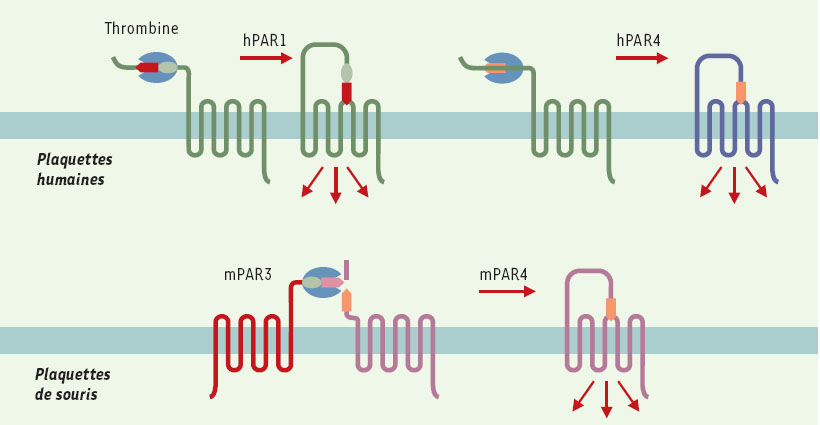
Après un quart de siècle de recherches infructueuses, un récepteur de la thrombine a été simultanément identifié et son gène cloné par différents groupes [1, 2]. Ce récepteur appartient à la superfamille des récepteurs à sept domaines transmembranaires couplés aux protéines G mais possède un mécanisme d’action particulier. La thrombine se lie au récepteur par un site spécifique et le clive, démasquant une nouvelle extrémité N-terminale qui agit comme peptide ago-niste interne (Figure 1). Du fait de son clivage, ce récepteur appelé PAR1 (protease activated recep-tor-1) est à usage unique. PAR1 est le premier d’une famille de quatre comportant PAR3 et PAR4 également récepteurs de la thrombine [3], PAR2 n’étant en revanche pas activé par la thrombine. La distribution tissulaire et cellulaire large de PAR1 rend compte des effets multiples de la thrombine observés in vitro.
| Figure 1. Les PAR des plaquettes humaines et de souris. Les plaquettes humaines expriment PAR1 et PAR4 qui peuvent être indépendamment activés par la thrombine (en bleu). La liaison de la thrombine à PAR1 au niveau d’un site complémentaire permet le clivage du site peptidique cible, la nouvelle extrémité N-terminale démasquée agissant en tant que peptide agoniste interne. PAR4 ne possédant pas de site complémentaire de liaison de la thrombine, n’est activé qu’à forte concentration d’enzyme. Les plaquettes de souris expriment PAR3 et PAR4. PAR3 est incapable d’induire des signaux par lui-même, mais présente un site de liaison de la thrombine et agit comme cofacteur du clivage et de l’activation de PAR4. |
Cependant, in vivo, le rôle de la thrombine au niveau cellulaire n’est pas clair mais l’obtention de souris déficientes en protéines impliquées dans la formation de la thrombine ou de son récepteur apporte de nouveaux éléments.
L’invalidation du gène de PAR1 [4] a révélé deux notions importantes : d’une part, l’activation des plaquettes par la thrombine implique d’autres récepteurs que PAR1, et d’autre part le rôle physiologique de la thrombine et de l’activation de son récepteur dépasse le strict cadre de l’hémostase, puisqu’il contribue au développement embryonnaire. Shaun Coughlin et son groupe ont très largement contribué à l’identification des récepteurs de la thrombine et eurs deux derniers articles [5, 6] vont plus loin dans la description de leur rôle tant au plan de l’hémostase que de l’embryogenèse.