Chez l’homme, les encéphalopathies spongiformes subaiguës transmissibles (ESST), ou maladies à prions, forment un groupe d’affections neurodégénératives comprenant la maladie de Creutzfeldt Jakob (CJD), le kuru, le syndrome de Gerstmann-Sträussler-Scheinker (GSS) et l’insomnie familiale fatale (pour revue, voir [ 1]). Les prions sont constitués principalement, voire exclusivement, d’une protéine nommée PrPSc. Cette protéine correspond à la forme altérée et pathogène d’une protéine normale, la PrPC, et est principalement détectée dans le cerveau de personnes atteintes d’ESST. Elle possède une conformation différente de la PrPC et peut être mise en évidence grâce à ses propriétés biochimiques particulières : insolubilité dans les détergents et résistance aux protéases.
| Figure 1.
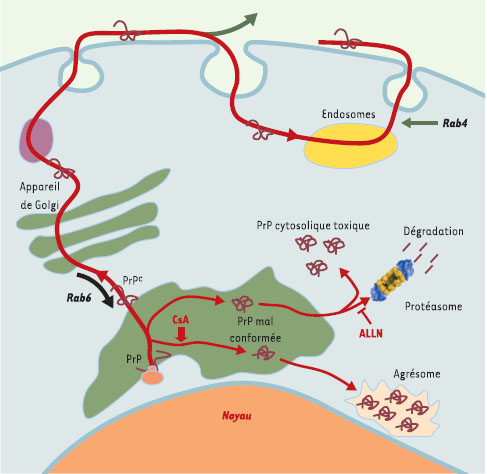
Trafic intracellulaire de la protéine du prion (PrP). La très grande majorité (90 %) des molécules de PrPC nouvellement synthétisées et correctement repliées au niveau du RE sont transportées vers la membrane plasmique, où elles sont impliquées dans un cycle d’endocytose et de recyclage à la membrane. Au cours de ce cycle, la protéine du prion peut être soumise à un transport rétrograde vers le RE, et ce compartiment jouerait un rôle dans sa conversion en PrPSc. Les protéines qui ne sont pas correctement repliées sont ciblées vers le protéasome puis dégradées. Lorsque la fonction du protéasome est inhibée, on observe l’accumulation de molécules de PrP cytosoliques, neurotoxiques, possédant certaines des caractéristiques biochimiques de la PrPSc. En inhibant les cyclophylines, la ciclosporine A (CsA) induit la formation de PrP mal repliées qui ne sont pas reconnues par le protéasome et s’accumulent au niveau de structures péricentriolaires, les agrésomes. |
La PrPC est une glycoprotéine ubiquitaire exprimée plus particulièrement dans les neurones du système nerveux central. Au cours de sa biosynthèse, la PrPC est modifiée de façon post-traductionnelle avant d’être ciblée vers la membrane plasmique, où elle est impliquée dans un cycle d’endocytose et de recyclage membranaire.
Les compartiments cellulaires où s’effectue la conversion de la PrPC en PrPSc sont très mal définis. Afin de comprendre le rôle des différentes étapes des mouvements intracellulaires de la PrPC sur sa conversion en PrPSc, nous avons bloqué certaines de ces étapes en surexprimant certaines protéines Rab, membres de la superfamille des protooncogènes Ras, qui jouent chez les mammifères un rôle important au cours du transport vésiculaire dans les cellules eucaryotes [ 2]. Comme les protéines Ras, les protéines Rab existent dans la cellule dans deux états, une forme inactive liée au GDP et une forme biologiquement active liée au GTP. Afin d’interférer avec les mécanismes de transport intracellulaire de la PrPC dans des lignées de neuroblastome murin infectées par les prions, nous avons choisi d’utiliser d’une part la protéine Rab4, qui agit dans les processus de recyclage des récepteurs endocytés, et d’autre part la protéine Rab6, qui stimule le transport rétrograde, de l’appareil de Golgi vers le réticulum endoplasmique (RE) [ 3].
Nos résultats suggèrent que la conversion de la PrPC en PrPSc s’effectue dans un compartiment intracellulaire, puisque le fait de bloquer le recyclage vers la membrane plasmique avec un mutant Rab4-GDP augmente la proportion de protéines converties. Par ailleurs, nous avons pu montrer que la stimulation du transport rétrograde vers le RE par des mutants Rab6 s’accompagne d’une accumulation de PrPSc, ce qui suggère fortement que la conversion a lieu au niveau de ce compartiment. Dans le RE, la PrPC se trouverait en contact avec des PrP mal conformées qui provoqueraient sa conversion en protéine pathogène. Des molécules de PrPSc s’accumuleraient ainsi dans cet organite impliqué dans le repliement des protéines en cours de synthèse.
Des études récentes ont montré que 10 % des molécules de PrPC sauvage synthétisées sont en permanence éliminées lors du «contrôle-qualité» du RE, c’està- dire exportées dans le cytoplasme, déglycosylées, ubiquitinylées et dégradées par le système du protéasome [ 4, 5]. Si l’on traite des cellules (neuroblastomes N2a ou des cellules d’ovaires de hamster CHO) surexprimant la PrPc murine par des inhibiteurs spécifiques du protéasome, on observe une accumulation cytoplasmique de molécules de PrPc possédant certaines des propriétés biochimiques de la PrPSc. Susan Lindquist démontre que, comme dans les modèles infectieux, ces PrPC cytosoliques anormales semblent convertir d’autres molécules de PrPC de façon autocatalytique, conduisant à une accumulation dans le cytosol de formes mal repliées de protéines du prion [ 6], responsables de la mort des cellules neuronales par apoptose [ 7]. Cette toxicité a été confirmée dans différents modèles. Ainsi, des souris transgéniques exprimant une PrPC mutée cytosolique présentent rapidement des signes cliniques similaires à ceux qui caractérisent les patients atteints de maladie à prions, avec une neurodégénérescence cérébrale. Néanmoins, à la différence des ESST, aucune forme de PrPSc n’a pu être mise en évidence chez ces souris, suggérant que la PrPSc ne serait pas directement impliquée dans la mort neuronale. En revanche, ces données supposent que certaines formes de PrPC endogène deviendraient neurotoxiques lorsque les capacités fonctionnelles du protéasome sont défectueuses.
Des travaux récents approfondissent davantage les mécanismes de contrôle de la PrP au niveau du RE [ 8]. Dans cette étude, les auteurs se sont intéressés au rôle d’une famille de chaperons moléculaires, les cyclophilines (ou peptidylprolyl isomérases), dans le repliement de la protéine du prion. Les cyclophilines catalysent l’isomérisation des liaisons X-Pro, et peuvent être inhibées par la ciclosporine. Dans le cytoplasme de cellules traitées par la ciclosporine, la PrP s’accumule sous forme d’une protéine insoluble dans les détergents et résistante à la protéolyse, comme avec les inhibiteurs du protéasome. Ces formes de PrP cytoplasmiques échappent à la dégradation par le protéasome et s’accumulent sous forme d’agrégats périnucléaires, les agrésomes. Ces derniers ont été définis comme des inclusions cytoplasmiques péricentriolaires constituées de protéines mal conformées et ubiquitinylées, enchevêtrées dans un réseau de vimentine et de filaments intermédiaires. Ces structures ont été identifiées dans certains cas d’accumulation de protéines CFTR (cystic fibrosis transmembrane conductance regulator) ou PS1 (préséniline 1) mutées, impliquées respectivement dans la mucoviscidose et la maladie d’Alzhei- mer, et ont par la suite été intimement liées à l’apparition de nombreuses maladies neurodégénératives ou liées au vieillissement. Dans le cas des ESST, on retrouve certaines PrP porteuses de mutations responsables de GSS dans des agrésomes. Les travaux récents de l’équipe du A. Taraboulos démontrent pour la première fois qu’une protéine sauvage peut également s’accumuler au niveau des agrésomes dans le cas d’une défaillance des cyclophilines.
En conclusion, ces données démontrent clairement que le système de «contrôle qualité» du RE et le protéasome constituent des éléments clés dont le dysfonctionnement, lié à l’âge ou au stress, pourrait expliquer l’apparition de formes sporadiques de CJD. Par ailleurs, comme le note ces auteurs [8], des traitements fondés sur l’utilisation d’inhibiteurs du protéasome, envisagés dans la thérapie de certains cancers, ou utilisant la ciclosporine, un immunosuppresseur d’utilisation très répandue, présentent des risques potentiels. En effet, ces composés pourraient induire la formation de PrP cytoplasmique toxique responsable de troubles neurologiques. De plus, ils devraient être utilisés avec précaution chez les personnes susceptibles de développer une ESST, telles que les personne âgées ou les patients porteurs de mutations dans le gène de la protéine du prion.