L’hypothalamus, qui est la cible de facteurs circulants capables d’informer le cerveau de l’état des réserves et des besoins énergétiques de l’organisme, joue un rôle clé dans la régulation de la prise alimentaire [ 1, 2]. Les hormones impliquées dans cette signalisation peuvent agir à long terme, comme la leptine et l’insuline dont les concentrations plasmatiques sont corrélées à la masse de tissu adipeux [ 3, 4], ou à court terme, comme la ghréline, un peptide sécrété par les cellules endocrines de la paroi gastrique et qui stimule la prise alimentaire [ 5]. Dans un article paru récemment dans la revue Nature, l’équipe de Bloom montre que l’hypothalamus est la cible d’un autre peptide circulant, le peptide YY3- 36 (PYY3-36), une hormone de la famille du neuropeptide Y (NPY) qui est sécrétée pendant la période post-prandiale par les cellules endocrines tapissant l’intestin grêle et le côlon (→) [ 6]. La concentration plasmatique en PYY3-36 est proportionnelle à la quantité de calories ingérées et reste élevée durant plusieurs heures après la fin du repas. Le PYY3-36 induit une sensation de satiété pendant une période de 12 heures. La durée d’action du PYY3-36 est donc plus longue que celle des peptides agissant de façon immédiate sur la prise individuelle des repas comme la ghréline et la cholécystokinine. Dans cet article, les auteurs montrent également que, à l’instar de la leptine, de l’insuline et de la ghréline, le site d’action du PYY3-36 est le noyau arqué de l’hypothalamus. Ces travaux ont le mérite de clarifier les mécanismes impliqués dans l’intégration des signaux hormonaux au niveau du noyau arqué et dans la transmission des informations nécessaires aux réponses comportementales et métaboliques permettant de maintenir l’équilibre énergétique.
(→) m/s 1998, n° 2, p. 223 et 1999, n° 2, p. 283
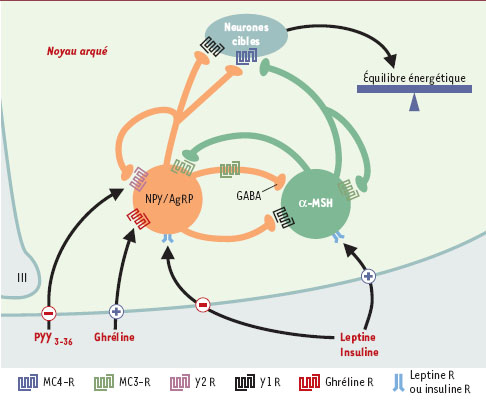
Le noyau arqué, situé dans la région médiobasale de l’hypothalamus, contient deux populations distinctes de neurones peptidergiques qui exercent des effets opposés sur le contrôle de la prise alimentaire et du poids corporel [ 7]. Le premier groupe de neurones, localisés dans la partie ventromédiane du noyau, synthétisent le NPY et l’agouti-related protein (AgRP), deux neuropeptides qui, contrairement au PYY3-36, stimulent l’appétit et diminuent la dépense énergétique. Un tiers de ces neurones produit également un autre facteur orexigène, le GABA. Le second groupe de neurones, situés dans les régions latérales du noyau, expriment la pro-opiomélanocortine (POMC) et sécrètent l’α- melanocyte-stimulating hormone (α- MSH), neuropeptide qui inhibe la prise de nourriture et augmente le catabolisme. La plupart des neurones à POMC expriment le neuropeptide cocaine-amphetamineregulated transcript (CART) qui exerce un effet anorexigène. Les neurones appartenant à chacun de ces groupes se projettent entre autres vers le noyau paraventriculaire et l’aire latérale de l’hypothalamus, lesquels contiennent d’autres réseaux neuropeptidergiques anorexigènes (CRH [corticotropin-releasing hormone], TRH [thyrotropin-releasing hormone]) et orexigènes, MCH [melaninconcentrating hormone], orexines). Les deux groupes de neurones projettent aussi leurs axones au sein même du noyau arqué, ce qui sous-tend des interactions étroites entre les deux systèmes neuropeptidergiques et laisse envisager l’existence de mécanismes de rétrocontrôle. D’une façon générale, lorsque l’un des groupes de neurones est stimulé, l’autre est freiné. Ainsi, à la suite d’un jeûne prolongé, les neurones à NPY sont activés tandis que les neurones à POMC sont inhibés, aboutissant à une stimulation de l’appétit et une récupération des réserves énergétiques. Les neurones NPYergiques du noyau arqué expriment également l’AgRP qui agit comme un antagoniste naturel des récepteurs centraux MC3-R et MC4-R des mélanocortines. L’activation des neurones à NPY/AgRP peut donc stimuler la prise alimentaire par deux voies différentes: en augmentant les taux de NPY orexigène et en bloquant, par l’intermédiaire de l’AgRP, l’effet anorexigène de l’α-MSH.
À partir des informations actuellement disponibles sur le mode d’action de la leptine au niveau du noyau arqué [ 8], Batterham et al. [6] ont pu élucider les mécanismes centraux impliqués dans l’effet satiétogène du PYY3-36. Les neurones à NPY/AgRP et à POMC du noyau arqué expriment les récepteurs de la leptine et leur activité est contrôlée de façon opposée par la leptine. Les travaux récents du groupe de Cowley [ 9] permettent de proposer un modèle de régulation des neurones à POMC et à NPY du noyau arqué par la leptine, qui prend en compte les interactions entre les deux populations de neurones ainsi que les phénomènes d’autorégulation s’exerçant sur les deux systèmes (Figure 1). La leptine dépolarise directement les neurones à POMC en activant des canaux cationiques non sélectifs, stimulant ainsi la libération d’α-MSH. Parallèlement, la leptine hyperpolarise les neurones à NPY/AgRP et diminue la production des deux peptides orexigènes. De ce fait, la leptine freine le contrôle négatif du NPY sur les neurones à POMC (→) [ 10], probablement via l’acti vation du récepteur Y1. De même, la leptine diminue l’activité antagoniste de l’AgRP au niveau des récepteurs postsynaptiques MC4-R. La leptine hyperpolarise également les neurones co-exprimant le NPY et le GABA, provoquant ainsi une levée du tonus inhibiteur GABAergique qui s’exerce normalement sur les neurones à POMC [10]. Ces effets directs et indirects de la leptine aboutissent à l’activation des neurones à POMC. Par ailleurs, les neurones à POMC et NPY/AgRP expriment le récepteur MC3-R des mélanocortines [ 11, 12]; l’α-MSH libérée peut donc à la fois contrôler la libération de NPY et d’AgRP et en même temps exercer un rétro-contrôle sur sa propre production. Les neurones à NPY/AgRP expriment aussi les récepteurs pré-synaptiques Y2 du NPY (Y2 R); or, les agonistes Y2 sont capables de freiner la libération de NPY. Ces dernières observations, associées au fait que le PYY3-36 est un agoniste sélectif des récepteurs Y2, ont conduit Batterham et al. à émettre l’hypothèse selon laquelle le PYY3-36 pourrait diminuer la prise alimentaire en activant des récepteurs Y2 au niveau du noyau arqué [6].
(→) m/s 1998, n° 8-9, p. 955
| Figure 1.
Action du PYY3-36 dans la régulation centrale de la prise alimentaire. Le neuropeptide Y (NPY) et l’agouti-related peptide (AgRP) produits par les neurones du noyau arqué de l’hypothalamus stimulent la prise alimentaire, tandis que l’α-MSH issue du clivage de la POMC l’inhibe. L’activité de ces deux populations neuronales est contrôlée par les hormones circulantes impliquées dans la régulation des comportements alimentaires. La leptine et l’insuline exercent leurs effets anorexigènes en freinant l’activité des neurones à NPY/AgRP et en stimulant les neurones à α-MSH. La ghréline, libérée par l’estomac, stimule l’appétit en contrôlant positivement les neurones à NPY/AgRP. Batterham et al. [6] viennent d’identifier une nouvelle hormone peptidique, le PYY3-36, qui diminue l’appétit pendant 12 heures. Le PYY3-36, qui est libéré par l’intestin en période post-prandiale, inhibe l’activité des neurones à NPY/AgRP en se liant au récepteur présynaptique Y2 (Y2R) du NPY. Les systèmes neuronaux producteurs de NPY/AgRP et d’α-MSH interagissent entre eux. Le NPY et le GABA (synthétisé par un tiers des neurones à NPY/AgRP) exercent un tonus inhibiteur sur les neurones à POMC. L’AgRP, qui agit comme un antagoniste naturel du récepteur des mélanocortines (MC4-R), bloque l’effet anorexigène de l’α-MSH. À l’inverse, l’α-MSH inhibe l’activité des neurones à NPY/AgRP et peut exercer un rétro-contrôle sur sa propre production via l’activation du récepteur MC3-R des mélanocortines. |
De fait, les auteurs montrent que l’administration périphérique d’une dose unique de PYY3-36 diminue l’appétit chez le rat soumis à un régime alimentaire normal, mais aussi chez l’animal maintenu à jeun pendant 24 heures. Cet effet est reproduit après l’injection du peptide directement dans le noyau arqué alors que l’administration dans le noyau paraventriculaire (où se projettent les neurones à POMC et à NPY/AgRP) est sans effet. Une baisse significative du poids corporel est détectée après un traitement chronique d’une semaine. Plusieurs observations laissent penser que l’effet anorexigène du PYY3-36 s’exerce via les neurones à NPY/AgRP et à POMC du noyau arqué. L’inhibition de l’appétit provoquée par une dose aiguë de PYY3-36 est accompagnée d’une augmentation de l’expression du proto-oncogène c-Fos et d’une diminution des taux de transcrits codant pour le NPY dans le noyau arqué. L’action du PYY3-36 sur la consommation de nourriture est mimée par le Y2A, un agoniste du récepteur Y2, alors que le PYY3-36 est sans effet chez la souris dont le gène codant pour le récepteur Y2 a été invalidé. Grâce à une approche électrophysiologique et des études de libération par des explants hypothalamiques, Batterham et al. démontrent que le PYY3- 36 et le Y2A, en se liant aux récepteurs Y2, hyperpolarisent les neurones à NPY/AgRP et inhibent la libération de NPY hypothalamique (Figure 1). Le PYY3-36 et le Y2A freinent également la transmission GABAergique inhibitrice sur les neurones à POMC. De cette manière, le PYY3-36 exerce indirectement une activation des neurones à POMC qui se traduit par une augmentation de la libération d’α-MSH hypothalamique. L’action inhibitrice du PYY3-36 sur l’appétit requiert donc (comme pour la leptine) l’intégrité des voies neuronales du noyau arqué qui synthétisent le NPY et l’α-MSH. Batterham et al. ont enfin étudié l’action du PYY3-36 sur l’appétit et la prise alimentaire chez l’homme. Des jeunes volontaires non obèses ont été perfusés avec le placebo ou le PYY3-36 pendant 90 minutes de façon à reproduire les concentrations plasmatiques du peptide en période post-prandiale. Le traitement n’a eu aucune incidence sur les concentrations plasmatiques de glucose, d’insuline et de leptine. En revanche, la quantité de nourriture ingérée deux heures après la fin de la perfusion a été réduite de 30 % chez les sujets traités avec le PYY3-36. Cette diminution de l’appétit persiste pendant 12 heures alors que les concentrations plasmatiques du PYY3-36 sont revenues aux valeurs basales dans les 30 minutes suivant la fin de la perfusion de peptide.
Les travaux de Batterham et al. apportent des informations importantes pour comprendre comment l’obésité peut se développer et pourrait être traitée. Le fait que le PYY3-36 soit capable de moduler les voies hypothalamiques impliquées dans l’homéostasie énergétique et d’inhiber l’appétit chez l’animal et chez l’homme permet d’envisager de nouvelles approches thérapeutiques pour lutter contre l’obésité.