| |
| Med Sci (Paris). 2003 April; 19(4): 459–464. Published online 2003 April 15. doi: 10.1051/medsci/2003194459.Quand la mère est plus que responsable du devenir de sa progéniture : les mutations à effet maternel Elisabeth S. Christians* Department of Internal Medicine, Molecular Cardiology Research Laboratories, the University of Texas Southwestern Medical Center, 6000 Harry Hines Blvd, Dallas, TX 75390-8573, États-Unis |
La création de tout nouvel organisme par reproduction sexuée implique la fécondation d’un ovocyte par un spermatozoïde. Ces deux gamètes haploïdes apportent un nombre identique de chromosomes à une chromatide, reconstituant ainsi une cellule diploïde, le zygote. Mis à part cette contribution quantitative identique, ovocyte et spermatozoïde sont extrêmement dissemblables par leur taille, leur composition et leur activité. L’ovocyte est une cellule volumineuse dont le cytoplasme contient de grandes quantités de transcrits et de protéines, appelés de façon générale, facteurs maternels [
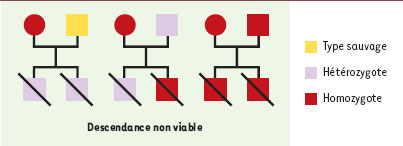
1]. Bien que ces facteurs maternels soient encore mal définis, il est clair qu’ils peuvent jouer un rôle essentiel dans le développement embryonnaire (→). C’est précisément ce qu’ont révélé les mutations dites à effet maternel. Ces mutations modifient la composition de l’ovocyte en facteurs maternels et affectent le devenir des embryons issus de la fécondation de tels ovocytes (Tableau I). On voit donc comment la mère contribue non seulement au génotype de sa progéniture mais également à son phénotype par le biais de ces facteurs maternels. Afin de pouvoir identifier ce type de mutations lorsqu’elles apparaissent, il faut tenir compte du fait qu’il n’y a pas de relation directe entre le génotype et le phénotype de l’embryon mais que c’est en réalité le génotype de la mère qui est déterminant (Figure 1). 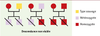 | Figure 1.
Définition et schéma décrivant la notion de mutations à effet maternel. Le schéma présente une mutation à effet maternel récessive. Lorsqu’une femelle (cercle) homozygote mutante est accouplée avec un mâle (carré) de type sauvage, hétérozygote ou homozygote mutant, les embryons produits sont soit hétérozygotes, soit homozygotes, mais leur phénotype est létal quel que soit leur génotype. Dans leur forme la plus simple, de telles mutations à effet maternel permettraient aux femelles ( D. melanogaster) homozygotes (mutantes) de survivre, mais provoqueraient chez elles la production d’une progéniture anormale parce que des facteurs maternels vitaux n’auraient pas été déposés dans l’œuf [
3]. |
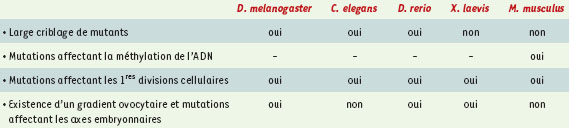
 | Tableau I.
Mutations à effet maternel chez les invertébrés et chez les vertébrés.
|
(→) m/s 1999, n° 2, p. 148
|
Alfred Sturtevant, plus connu comme généticien de la drosophile, fut l’un des premiers à émettre l’hypothèse de l’existence de caractères à effet maternel [
2]. Il réexaminait alors les données publiées par d’autres auteurs au sujet du déterminisme génétique de l’enroulement à gauche ou à droite de la coquille de la limnée. L’hypothèse de travail de A. Sturtevant suggérait que l’enroulement à droite était un caractère dominant établi par la constitution génétique de l’œuf et non de l’embryon lui-même. Des travaux ultérieurs démontrèrent la justesse de son hypothèse. Dans le cas de la limnée, l’effet maternel concernait un gène présentant deux allèles. De façon plus générale, n’importe quel gène maternel contrôlant un caractère phénotypique de l’embryon peut être porteur de mutations dite à effet maternel. |
Diversité et effet dramatique des mutations à effet maternel chez les non mammifères Mis en évidence chez l’escargot, l’existence de caractères à effet maternel a été largement démontrée par l’observation de mutants chez la drosophile [3]. Un point important du développement dans cette espèce est l’organisation en gradient des facteurs maternels dans l’ovocyte. Cette organisation implique de nombreux gènes qui déterminent la mise en place des axes antéro-postérieur et dorso-ventral ainsi que la différenciation de certaines populations cellulaires comme les cellules germinales. Toute perturbation de ces gènes modifie gravement le phénotype de l’embryon qui peut, par exemple, présenter deux têtes ou une absence de dos [
4]. Des mutations à effet maternel plus discrètes se traduisent par l’apparente stérilité des femelles dont les embryons meurent au tout début de leur développement [3]. Durant les vingt dernières années, un travail de criblage très étendu a permis de sélectionner des locus d’intérêt, d’identifier les mécanismes atteints et, enfin, de déterminer de plus en plus efficacement les gènes impliqués et leur rôle. Sont maintenant connus des facteurs d’origine maternelle spécifiquement nécessaires pour le contrôle d’événements tels que la formation du pro-noyau mâle, la migration du pro-noyau femelle et l’intégration du génome paternel dans le génome embryonnaire (cas du gène Sésame) [
5]. Même si l’organisation de l’embryon apparaît plus simple chez le nématode, C. elegans, celle-ci dépend aussi de gènes à effet maternel. Parmi les centaines de mutations Mel (maternal effect embryonic lethal) identifiées lors de criblages intensifs, 32 s’accompagnent d’un arrêt du développement avant même la première division cellulaire [
6]. Enfin, des mutations à effet maternel ont été également décrites chez les vertébrés inférieurs tels que le poisson zèbre, le xénope ou le pleurodèle [
7]. Des criblages génétiques réalisés chez le poisson zèbre permettront l’identification de gènes impliqués dans ces mutations. C’est déjà le cas pour le gène nebel dont la mutation empêche la formation du sillon de division cellulaire [
8]. Chez le xénope, au contraire, de telles panoplies de mutants ne sont pas disponibles; il existe toutefois quelques exemples de mutations à effet maternel naturelles telles que af qui affecte le sillon de division cellulaire et pourrait donc être comparée à la mutation nebel du poisson zèbre [
9]. Malgré ce manque d’outils génétiques, le concept d’effet maternel est bien présent dans l’étude du développement du xénope, car les conséquences d’un déficit sévère en un facteur maternel donné peuvent être testées en injectant des séquences antisens dans l’embryon. Un groupe d’Edimbourg (Écosse) a ainsi démontré que l’ADN-méthyltransférase d’origine maternelle était nécessaire pour maintenir silencieux le génome zygotique et permettre ainsi les divisions cellulaires rapides qui caractérisent l’embryon de xénope [
10]. |
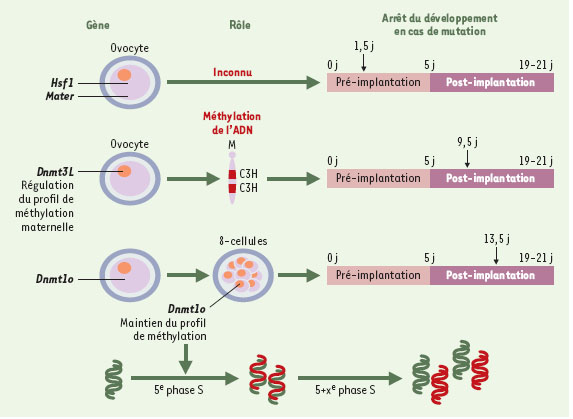
Exemples plus rares et plus récents chez les mammifères Ainsi que nous l’avons vu, c’est principalement à partir de criblages de mutations induites au hasard dans le génome qu’un grand nombre de mutations à effet maternel a été découvert chez les organismes inférieurs. À l’inverse de cette recherche allant du phénotype au génotype, un grand nombre de mutations par recombinaison homologue ont été réalisées chez la souris, visant à déterminer le phénotype associé à la perte de fonction du gène ciblé. C’est au cours d’expériences semblables qu’ont été observées, chez la souris, les premières mutations à effet maternel (Dnmt1o et Dnmt3L, Hsf1, Mater) (Figure 2).  | Figure 2.
Caractérisation des mutations à effet maternel identifiées chez la souris. Le rôle des gènes Hsf1 et Mater dans l’ovocyte n’est pas encore connu, mais leurs mutations par recombinaison homologue ou invalidation entraînent l’arrêt du développement embryonnaire au stade 2 cellules. Les gènes Dnmt1o et Dnmt3L sont impliqués dans le maintien et la régulation de la méthylation dont la perturbation se traduit par un effet délétère plus tardif durant la période post-implantatoire. Dnmt3L règle le profil spécifique de méthylation maternelle qui est apposé durant l’ovogenèse; en l’absence de Dnmt3L, des gènes à empreinte maternelle ne sont plus maintenus silencieux. Dnmt1o sert à conserver le profil de méthylation durant la 5e phase S du développement. En cas de déficience en Dnmt1o, le profil de méthylation n’est pas copié au niveau du brin néosynthétisé (brin en rouge), ce qui entraîne l’apparition, dans les cycles cellulaires ultérieurs, de deux populations de cellules, l’une dont l’ADN est correctement méthylé, et l’autre dont le profil de méthylation est anormal. Le nombre de jours, au-delà duquel le développement des embryons produits par les femelles mutantes s’arrête, est indiqué par des flèches noires. |
Nous avons déjà mentionné, chez le xénope, que la méthylation de l’ADN sous le contrôle de facteurs maternels est un mécanisme important du développement embryonnaire. C’est également le cas chez les mammifères. Toutefois, le rôle joué par la méthylation est différent: celle-ci est notamment impliquée dans le déterminisme de l’empreinte génomique qui règle certains gènes (par exemple: IgfII, H19), privilégiant l’expression d’un allèle en fonction de son origine parentale [
11] (→). Durant la gamétogenèse, l’empreinte dérivant des parents est gommée pour être remplacée par l’empreinte de l’individu, futur mère ou père. Cela implique qu’au niveau des gamètes, s’établit un nouveau profil de méthylation qui devra ensuite être maintenu après que ces gamètes ont participé à la formation d’un nouvel organisme. Des progrès sont faits dans l’identification des méthyltransférases et des facteurs régulateurs impliqués dans ces différentes étapes de méthylation et de déméthylation. Cela a mené à une meilleure compréhension du rôle joué notamment par deux gènes à effet maternel, Dnmt1, et le gène apparenté, Dnmt3L [
12,
13]. Le gène Dnmt1 a la particularité de s’exprimer, dans l’ovocyte et dans l’embryon avant implantation, à partir d’un promoteur spécifique (Dnmt1o). La délétion de ce promoteur spécifique a permis de créer des souris qui n’expriment pas Dnmt1 durant l’ovogenèse et la période préimplantatoire du développement. Les femelles homozygotes pour cette délétion donnent naissance à des embryons dont le développement s’arrête avant le dernier tiers de la gestation. Bien que Dnmt1o soit la forme exprimée spécifiquement durant l’ovogenèse, la mutation de Dnmt1o ne perturbe pas le profil de méthylation de l’ovocyte. En revanche, l’analyse des embryons produits par les femelles déficientes en Dnmt1 ovocytaire montre que Dnmt1 est essentiel pour maintenir le profil de méthylation durant la 5e phase S, ce qui par ailleurs, correspond de manière convaincante à la localisation nucléaire de Dnmt1 durant cette phase particulière de réplication. Malheureusement, peu d’informations sont données sur les anomalies présentées par ces embryons dont la méthylation est défectueuse [12]. À la différence de Dnmt1o, Dnmt3L n’a pas la structure d’une réelle méthyltransférase mais serait plutôt un régulateur de la méthylation. En l’absence de Dnmt3L, le profil de méthylation spécifique qui caractérise l’établissement de l’empreinte génomique maternelle est significativement perturbé sans que cela ait des répercussions visibles au niveau de l’ovogenèse (→→). Toutefois, les embryons issus des femelles Dnmt3L−/−
présentent une expression bi-allélique des gènes normalement porteurs d’une empreinte maternelle. Ces embryons développent des malformations sévères affectant le système nerveux et les annexes extraembryonnaires qui entraînent la mort 9,5 jours après la date de fécondation. Outre son effet maternel, la mutation de Dnmt3L interrompt complètement la production de spermatozoïdes dans les tubes séminifères qui ne contiennent plus que des cellules de Sertoli. Cela semble indiquer que la gamétogenèse mâle, à l’inverse de l’ovogenèse, ne peut s’effectuer en l’absence du produit de ce gène [13]. (→) m/s 2000, n° 3, p. 336
(→→) m/s 2003, n° 1, p. 15
Contrairement à Dnmt1o et à Dnmt3L, le facteur de choc thermique (heat shock factor, HSF1), qui fait l’objet des recherches menées dans notre laboratoire, n’était pas un candidat attendu dans le groupe des gènes porteurs de mutations à effet maternel. Ce gène s’exprime en effet largement en dehors de l’ovocyte. Le rôle connu d’HSF1 est de contrôler l’expression inductible des gènes Hsp (heat shock protein) qui codent pour les protéines de choc thermique. En cas de stress cellulaire, ces protéines jouent un rôle de chaperons protégeant la conformation adéquate d’autres polypeptides auxquels elles s’associent [
14] (→). Les femelles Hsf1−/−
produisent des ovocytes qui peuvent être fécondés mais les embryons qui en résultent restent pour la plupart bloqués au stade 1 ou 2- cellules et aucun n’atteint le stade blastocyste [
15]. Un problème dans la transcription du génome embryonnaire pourrait expliquer ce type de blocage du développement, qui est notamment observé chez des embryons normaux traités expérimentalement avec des inhibiteurs de la transcription. En fait, chez les embryons produits par les femelles Hsf1−/−
, il ne s’agit pas d’une absence de transcription embryonnaire, mais plutôt d’une activité réduite, conduisant probablement à un déficit qualitatif ou quantitatif en produits embryonnaires nécessaires à la poursuite du développement. Par ailleurs, plusieurs études, ainsi que des travaux de notre laboratoire ont montré que HSF1 peut aussi régler l’expression des gènes Hsp et d’autres gènes en l’absence de stress visible [
16]. En raison de l’implication des gènes Hsp dans de nombreux processus cellulaires (cycle cellulaire, contrôle de la translocation nucléocytoplasmique de protéines, protection contre l’apoptose), il est possible que la mort des embryons produits par les femelles Hsf1−/−
ait une origine multifactorielle incluant notamment un dysfonctionnement nucléaire [15]. (→) m/s 2000, n° 5, p. 630
Publiée presque en même temps que notre étude sur Hsf1, la mutation à effet maternel du gène Mater (maternel antigen that embryos require) semble avoir des effets assez similaires [
17]. Les embryons engendrés par les femelles Mater−/−
ont une activité transcriptionnelle réduite et ne se développent pas au-delà du stade 2 cellules. Le gène Mater a été découvert dans le cadre d’études sur la ménopause précoce d’origine autoimmune (premature ovarian failure). Cette maladie se caractérise par une production anormale d’anticorps dirigés contre certaines protéines ovocytaires qui aboutit à la destruction auto-immune des ovocytes. Des souris thymectomisées, utilisées comme modèle animal de cette maladie, synthétisent massivement des anticorps reconnaissant une protéine de 125 kDa nommée OP1 (ooplasm-specific1). Une fois cloné, le gène correspondant à OP1 a été appelé Mater [
18]. L’analyse de ce gène révèle la présence d’un domaine homologue avec un inhibiteur de ribonucléase, ce qui suggère que le rôle essentiel de Mater pourrait être d’empêcher une dégradation trop précoce des ARN maternels nécessaires au début du développement embryonnaire [18]. La capacité de l’ovocyte de participer au développement embryonnaire dépend de nombreux facteurs qui sont exprimés dans l’ovocyte, non seulement de manière autonome mais aussi apparemment sous le contrôle des cellules de la granulosa. Ainsi, des mutations entraînant un dysfonctionnement de ces cellules ou de leurs interactions avec l’ovocyte pourraient avoir un effet maternel. C’est l’hypothèse formulée par T.L. Rankin et al. dans l’analyse de leurs résultats sur la mutation du gène Zp2, qui empêche la formation de la zone pellucide entourant normalement l’ovocyte [
19]. Ces auteurs montrent que les ovocytes mutants sans zone pellucide peuvent être fécondés, mais qu’ils ne peuvent pas se développer. En revanche, des ovocytes « dépellucidés » expérimentalement avant la fécondation donnent lieu à des embryons viables. L’absence de zone pellucide durant l’ovogenèse perturberait ainsi les échanges entre l’ovocyte et les cellules de la granulosa, rendant l’ovocyte incompétent pour le développement embryonnaire [19]. Chronologiquement antérieure à ces exemples, la description de deux mutations naturelles (DDK, Tme) montre qu’elles se rapprochent de la définition de mutation à effet maternel, tout en s’en distinguant. Comme nous l’avons mentionné plus haut, l’existence d’une mutation à effet maternel est parfois uniquement révélée par une très faible fertilité des femelles dont les embryons meurent précocement. C’est ce type d’observation qui a attiré l’attention de N. Wakasugi et de ses collaborateurs, alors qu’ils étudiaient la souche de souris DDK [
20]: les femelles DDK n’engendrent pas de descendance viable lorsqu’elles sont croisées avec des mâles d’autres souches. Dans ce type de croisement, on voit donc que la survie de l’embryon dépend non seulement du génotype de sa mère, mais aussi de celui de son père. À ce titre, DDK est une mutation à effet maternel conditionnée par le génotype du père. Cela peut s’expliquer par la modification d’un facteur maternel chez DDK qui est devenu incompatible avec les facteurs paternels de souches non DDK [
21]. Un pH anormalement bas, s’accompagnant d’une réduction des communications entre cellules embryonnaires, pourrait être responsable de la mort de ces embryons au stade morula. Concernant le facteur maternel en cause, les travaux réalisés par J.P. Renard et al. ont montré qu’il s’agit d’un ARN présent dans l’ovocyte et qui joue un rôle déterminant entre le stade 1 et 8 cellules [
22] (→). Malgré la complexité génétique qui rend difficile la compréhension complète de ces observations, il semble que les gènes impliqués et les fonctions touchées soient bientôt identifiés. (→) m/s 2002, n° 2, p. 169
La seconde mutation à effet maternel naturel, observée chez la souris, touche le locus T (Tme), au niveau duquel H. Winking et al. ont rapporté dès 1984 l’existence d’une délétion particulière entraînant la mort des foetus recevant cette anomalie de leur mère [
23]. En fait, le locus T contient le gène IgfIIr qui est porteur d’une empreinte paternelle, ce qui signifie que seul l’allèle maternel peut être exprimé [
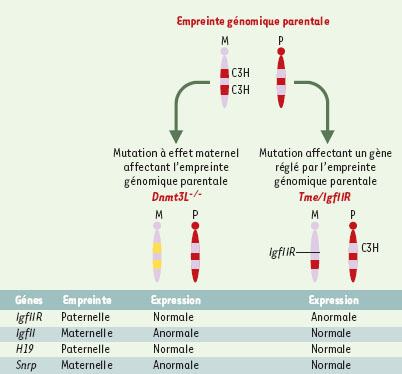
24]. Les embryons recevant l’allèle muté de leur mère ne peuvent donc pas exprimer IgfIIR. Là aussi, on retrouve une nette différence entre ces mutations touchant un locus soumis à l’empreinte génomique et la mutation à effet maternel telle qu’elle est définie plus haut (Figure 1). Les premières n’impliquent pas un facteur maternel présent dans l’œuf, mais un gène transmis par la mère. Les secondes touchent directement les gènes codant pour des produits déposés dans l’ovocyte qui, secondairement, peuvent affecter l’empreinte comme dans le cas de Dnmt3L (Figures 2 et 3).  | Figure 3.
Schéma de mutations affectant des gènes soumis à l’empreinte génomique parentale. L’empreinte se caractérise par un profil de méthylation spécifique dépendant de l’origine parentale de l’allèle. L’invalidation de Dnmt3L est une mutation à effet maternel qui affecte le mécanisme d’établissement de l’empreinte maternelle. Des gènes à empreinte maternelle comme IgfII s’expriment de manière bi-allélique dans les embryons issus des femelles Dnmt3L−/−
. En revanche, Tme est une mutation touchant directement un gène (IgfIIR), qui est par ailleurs soumis à l’empreinte génomique. Seule l’expression d’IgfIIR est directement affectée par la délétion Tme. |
|
Mutation à effet maternel : une réalité pour le concept de compétence ovocytaire Contrairement à la drosophile et au nématode, chez les mammifères, la mise en évidence de gènes porteurs de mutations à effet maternel s’est faite plus récemment. L’importance de ces mutations dépend des schémas et des cinétiques de développement des différentes espèces. Chez les mammifères, le développement est très lent, l’ovocyte n’est pas organisé en territoires et peut apparaître comme moins spécialisé. Dès lors, on peut faire l’hypothèse selon laquelle, chez les mammifères, un nombre plus limité de gènes présenteront des mutations à effet maternel. Cela ne veut pas dire que les facteurs maternels jouent un rôle moindre chez ces espèces. Au contraire, au début du développement, les facteurs maternels contrôlent les fonctions vitales de l’embryon, avant que celui-ci ne les assume grâce à l’expression de son propre génome. C’est la raison pour laquelle un grand nombre de mutations, pouvant toucher les facteurs maternels exprimés dans l’œuf, sont en réalité létales a l’état homozygote. Ces mutations ne laissent donc pas la possibilité d’obtenir des femelles mutantes viables à partir desquelles se révèleraient des mutations à effet maternel. Néanmoins, la découverte des cas décrits dans cet article donne une réalité génétique au concept de compétence ovocytaire souvent utilisé dans le contexte de la production d’embryons in vitro (reproduction assistée, clonage) [
25]. Le rôle de l’ovocyte est de pourvoir au développement de l’embryon. C’est à partir de ce critère que peut se définir la compétence de l’ovocyte à exercer son rôle, et les mutations à effet maternel révèlent les gènes majeurs qui en sont responsables. Il est à remarquer que ces gènes ne présentent pas nécessairement une expression exclusivement ovocytaire (Hsf1), ce qui diminue la valeur des criblages différentiels destinés à les découvrir. En revanche, l’opportunité d’identifier de nouveaux gènes à effet maternel pourrait se trouver dans les vastes collections de mutants obtenues par traitement à l’ENU (Néthyl- N-nitroso-urée), qui sont créées dans différents grands centres en Europe et aux États-Unis. Cela requiert cependant un effort soutenu lorsqu’il s’agit d’identifier des mutations récessives telles que les mutations à effet maternel. En effet, les mâles traités à l’ENU sont utilisés pour produire une première génération d’animaux dont certains seront porteurs de mutations à l’état hétérozygote. Cette première génération doit ensuite être croisée avec ce même mâle, ou entre elle, pour engendrer des individus homozygotes pour la mutation induite. Il faut donc maintenir de très larges colonies d’animaux durant de nombreux mois avant de pouvoir identifier les cas intéressants. De tels schémas de croisement sont actuellement élaborés et il serait dommage de ne pas donner suite à des observations mentionnant des cas d’infertilité femelle qui pourraient révéler l’existence d’autres gènes à effet maternel [
26]. |
1. Richoux-Duranthon V. Information maternelle et développement embryonnaire chez la souris. Med Sci 1991; 7: 1078–82. 2. Sturtevant A. Inheritance of direction of coling in Limnea. Science 1923; 58: 269–70. 3. Schupbach T, Wieschaus E. Female sterile mutations on the second chromosome of Drosophila melanogaster. I. Maternal effect mutations. Genetics 1989; 121: 101–17. 4. Mohier E. Déterminisme de la polarite dorso-ventrale de l’embryon de drosophile. Med Sci 1992; 8: 654–63. 5. Loppin B, Docquier M, Bonneton F, Couble P. The maternal effect mutation sesame affects the formation of the male pronucleus in Drosophila melanogaster. Dev Biol 2000; 222: 392–404. 6. Golden A, Sadler PL, Wallenfang MR, et al. Metaphase to anaphase (mat) transition-defective mutants in Caenorhabditis elegans. J Cell Biol 2000; 151: 1469–82. 7. Humphrey RR. A recessive factor (o, for ova deficient) determining a complex of abnormalities in the Mexican axolotl (Ambystoma mexicanum). Dev Biol 1966; 13: 57–76. 8. Pelegri F, Knaut H, Maischein HM, Schulte- Merker S, Nusslein-Volhard C. A mutation in the zebrafish maternal-effect gene nebel affects furrow formation and vasa RNA localization. Curr Biol 1999; 9: 1431–40. 9. Kubota HY, Itoh K, Asada- Kubota M. Cytological and biochemical analyses of the maternal-effect mutant embryos with abnormal cleavage furrow formation in Xenopus laevis. Dev Biol 1991; 144: 145–51. 10. Stancheva I, Hensey C, Meehan RR. Loss of the maintenance methyltransferase, xDnmt1, induces apoptosis in Xenopus embryos. EMBO J 2001; 20: 1963–73. 11. Paldi J, Jami J. Éléments chromosomiques contrôlant l’empreinte parentale des gènes. Med Sci 1996; 12: 189–91. 12. Howell CY, Bestor TH, Ding F, et al. Genomic imprinting disrupted by a maternal effect mutation in the Dnmt1 gene. Cell 2001; 104: 829–38. 13. Bourc’his D, Xu GL, Lin CS, Bollman B, Bestor TH. Dnmt3L and the establishment of maternal genomic imprints. Science 2001; 294: 2536–9. 14. Pirkkala L, Nykanen P, Sistonen L. Roles of the heat shock transcription factors in regulation of the heat shock response and beyond. FASEB J 2001; 15: 1118–31. 15. Christians E, Davis AA, Thomas SD, Benjamin IJ. Maternal effect of Hsf1 on reproductive success. Nature 2000; 407: 693–4. 16. Yan LJ, Christians ES, Liu L, Xiao X, Sohal RS, Benjamin IJ. Mouse heat shock transcription factor 1 deficiency alters cardiac redox homeostasis and increases mitochondrial oxidative damage. EMBO J 2002; 21: 5164–72. 17. Tong ZB, Gold L, Pfeifer KE, et al. Mater, a maternal effect gene required for early embryonic development in mice. Nat Genet 2000; 26: 267–8. 18. Tong ZB, Nelson LM, Dean J. Mater encodes a maternal protein in mice with a leucine-rich repeat domain homologous to porcine ribonuclease inhibitor. Mamm Genome 2000; 11: 281–7. 19. Rankin TL, O’Brien M, Lee E, Wigglesworth K, Eppig J, Dean J. Defective zonae pellucidae in Zp2-null mice disrupt folliculogenesis, fertility and development. Development 2001; 128: 1119–26. 20. Zhao WD, Ishikawa A, Yamagata T, Bolor H, Wakasugi N. Female mice of DDK strain are fully fertile in the intersubspecific crosses with Mus musculus molossinus and M. m. castaneus. Mamm Genome 2002; 13: 345–51. 21. Pardo-Manuel de Villena F, Naumova AK, Verner AE, Jin WH, Sapienza C. Confirmation of maternal transmission ratio distortion at Om and direct evidence that the maternal and paternal DDK syndrome genes are linked. Mamm Genome 1997; 8: 642–6. 22. Renard JP, Baldacci P, Richoux-Duranthon V, Pournin S, Babinet C. A maternal factor affecting mouse blastocyst formation. Development 1994; 120: 797–802. 23. Winking H, Silver LM. Characterization of a recombinant mouse T haplotype that expresses a dominant lethal maternal effect. Genetics 1984; 108: 1013–20. 24. Wutz A, Theussl HC, Dausman J, Jaenisch R, Barlow DP, Wagner EF. Nonimprinted Igf2r expression decreases growth and rescues the Tme mutation in mice. Development 2001; 128: 1881–7. 25. Duranthon V, Renard JP. The developmental competence of mammalian oocytes: a convenient but biologically fuzzy concept. Theriogenology 2001; 55: 1277–89. 26. Brown SD, Balling R. Systematic approaches to mouse mutagenesis. Curr Opin Genet Dev 2001; 11: 268–73. |