Parmi les maladies infectieuses humaines les plus fréquentes, les infections urinaires représentent un problème important de santé publique en termes de morbidité et de coût. L’agent étiologique isolé dans les infections urinaires non compliquées est presque exclusivement Escherichia coli [ 1]. L’épithélium urinaire constitue une barrière fortement imperméable et un environnement hostile aux bactéries qui ne le colonisent normalement pas. Les souches d’UPEC (uropathogenic E. coli) ont acquis la capacité de coloniser cet épithélium, propriété conférée par un ensemble de facteurs de virulence comprenant des facteurs d’attachement de type P-fimbriae et des exotoxines. Ainsi, les toxines hémolysine-α et facteur cytotoxique nécrosant-1 (CNF1) caractérisent respectivement 40 % et 30 % des UPEC [ 2]. Le gène cnf1 est aussi retrouvé dans 10 % des souches E. coli K1 responsables de méningites ainsi que chez Yersinia pseudotuberculosis (pour revue, voir [ 3]).
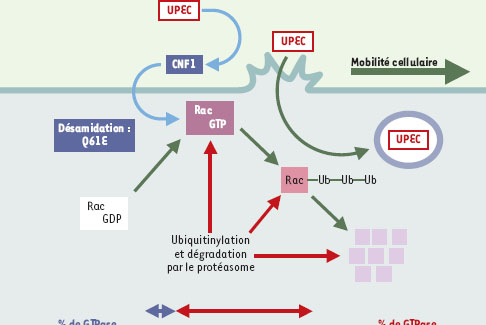
La toxine CNF1 possède une structure classique composée de trois domaines fonctionnels, chacun responsable d’une des trois étapes du processus d’intoxication [ 4]. Le tiers amino-terminal de CNF1 confère la capacité de liaison de la toxine à un récepteur de la membrane de la cellule hôte. Cette association permet à la toxine de pénétrer dans des compartiments d’endocytose acides [ 5]. Cette acidité est responsable de l’insertion de la partie médiane de CNF1 dans la bicouche lipidique et de l’injection du domaine carboxy-terminal dans le cytoplasme [ 6]. Le domaine carboxy-terminal de CNF1, véritable composant enzymatique de la toxine, catalyse alors la désamidation de la glutamine 63 de Rho (ou 61 de Rac et CDC42) en acide glutamique [ 7]. Les protéines Rho appartiennent à la super-famille des petites protéines GTPasiques Ras, régulatrices de l’homéostasie cellulaire [ 8] (→). Elles fixent et hydrolysent le GTP en GDP et oscillent ainsi entre une forme respectivement active, membranaire, capable de fixer et d’activer des protéines effectrices, et une forme inactive cytosolique. La glutamine est essentielle à l’hydrolyse du GTP et sa modification par CNF1 produit donc l’activation permanente des GTPases Rho (Figure 1).
(→) m/s 2003, n° 3, p. 358
| Figure 1.
Représentation schématique du mécanisme d’intoxication des cellules épithéliales par la toxine CNF1 des E. coli uropathogènes (UPEC). L’étude de CNF1 (cytotoxic necrotizing factor) a permis de mettre en évidence l’existence d’un système de vigilance cellulaire capable de produire l’ubiquitinylation et la dégradation par le protéasome des protéines Rho en réponse à leur activation soutenue. L’activation transitoire des protéines GTPasiques Rho (Rho, Rac et CDC42) due à leur rapide ubiquitinylation et à leur dégradation par le protéasome produite en réponse à la toxine est représentée sur le graphique. La résultante de l’activation-dégradation des protéines Rho produit leur activation modérée et confère aux cellules hôtes des capacités de migration et de phagocytose. |
CNF1 partage, avec une vingtaine de facteurs de virulence bactériens connus, la propriété biochimique de modification des GTPases Rho (pour revue, voir [3]). Les protéines Rho semblent être en amont de cascades moléculaires commandant les remaniements du cytosquelette d’actine nécessaires à la phagocytose, à la migration et à la différenciation cellulaires [8]. L’activation de Rac et de CDC42 produit la formation de projections membranaires notamment impliquées dans la phagocytose de type Fcγ alors que le contrôle de l’état de contraction de l’actine par Rho participe à la phagocytose de type complément [ 9]. Rac contrôle également la formation d’espèces actives de l’oxygène en réponse aux pathogènes. Il partage aussi avec Rho et CDC42 le contrôle de la régulation de la synthèse de produits inflammatoires et de molécules pro- ou antiapoptotiques. Il est vraisemblable que la forte occurrence de facteurs de virulence dirigés contre ces protéines soit la conséquence de l’implication des protéines Rho dans les mécanismes de défense cellulaire (pour revue, voir [3]). Dans ce contexte, une activation soutenue des protéines Rho par CNF1 est toujours apparue difficile à concilier avec une vue finaliste de la physiologie bactérienne et cela d’autant plus que la majorité des toxines ciblant les protéines Rho sont connues pour les inactiver.
Le travail que nous venons de publier offre une nouvelle vision du mode d’action intracellulaire de cette toxine et permet une meilleure compréhension du mode d’invasion des cellules épithéliales par les bactéries pathogènes [ 10]. Nous avons mis en évidence que CNF1 induit, in vivo, une activation transitoire des protéines Rho qui est corrélée avec leur déplétion. En effet, la modification par la toxine de la protéine Rac (activation) produit sa dégradation par le protéasome (inactivation par déplétion). Cette observation mise en évidence grâce à CNF1 nous a alors conduit à découvrir qu’il existe dans les cellules un système de vigilance capable de contrôler le niveau de protéines Rho actives. Ainsi, l’activation soutenue de la protéine Rac, par mutation ou expression d’un facteur cellulaire activateur, induit sa sensibilisation à l’ubiquitinylation, proportionnellement à son niveau d’activation. Cet ensemble de résultats constitue un modèle capable de réconcilier certaines observations contradictoires sur le caractère oncogénique des GTPases Rho: bien que la surexpression de protéines de la famille Rho confère des caractéristiques oncogéniques, aucune mutation activatrice de ces protéines n’a encore été observée dans les cancers [ 11].
Ce mécanisme d’activation-dégradation des protéines Rho par le protéasome conduit à une seconde phase d’activation modérée de ces protéines. C’est pendant cette seconde phase que les cellules épithéliales de vessie ou d’endothélium ombilical deviennent mobiles et douées d’une forte capacité de phagocytose. Cela doit permettre, d’une part, la disjonction de l’épithélium et, d’autre part, l’invasion des cellules par les UPEC. L’internalisation des UPEC dans les cellules épithéliales pourrait leur offrir une niche protectrice contre l’attaque par des cellules effectrices de la réponse immunitaire. L’implication de CNF1 en tant que facteur d’invasion s’inscrit dans une évolution globale du concept de la maladie infectieuse urinaire, suggérant qu’elle constitue une pathologie extra- et intracellulaire.
De plus, par analogie à CNF1, nous avons proposé que les facteurs de virulence SopE et SptP, respectivement activateur et inhibiteur de Rac et de CDC42, présents chez Salmonella, pourraient être responsables d’une activation limitée des protéines Rho, nécessaire à l’obtention d’une forte efficacité d’invasion des cellules épithéliales de l’hôte par les bactéries [ 12]. Cela permet de comprendre l’existence de facteurs antagonistes, activateurs et inhibiteurs des GTPases Rho, au sein d’une même bactérie pathogène.