| |
| Med Sci (Paris). 2003 March; 19(3): 327–336. Published online 2003 March 15. doi: 10.1051/medsci/2003193327.Identifier et comprendre les allergies médicamenteuses Pascal Demoly,1* Dominique Hillaire-Buys,2 Nadia Raison-Peyron,1 Philippe Godard,1 François-Bernard Michel,1 and Jean Bousquet1 1Maladies Respiratoires, Inserm U.454 - IFR3, Hôpital Arnaud de Villeneuve, Avenue Gaston Giraud, 34295 Montpellier Cedex 05, France 2Centre Régional de Pharmacovigilance, Hôpital Saint-Charles, 34295 Montpellier Cedex 5, France |
Les allergies et les intolérances médicamenteuses représentent un problème fréquent, presque quotidien, pour le médecin prescripteur. Responsables d’une mortalité, d’une morbidité et de surcoûts mal évalués, elles constituent ainsi un problème de santé publique très mal exploré. Leurs mécanismes, comme leurs manifestations, sont variés, incluant l’ensemble des quatre réactions immunologiques de la classification de Gell et Coombs [
1]. Par ailleurs, leurs diagnostics ne sont que trop rarement confirmés. Il n’existe ainsi pas de réelles études épidémiologiques systématiques, car de nombreuses réactions revêtent les symptômes d’une allergie sans pour autant posséder de mécanisme allergique (réactions « anaphylactoïdes », autres diagnostics différentiels). Les outils cliniques et biologiques diagnostiques sont rares, et la plupart non validés. Or, seul un diagnostic formel d’allergie ou d’intolérance médicamenteuse permet de mettre en place des mesures de prévention et de traitement adaptées [
2–
4]. Devant l’impossibilité de détailler ici l’ensemble des connaissances relatives aux allergies et intolérances médicamenteuses, cet article se limitera à la présentation des données essentielles concernant les études épidémiologiques incluant des données d’incidence et de mortalité, l’implication des lymphocytes T dans les réactions cutanées médicamenteuses, et les méthodes et stratégies de diagnostic les plus récentes. |
Épidémiologie des allergies médicamenteuses Épidémiologie descriptive : incidence et prévalence Dix à 20 % des patients hospitalisés présentent des effets secondaires aux médicaments [ 1–
3], les allergies médicamenteuses représentant jusqu’à 30 % de l’ensemble de ces réactions. Lazarou et al. [ 2] ont récemment analysé trente-trois études prospectives américaines réalisées entre 1966 et 1996, et rapporté que 15,1 % des sujets hospitalisés ont présenté un effet secondaire à des médicaments, 6,7 % présentant un effet sévère. Toutefois, on observe à la fois une sous-déclaration des effets indésirables des médicaments (même à l’hôpital, 6 % à 12 % au maximum sont notifiés) [ 1] et une surestimation de ce type de réactions en raison de l’absence de précision des diagnostics portés [ 1]. La revue de Bigby et al. [4], retraçant un travail du Boston collaborative drug surveillance program, fournit la majorité des données d’incidence des réactions allergiques médicamenteuses régulièrement reprises. Les auteurs ont recensé le nombre de cas de réactions cutanées allergiques chez 15438 patients hospitalisés sur une période de sept ans: 358 réactions, concernant donc 2,3 % des administrations, ont été colligées et confirmées par un dermatologue. Les incidences ont été ensuite calculées en fonction de chacun des cinquante et un médicaments à l’origine de la réaction: 5,1 % pour l’amoxicilline, 3,4 % pour le cotrimoxazole, 3,3 % pour l’ampicilline, 2,2 % pour les produits sanguins, 2,1 % pour les céphalosporines, 2 % pour l’érythromycine, 1,8 % pour la pénicilline G, 0,4 % pour la gentamycine… Des études de cohorte ont elles aussi rapporté des taux de réactions allergiques en réponse à l’administration de médicaments, en particulier d’antibiotiques: 0,7 % à 10 % pour les allergies aux β-lactamines (cause la plus fréquente d’allergies médicamenteuses) [
5], 7,3 % d’éruptions cutanées (12,3 % pour le Céfaclor®, 8,5 % pour les sulfamides et 7,4 % pour les pénicillines) pour près de 6000 prescriptions d’antibiotiques à des enfants [
6]. Dans une cohorte d’étudiants traités par ciprofloxacine pour prévenir le portage du méningocoque, une incidence de 3/3 200 réactions anaphylactiques a été observée [
7]. Un autre exemple d’allergie médicamenteuse concerne l’injection de produits de contraste iodés. Dans une enquête de Katayama et al. [
8], portant sur le suivi de 337647 injections, l’incidence des réactions était de 12,6 %, avec 0,22 % de réactions sévères pour les produits ioniques et 0,04 % pour les produits non ioniques. Un dernier exemple est celui du registre français sur les allergies peropératoires (Groupe national d’études épidémiologiques des réactions anaphylactoïdes per-anesthésiques): la quatrième enquête [
9] a relevé 1303 cas de réactions (692 anaphylaxies et 611 réactions « anaphylactoïdes »), soit une incidence de 1/13000 anesthésies générales et 1/6 500 utilisations de curares. Aux États-Unis, Lazarou et al. [2] (voir plus haut) rapportent que 0,32 % des sujets hospitalisés (106000 personnes) sont décédés des suites de l’administration de médicaments, la mortalité d’origine iatrogène constituant, selon l’âge et le sexe, la 4e ou 6e cause de mortalité dans le pays. La part de l’allergie médicamenteuse était estimée à 23,8 % des effets secondaires (toutes sévérités confondues) des patients hospitalisés. Bien que relativement rare, le choc anaphylactique est la réaction immunologique la plus redoutée des médecins et des patients, du fait de l’installation extrêmement rapide des symptômes et de sa possible issue fatale (moins de 5 % des cas). Il n’est toutefois pas la seule cause de mortalité des réactions allergiques médicamenteuses: il faut aussi y ajouter celle de certaines formes de toxidermies [
10] telles que les syndromes de Lyell (30 % de mortalité), de Stevens-Johnson (5 %) et d’hypersensibilité avec des atteintes multi-organes (DRESS, drug reaction with eosinophilia and systemic symptoms) (10 %). L’incidence du choc anaphylactique a été analysée dans différentes études de cohorte. L’Agence du médicament danoise a ainsi recensé, entre 1968 et 1990, 30 cas de chocs anaphylactiques mortels après injection de produits de contraste iodés (8 cas), de pénicillines (6 cas), d’extraits allergéniques (5 cas), d’anti-inflammatoires non-stéroïdiens (2 cas) et de curare (1 cas) [
11], soit une incidence estimée à 0,3 cas par million d’habitants et par année. Une enquête, réalisée entre 1991 et 1995 dans les services d’urgences en Grande-Bretagne, a démontré que l’incidence des chocs anaphylactiques était en augmentation, passant de 56 par million d’admissions en 1991 à 102 en 1995, la première cause identifiable (62 %) étant médicamenteuse [
12] (cependant, seule la moitié des causes a été identifiée dans ce travail). L’enquête de Katayama et al. [8] relève une incidence de 6 décès pour un million d’injections de produits de contraste iodés, ioniques et non ioniques. Dans un travail réalisé chez des patients recevant des injections mensuelles de pénicilline G dans le cadre d’un rhumatisme articulaire aigu [
13], 4 épisodes anaphylactiques ont été décrits (soit une incidence de 0,2 % des patients et 0,01 % des injections) et 1 décès (soit une incidence de 0,05 % des patients et 0,003 % des injections). Dans notre série de 2150 patients pour lesquels est suspectée une allergie médicamenteuse et venus en consultation depuis 5 ans, il y avait 6 % de chocs anaphylactiques, 10,4 % d’oedèmes laryngés et 0,2 % de toxidermies graves. Plusieurs de ces cas étaient gravissimes, un cas s’est révélé mortel. Épidémiologie analytique : facteurs liés au médicament, facteurs liés à l’hôte Les données d’épidémiologie analytique sont dans l’ensemble peu nombreuses [ 2– 4]. Les facteurs les mieux connus sont ceux liés à la nature du médicament. Pour être immunogène à l’état natif, une substance doit avoir un poids moléculaire suffisant (> 1000 daltons), ce qui est le cas des sérums hétérologues et de certaines enzymes (chymopapaïne…) ou hormones (insuline…). La plupart des autres médicaments ont un poids moléculaire insuffisant et devront donc, pour induire une réponse immune spécifique, se comporter comme des haptènes et se coupler à une protéine porteuse (le plus souvent autologue, comme l’albumine plasmatique) [
14]. La posologie du médicament et ses modalités d’administration influencent la fréquence des réactions. Ainsi, dans les cas d’allergie aux pénicillines ou à l’insuline, il est depuis longtemps rapporté que les administrations intermittentes et répétées sont plus sensibilisantes qu’un traitement ininterrompu. Le patient sensibilisé réagit alors à des doses minimes. La voie parentérale est la plus immunogène, devant les voies locales (pommades, crèmes, collyres…), également très immunogènes du fait, probablement, de l’inflammation locale. La plupart des études démontrent que les femmes sont plus souvent atteintes que les hommes (65 %-70 % versus 30 %-35 %) [
15]. Il est par ailleurs souvent rapporté que les enfants sont moins concernés par ce type de réactions que les adultes. Toutefois, des études systématiques bien conduites font encore défaut. Les patients atopiques ne semblent pas prédisposés [15], mais leurs réactions pourraient être plus sévères. Cette notion est cependant régulièrement controversée et l’atopie pourrait jouer un rôle dans le cas de réactions à certains médicaments tels que la chymopapaïne. Dans le travail de Haddi et al. [15], les auteurs ont démontré que le pourcentage de sujets porteurs d’immunoglobulines E spécifiquement dirigées contre les principaux aéro-allergènes, évalués globalement par la positivité du Phadiatop®, n’est pas plus élevé chez des sujets présentant un antécédent de réactions allergiques aux médicaments (17,6 %) que chez des sujets dénués d’antécédent (19,5 %). La littérature fait parfois état d’une concentration familiale de certains cas, et des haplotypes HLA particuliers semblent impliqués dans les réactions retardées aux aminopénicillines [
16] et à la pyrazolone [
17], mais pas aux anti-convulsivants [
18]. Les patients infectés par le virus de l’immunodéficience humaine (VIH) souffrent plus que d’autres de réactions cutanées aux médicaments (10 à 50 fois plus concernant le cotrimoxazole) ou de syndromes de Lyell et de Stevens-Johnson (1000 fois plus que les sujets VIH négatifs) [
19]; ces réactions ne sont toutefois probablement pas toutes de nature immunologique. Un syndrome d’allergies médicamenteuses multiples, dépendantes des IgE pour les sujets allergiques aux pénicillines, a été décrit [
20] puis décrié [
21]. Ce syndrome, qui pourrait faire intervenir des contrôles génétiques, notamment HLA, ne doit toutefois pas être confondu avec les réactions à divers médicaments de structure identique (réactivité croisée). Il n’est pas encore possible à l’heure actuelle d’identifier les patients susceptibles de développer une allergie médicamenteuse. |
Physiopathologie des allergies médicamenteuses Réactivité chimique des médicaments La plupart des médicaments ne sont pas réactifs chimiquement. C’est classiquement au cours de leur métabolisme qu’apparaissent des composés intermédiaires réactifs, dits métabolites réactifs, capables de se fixer sur des protéines, d’en changer la structure et de devenir ainsi immunogènes (c’est-à-dire de se comporter comme des haptènes). Les β-lactamines natives [
22] et les métabolites des sulfamides [
23,
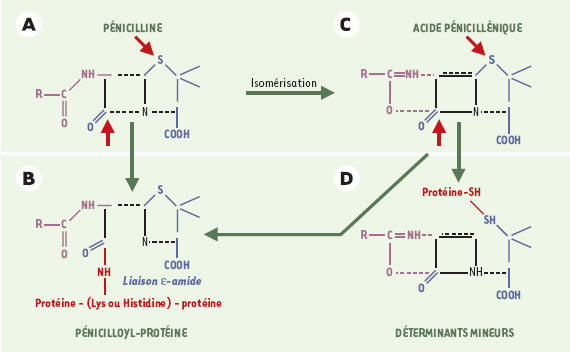
24] constituent deux exemples fréquents, et bien étudiés, de cet aspect. Dans les liquides biologiques, le noyau β-lactame (azétidine- 2-one) s’ouvre spontanément, exposant son groupement carbonyl, capable de réagir avec le groupement ε-amine d’une lysine ou d’une histidine portées par une protéine, pour former une liaison covalente ε- amide (Figure 1). Le groupement pénicilloyl ainsi formé est le principal produit de dégradation immunogène (95 %), les autres molécules de pénicilline étant dégradées par d’autres voies en divers déterminants antigéniques mineurs, dont l’acide pénicillénique (ou pénicilloïque) et les pénicillamines, qui forment des ponts disulfures avec les groupements sulfhydryles des cystéines protéiques [ 22].
 | Figure 1.
Déterminants antigéniques des pénicillines. Le noyau β-lactame (azétidine-2-one) s’ouvre spontanément (A), exposant son groupement carbonyl à l’attaque d’une protéine (d’une lysine ou d’une histidine) pour former une liaison covalente ε-amide au sein d’une pénicilloyl-protéine (B). Divers autres déterminants, dits mineurs (D, pénicillamines), sont également formés: l’acide pénicillénique, produit de l’isomérisation de la pénicilline (C), peut ainsi réagir, par l’intermédiaire de son groupement sulfhydryle, avec des résidus cystéines de chaînes protéiques. Les attaques protéiques sont indiquées par des flèches rouges. |
Le sulfaméthoxazole (SMX) n’est semble-t-il pas réactif spontanément, non plus que son principal métabolite issu de l’action de la N-acétyltransférase. Les métabolites réactifs du sulfaméthoxazole sont issus de sa biotransformation par le cytochrome P450-2C9 en SMXhydroxylamine, qui subit ensuite une auto-oxydation en nitroso-SMX, chimiquement très réactif. Les métabolites réactifs du sulfaméthoxazole peuvent non seulement se comporter comme des haptènes, mais aussi participer à des mécanismes toxiques non allergiques [23]. Ils sont fabriqués en quantité plus importante chez les sujets VIH positifs [23]: cela s’explique pour certains auteurs par l’effet combiné de la fréquence accrue du profil lent d’acétylation [
25,
26] chez les sujets séropositifs, qui implique une dérivation de leur métabolisme de l’acétylation vers la voie des cytochromes P450 et de la myéloperoxydase, et d’un certain déficit des processus de détoxification (déficit en cystéine [
27] et en glutathion [
28]). L’hypothèse des métabolites réactifs dans le cas du sulfaméthoxazole, proposée il y a une quinzaine d’années par Shear [24] et portée au rang de véritable dogme, est cependant remise en question [
29] depuis la mise en évidence par l’équipe de Pichler de très nombreux clones de lymphocytes T réagissant avec le médicament lui-même, plutôt qu’avec ses métabolites réactifs [22,
30], et l’absence de constance dans la découverte d’anomalies phénotypiques ou génotypiques des enzymes du métabolisme des médicaments. Implication des lymphocytes T spécifiques des médicaments L’allergie médicamenteuse est toujours associée à un mécanisme immunologique où peuvent être mis en évidence des anticorps (en général, mais pas toujours, de type IgE) et/ou des lymphocytes T activés dirigés contre les médicaments. Le rôle des lymphocytes T, par définition certain, n’est pas encore totalement élucidé. Il a été clairement démontré qu’il était possible d’identifier, d’isoler et de cloner à partir du sang périphérique de sujets allergiques aux pénicillines, au sulfaméthoxazole, à la lidocaïne, à la carbamazépine ou à la phénytoïne des lymphocytes T spécifiques du médicament [ 30–
32]. Ceux-ci ont également été isolés à partir de prélèvements de peau lésée. La caractérisation ex vivo de lymphocytes T spécifiques d’allergènes médicamenteux a permis de montrer qu’ils étaient en général CD4 positifs, dans l’ensemble restreints à certains allèles HLA et exprimaient en très grande majorité (>et peu, ou pas, 99 %) le récepteur T (TCR) α et β. Pour un même allergène médicamenteux, la réponse peut être hétérogène d’un patient à l’autre, mais également chez un même patient, avec la production de clones de TCRαβ différents, présentant soit une faible affinité et un faible pouvoir de synthèse de cytokines et de présentation antigénique, soit une forte affinité et une production importante de cytokines dites de profil Th2: interleukine-5 (IL-5), éotaxine et IL-4 (dans les formes cliniques avec hyperéosinophilie) ou IL-8 (dans les pustuloses exanthématiques aiguës généralisées) [
33]. Enfin, quelques clones CD4 et les rares clones CD8 sont clairement de type Th1, sécrétant de l’interféron γ(IFNγ) et peu, ou pas, d’IL-5 ou d’IL-4 [
31, 32,
34]. Toujours ex vivo et après stimulation avec l’allergène médicamenteux, les lymphocytes T se révèlent cytotoxiques pour les kératinocytes, mais seulement après l’incubation de ces derniers avec de l’IFNγ. La cytotoxicité est en effet en partie assurée par le système perforine-granzyme B [30] (→). Dans une autre étude, l’apoptose des kératinocytes au sein des lésions de syndrome de Lyell était induite via le système Fas-ligand de Fas: les sérums et les kératinocytes de 5 patients sur 7 contenaient des concentrations élevées de ligand de Fas, contrairement à ceux de 5 patients atteints d’éruption maculopapuleuse extensive et de 5 sujets sains [
35].
In vivo, les lymphocytes isolés du sang périphérique de patients allergiques expriment les marqueurs d’activation lymphocytaire HLA-DR [
36,
37], mais pas CD25 (chaîne α du récepteur de l’IL-2) [36]. En cas d’exanthèmes médicamenteux, ils expriment fréquemment des marqueurs de domiciliation cutanée (CLA, cutaneous lymphocyte-associated antigen, notamment) se liant aux molécules d’E-sélectine exprimées à la surface des cellules endothéliales du derme [37]. L’expression de marqueurs d’activation à la phase aiguë de la réaction allergique concerne les deux types de lymphocytes, CD4 et CD8. Elle disparaît à la phase de guérison et, en ce qui concerne les lymphocytes CD8, est corrélée à la sévérité de la réaction clinique: elle est ainsi plus importante dans les réactions bulleuses et/ou avec cytolyse hépatique associée [36]. La présence, dans le sang périphérique, de cytokines de profil Th2 (IL-5, IL-4) dans les réactions médicamenteuses immédiates [
38] et de profil Th1 (IFNγ, IL-2) dans les réactions non immédiates [38] est un argument supplémentaire en faveur de l’implication des lymphocytes T. Elle montre également que le concept de dérèglement de l’équilibre Th1/Th2 en faveur du profil Th2 dans les allergies immédiates (telles que l’asthme, la rhinite allergique et les allergies alimentaires ou aux venins d’hyménoptères) s’applique aussi à certaines formes cliniques d’allergie médicamenteuse. Cette libération de cytokines à la phase aiguë de la réaction allergique est éphémère et disparaît en phase de guérison [38]. Bases moléculaires de la reconnaissance des allergènes médicamenteux L’analyse des clones T spécifiques a permis de mettre en évidence différents types de réactions au cours du phénomène d’allergie aux médicaments (Figure 2). Les sulfamides antibactériens et la lidocaïne, par exemple, peuvent directement réactiver les lymphocytes T, sans apprêtement ni métabolisme, en se fixant de façon non covalente sur les molécules HLA de classe II des cellules présentatrices de l’antigène [ 22, 30]. La pénicilline native aussi peut se fixer directement, mais de façon covalente, cette fois, sur des protéines telles que les molécules HLA des cellules présentant l’antigène; elle est alors capable d’en modifier la structure et de réactiver spécifiquement certains clones T spécifiques. Cette activation est directe, c’est-à-dire qu’elle ne nécessite pas que la pénicilline subisse l’étape préalable de digestion ( processing) siégeant dans le réticulum endoplasmique, comme c’est le cas avec les conjugués pénicilline- albumine [
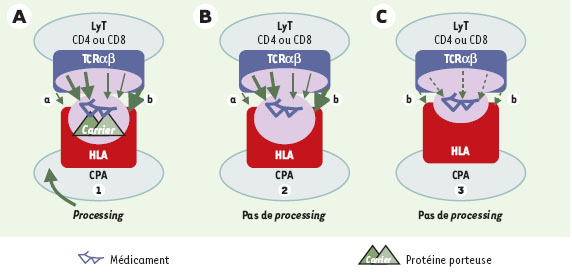
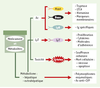
39]. Comme le font les IgE spécifiques, les clones T des patients allergiques aux β-lactamines reconnaissent aussi bien le noyau β-lactame que le reste de la molécule, c’est-à-dire tout ou partie des chaînes latérales surtout, mais peut-être également le noyau thiazolidine pour les pénicillines et le noyau dihydrothiazine pour les céphalosporines. C’est plus souvent le peptide modifié par l’haptène que l’haptène seul qui est cependant reconnu par le TCR.
 | Figure 2.
Bases moléculaires de la reconnaissance des médicaments. Selon les travaux des équipes de Weltzien [57] et Pichler [56], trois mécanismes peuvent être envisagés: présentation des médicaments aux lymphocytes T (LyT) avec (1) ou sans (2, 3) processing, c’est-à-dire avec ou sans digestion du médicament dans le réticulum endoplasmique de la cellule présentatrice de l’antigène (CPA); présentation avec (1, 2) ou sans (3) liaisons covalentes entre le récepteur T (plus souvent TCRαβ) et les molécules HLA de classe II. Les exemples donnés ici sont ceux des β-lactamines (A, B), du sulfaméthoxazole (SMX) (B, C) et de la lidocaïne (C). L’épaisseur des flèches schématise la force des liaisons; leur position précise si tout ou partie seulement du médicament et de sa protéine porteuse sont inclus dans le site de reconnaissance. Allèles HLA: peu restreint (a) ou restreint (b). |
Immunopathologie des exanthèmes médicamenteux allergiques Les réactions cutanées sont les effets secondaires allergiques médicamenteux les plus fréquents, dont l’expression clinique est variable. Les réactions immédiates, de type urticaire/angioedème, par exemple, sont souvent de mécanisme dépendant des IgE lorsqu’elles sont de nature allergique. Les réactions non immédiates, de type exanthème maculopapuleux, par exemple, impliquent l’activation de lymphocytes T spécifiques, lorsqu’elles sont de nature allergique. Des lymphocytes T (CD4 et CD8) spécifiques sont retrouvés non seulement dans le sang des patients allergiques aux médicaments, mais aussi dans les biopsies de peau lésée réalisées en phase aiguë de la maladie [ 36] et sur le site de patch tests positifs avec le médicament. Des lymphocytes T, CD4 surtout mais aussi CD8, infiltrent la jonction dermo-épidermique des lésions cutanées, et sont souvent associés à un infiltrat de polynucléaires, éosinophiles ou neutrophiles. Leur caractérisation montre qu’ils sont activés (expression des marqueurs HLADR et CD25), souvent cytotoxiques (expression de la perforine et du granzyme B) [ 36] vis-à-vis des kératinocytes, ce qui se traduit par une spongiose et une nécrose lors de l’analyse histologique [ 36] et qu’ils expriment fréquemment des molécules d’adhérence, CD11a, CD18, CD62L notamment [
40]. L’infiltration de lymphocytes CD8 est corrélée à la sévérité de la réaction clinique, plus importante dans les réactions bulleuses et/ou avec cytolyse hépatique associée [ 36,
41]. L’expression des molécules HLA-DR concerne également les cellules de Langerhans et les kératinocytes, en association avec les molécules d’adhérence ICAM-1 et CD62L [ 40]. Ces derniers, en présentant l’allergène médicamenteux aux lymphocytes T activés, sont alors la cible de la réaction cytotoxique assurée par le système perforine-granzyme B dans le cas des érythèmes maculo-papuleux [ 36] (Figure 3) et le système Fas-ligand de Fas dans celui des syndromes de Lyell [ 35]. Il a par ailleurs été montré que les kératinocytes, grâce à l’expression de nombreux cytochromes P450 et transporteurs de xénobiotiques, sont capables, notamment, de produire des métabolites réactifs du sulfaméthoxazole [
42], ce qui pourrait constituer une explication supplémentaire de la fréquence accrue de réactions cutanées au cours des allergies médicamenteuses.
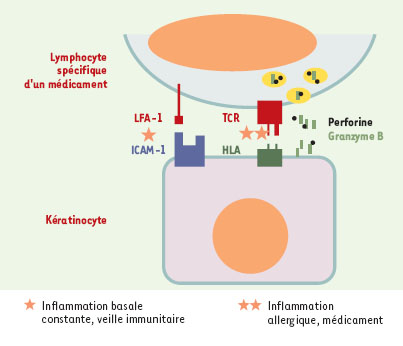
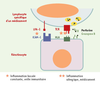 | Figure 3.
Conséquence de la reconnaissance spécifique d’un médicament par un lymphocyte T au niveau de la peau. Le kératinocyte, présentant naturellement un certain degré d’inflammation à l’état de base (interaction LFA-1 et ICAM-1), devient, en présentant le médicament à ce lymphocyte T, la cible de la cytotoxicité par le système perforine-granzyme B. LFA: β2-intégrine; ICAM: intercellular adhesion molecule; TCR: récepteur T α et β. |
|
Diagnostic des allergies médicamenteuses Les sociétés européennes de dermatologie (European society of contact dermatitis), d’allergologie et d’immunologie clinique (European academy of allergy and clinical immunology, www.eaaci.org) ont proposé une prise en charge diagnostique standardisée. Un questionnaire [
43] et des recommandations générales [
44,
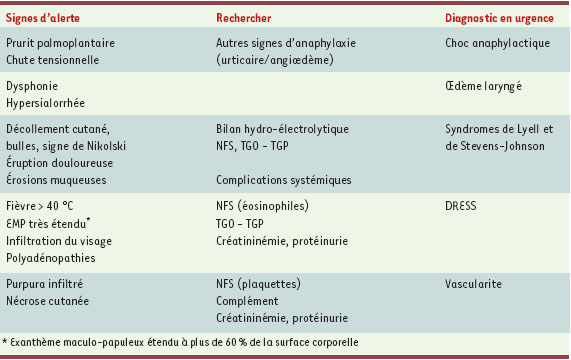
45] sur la pratique des tests cutanés ont été successivement élaborés. De nombreux autres documents sont en cours de relecture. Au niveau national, les sociétés savantes se font le relais de ces recommandations européennes par le biais de leurs représentants français. Elles essaient actuellement de rendre accessibles, dans le cadre de réseaux, des banques de procédures et de connaissances (www.sfaic.com). Démarche diagnostique stéréotypée Les deux étapes menant à un diagnostic de certitude sont l’interrogatoire et la réalisation de tests, cutanés ou, à défaut, de provocation. La première étape prévoit la recherche d’une histoire clinique compatible avec une allergie médicamenteuse. L’interrogatoire doit être minutieux, s’attacher à la description précise de la symptomatologie et de la chronologie des symptômes (contacts antérieurs, délai d’apparition après la dernière prise, effet de l’arrêt du médicament), rechercher la prise d’autres médicaments au moment de la réaction, et de médicaments de la même classe depuis, et étudier les antécédents du patient (notion d’incidents allergiques antérieurs, en présence ou non de toute prise médicamenteuse…) [43]. L’interrogatoire recherche également tout signe de gravité (Tableau I) dont la présence doit faire suspecter, explorer et, éventuellement, rapidement traiter un choc anaphylactique, un oedème laryngé, un syndrome de Lyell ou de Stevens-Johnson, une vascularite ou un syndrome d’hypersensibilité avec atteintes multi-organes (DRESS). La présence de ces signes de gravité impose le dosage de différents paramètres biologiques et l’arrêt immédiat du traitement.
 | Tableau I.
Signes de gravité à rechercher rapidement devant toute allergie médicamenteuse. DRESS: drug reaction with eosinophilia and systemic symptoms ou syndrome d’hypersensibilité; TGO-TGP: transaminase glutamique oxalo-acétique-transaminase glutamique-pyruvique; NFS: numération-formule sanguine. |
Les algorithmes de pharmacovigilance [
46], principalement fondés sur l’interrogatoire, sont utiles dans de nombreux cas de réactions secondaires aux médicaments. Cependant, dans le cas de l’allergie médicamenteuse, l’interrogatoire, aussi minutieux soit-il, ne permet que rarement de porter le diagnostic. La symptomatologie est suggestive, mais rarement spécifique, et l’effet de l’arrêt du médicament n’est pas toujours concluant (possibilité de rebond). Par ailleurs, ces critères ne différencient pas les médicaments pris par le patient au cours de l’épisode supposé de nature allergique, contrairement au bilan allergologique. Ces doutes, qui ne sauraient pourtant guider un diagnostic médical, entraînent souvent pour le patient une contreindication de prescription des médicaments mis en cause, dont les conséquences sont parfois néfastes: contrainte d’une attention constante et source d’angoisse vis-à-vis des substances prescrites, surcoût possible des alternatives thérapeutiques, voire induction de résistances aux antibiotiques. Devant la suspicion d’une réaction de nature allergique et l’incapacité de trancher sur les seules données issues de l’interrogatoire, un bilan allergologique s’impose. Cette obligation tient surtout lorsque le médicament éventuellement en cause est indispensable, ou fréquemment prescrit (β-lactamines, paracétamol et anti-inflammatoires non stéroïdiens, par exemple), c’est-à-dire quand le seul principe d’éviction n’est pas envisageable. Seul un diagnostic formel d’allergies médicamenteuses, ou d’intolérance pour les antiinflammatoires non stéroïdiens, semble en effet pouvoir permettre de mettre en place les mesures adaptées de prévention et de traitement. Le bilan allergologique repose, dans un premier temps, sur la réalisation de tests cutanés ou de tests de provocation, ces derniers n’étant pratiqués qu’en cas de tests cutanés négatifs et validés, de tests non validés ou de tests impossibles à mettre en oeuvre, et uniquement en l’absence de contreindications (un document à ce sujet est en cours de relecture par la Société européenne d’allergologie). En effet, les risques de réactivation de la réaction allergique existent, et seuls certains centres sont habilités à un tel diagnostic. Les tests cutanés (prick tests et intradermiques) sont particulièrement importants pour les haptènes réactifs, afin de mettre en évidence le mécanisme dépendant des IgE: en effet, leur positivité démontre la présence d’anticorps, le plus souvent de type IgE, à la surface des mastocytes cutanés. Ils sont classiquement réalisés 4 à 6 semaines après la réaction, en milieu spécialisé associé à un secteur de réanimation car ils peuvent, à eux seuls, induire une réaction anaphylactique [44, 45]. Leur sensibilité et leur valeur prédictive varient selon les médicaments: d’excellentes (pénicillines, curares, sérums hétérologues, enzymes) à mauvaises ou inconnues (quinolones, opiacés, paracétamol, sulfamides, produits de contraste iodés et anti-inflammatoires non stéroïdiens). Lors des réactions retardées, des patch tests avec le médicament suspecté peuvent être réalisés, mais leur sensibilité reste inférieure à 70 % [44, 45]. Parfois, lorsque le médicament n’est pas disponible sous une forme réactive adéquate, c’est-à-dire que seuls ses dérivés métaboliques sont immunogènes (anti-inflammatoires non stéroïdiens, anesthésiques locaux, antibiotiques autres que les pénicillines…), ou lorsque les tests cutanés sont négatifs (cas des pénicillines, notamment), seuls les tests réalistes de provocation permettent de poser le diagnostic. Ils sont réalisés à distance (au moins un mois) de l’épisode et utilisent le médicament et la voie d’administration initiale mis en cause. Ils ne sont pas pratiqués si le médicament responsable est peu utilisé, si les alternatives à ce traitement sont nombreuses, ou lorsque la réaction a été grave (décollements cutanés, atteintes muqueuses faisant suspecter une dermatose bulleuse, érythème maculopapuleux extensif avec fièvre élevée, hyper-éosinophilie, cytolyse hépatique faisant suspecter une atteinte sévère de type DRESS, pustulose exanthématique aiguë généralisée et toute atteinte d’organes, vascularite…). C’est le test ayant la sensibilité maximale, mais il ne peut être réalisé que sous haute surveillance, et donc uniquement dans certains centres spécialisés associés à un secteur de soins intensifs ou de réanimation. Place de la biologie L’amélioration de la prise en charge des patients allergiques à des médicaments doit à terme être accessible à tout médecin et nécessite, de ce fait, la mise à disposition d’outils diagnostiques simples, discriminants et validés, par exemple biologiques. Pour l’instant, le diagnostic d’allergie ou d’intolérance médicamenteuse est avant tout clinique, puisque la plupart des tests biologiques disponibles, peu nombreux et non validés, connaissent de nombreux faux positifs et faux négatifs: ainsi, un test négatif ne permet pas d’exclure la responsabilité d’un médicament, tandis qu’un test positif traduit tout au plus une sensibilisation au médicament, sans affirmer sa responsabilité dans la réaction. En outre, les mécanismes d’allergie médicamenteuse sont multiples et les marqueurs solubles ou cellulaires variés (Figure 4).
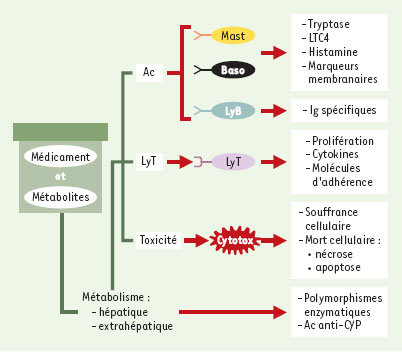
 | Figure 4.
Paramètres biologiques mesurables dans les tests d’hypersensibilité médicamenteuse. La multiplicité des cellules et des médiateurs impliqués dans ces réactions rend difficile la validation de ces tests. Ac: anticorps; Baso: polynucléaires basophiles; CYP: cytochrome P450; cytotox: cytotoxicité; Ig: immunoglobuline; LTC4: leucotriène C4; Ly: lymphocyte. |
La détection d’IgE anti-médicament ne suffit pas à elle seule à porter le diagnostic d’allergie médicamenteuse. Mais elle permet, dans un contexte clinique évocateur (symptômes typiques et chronologie rapide), de préciser que le mécanisme de la réaction est dépendant des IgE (surtout si des tests cutanés au médicament sont également positifs) et parfois d’explorer les réactivités croisées entre plusieurs médicaments, par inhibition quantitative. En revanche, l’absence d’IgE spécifiques circulantes ne permet pas d’éliminer le diagnostic. Par ailleurs, ces types de dosages ne sont disponibles en pratique clinique que pour certains médicaments allergisants (pénicillines, curares, chymopapaïne, thiopenthal, formol, insuline, protamine, toxine tétanique). Les tests d’histaminolibération sur sang total en présence du médicament sont bien corrélés avec les tests cutanés et les IgE spécifiques pour l’allergie aux curares [
47], mais ne sont pas assez sensibles pour les autres médicaments [48]. Compte tenu du faible nombre de basophiles circulants, les tests de dégranulation des polynucléaires basophiles ne sont pas fiables. Ils ont été remplacés par l’étude de l’expression à leur surface de marqueurs d’activation, parmi lesquels le CD63. Les tests de libération de sulfidoleucotriènes, proposés à la fois dans l’allergie dépendante des IgE et dans les fausses allergies par libération de ces médiateurs (comme avec l’aspirine, par exemple), ne permettent pas encore un diagnostic suffisamment fiable [48]. Devant une réaction clinique aiguë, les dosages sanguins d’histamine ou de tryptase et les dosages urinaires de méthylhistamine précisent le rôle des polynucléaires basophiles et des mastocytes, quelle que soit la cause de la dégranulation. La recherche d’une hyper-éosinophilie et d’une cytolyse hépatique [36] devant un érythème maculo-papuleux sévère fébrile permet d’évoquer le diagnostic de DRESS. Enfin, l’étude des lymphocytes T (prolifération, activation, clones) reste encore du domaine de certains laboratoires spécialisés. Le test de prolifération lymphocytaire est actuellement le test dont la sensibilité et la spécificité sont les meilleures (respectivement 77 % et 85 % dans une série de 923 patients testés) [49]. |
La complexité physiopathologique des allergies et des intolérances médicamenteuses, la difficulté de leur diagnostic, leur défaut d’enseignement au cours des études médicales et paramédicales et la crainte qu’elles inspirent au patient et au médecin sont différentes raisons expliquant leur méconnaissance actuelle, tant d’un point de vue épidémiologique que physiopathologique ou diagnostique. Cependant, les quelques équipes s’y intéressant aujourd’hui mettent en commun l’ensemble de leurs expériences cliniques et biologiques, ce qui devrait rapidement permettre de standardiser les pratiques diagnostiques et de faire avancer les connaissances fondamentales. Les sociétés française (SFAIC) et euréopéenne (EAACI) d’allergologie en ont fait un objectif prioritaire. |
1. Demoly P, Messaad D, Benahmed S, et al. Les réactions immunoallergiques d’origine médicamenteuse: données épidémiologiques et cliniques. Therapie 2000; 55: 13–21. 2. Lazarou J, Pomeranz BH, Corey PN. Incidence of adverse drug reactions in hospitalized patients. A meta-analysis of prospective studies. JAMA 1998; 279: 1200–5. 3. Imb JL, Pouyanne P, Haramburu F, et al. Iatrogénie médicamenteuse: estimation de sa prévalence dans les hôpitaux publics français. Therapie 1999; 54: 21–7. 4. Bigby M, Jick S, Jock H, Arndt K. Drug-induced cutaneous reactions. A report from the Boston collaborative drug surveillance program on 15,438 consecutive inpatients, 1975 to 1982. JAMA 1986; 256: 3358–63. 5. Smith JW, Johnson JEIII, Cliff LE. Studies on the epidemiology of adverse drug reactions. II. An evaluation of penicillin allergy. N Engl J Med 1966; 274: 998–1002. 6. Ibia EO, Schwartz RH, Wiedermann BL. Antibiotic rashes in children. Arch Dermatol 2000; 136: 849–54. 7. Burke P, Burne SR. Allergy associated with ciprofloxacin. Br Med J 2000; 320: 679. 8. Katayama H, Yamaguchi K, Kozuka T, Takashima T, Seez P, Matsuura K. Adverse reactions to ionic and nonionic contrast media. A report from the Japanese Committee on the Safety of Contrast Media. Radiology 1990; 175: 621–8. 9. Laxenaire MC. Épidémiologie des réactions anaphylactoides peranesthésiques. Quatrième enquête multicentrique (juillet 1994-décembre 1996). Ann Fr Anesth Reanim 1999; 18: 796–809. 10. Roujeau JC, Stern RS. Severe cutaneous adverse reactions to drugs. N Engl J Med 1994; 331: 1272–85. 11. Lenler-Petersen P, Hansen D, Andersen M, et al. Drugrelated fatal anaphylactic shock in Denmark 1968- 1990. A study based on notifications to the Committee on Adverse Drug Reactions. J Clin Epidemiol 1995; 48: 1185–8. 12. Sheikh A, Alves B. Hospital admissions for acute anaphylaxis: time trend study. Br Med J 2000; 320: 1441. 13. International Rheumatic Fever Study Group. Allergic reactions to long-term benzathine penicillin prophylaxis for rheumatic fever. Lancet 1991; 337: 1308–10. 14. Lafaye P, Lapresles C. Fixation of penicilloyl groups to albumin and appearance of antipenicilloyl antibodies in penicillin-treated patients. J Clin Invest 1988; 82: 7–12 15. Haddi E, Charpin D, Tafforeau M, et al. Atopy and systemic reactions to drugs. Allergy 1990; 45: 236–9. 16. Romano A, De Santis A, Romito A, et al. Delayed hypersensitivity to aminopenicillins is related to major histocompatibility complex genes. Ann Allergy Asthma Immunol 1998; 80: 433–7. 17. Kowalski ML, Woszczek G, Bienkiewicz B, Mis M. Association of pyrazolone drug hypersensitivity with HLA-DQ and DR antigens. Clin Exp Allergy 1998; 28: 1353–8. 18. Vittorio CC, Muglia JJ. Anticonvulsiviant hypersensitivity syndrome. Arch Intern Med 1995; 155: 2285–90. 19. Coopman SA, Johnson RA, Platt R, Stern RS. Cutaneous disease and drug reactions in HIV infection. N Engl J Med 1993; 328: 1670–4. 20. Asero R. Detection of patients with multiple drug allergy syndrome by elective tolerance tests. Ann Allergy Asthma Immunol 1998; 80: 185–8. 21. Khoury L, Warrington R. The multiple drug allergy syndrome: a matchedcontrol retrospective study in patients allergic to penicillin. J Allergy Clin Immunol 1996; 98: 462–4. 22. Zanni MP, von Greyerz S, Scnyder B, Wendland T, Pichler WJ. HLA-restricted, processing- and metabolism independent pathway of drug recognition by human αβ T lymphocytes. J Clin Invest 1998; 102: 1591–8. 23. Rieder MJ, Uetrcht J, Shear NH, Cannon M, Miller M, Spielberg SP. Diagnosis of sulfonamide hypersensitivity reactions by in vitro rechallenge with hydroxylamine metabolites. Ann Intern Med 1989; 110: 286–9. 24. Shear NH, Spielberg SP, Grant DM, Tang BK, Kalow W. Differences in metabolism of sulfonamides predisposing to idiosyncratic toxicity. Ann Intern Med 1986; 105: 179–84. 25. Carr A, Gross AS, Hoskins JM, Penny R, Cooper DA. Acetylation phenotype and cutaneous hypersensitivity to trimethoprimsulphamethoxazole in HIVinfected patients. AIDS 1994; 8: 333–7. 26. Wolkenstein P, Carriere V, Charue D, et al. A slow acetylator genotype is a risk factor for sulfonamide-induced toxic epidermal necrolysis and Stevens-Johnson syndrome. Pharmacogenetics 1995; 5: 255–8. 27. Naisbitt DJ, Vilar J, Stalford A, et al. Plasma cysteine and decreased reduction of nitroso sulphamethoxazole with HIV infection. AIDS Res Hum Retrovir 2000; 16: 1929–38. 28. Buhl R, Jaffe HA, Holroyd KJ, et al. Systemic glutathion deficiency in symptom free HIVseropositive individuals. Lancet 1989; 334: 1294–8. 29. Roujeau JC. Toxidermies médicamenteuses: quelques nouveautés. Rev Fr Allergol Immunol Clin 2002; 42: 71–4. 30. Schnyder B, Mauri-Hellweg D, Zanni M, Bettens F, Pichler WJ. Direct, MHCdependent presentation of the drug sulfamethoxazole to human alphabeta T cell clones. J Clin Invest 1997; 100: 136–41. 31. Mauri-Hellweg D, Bettens F, Mauri D, Brander C, Hunziker T, Pichler WJ. Activation of drug-specific CD4+ and CD8+ T cells in individuals allergic to sulfonamides, phenytoin, and carbamazepine. J Immunol 1995; 155: 462–72. 32. Zanni MP, von Greyerz S, Schnyder B, Wendland T, Pichler WJ. HLAunrestricted presentation of lidocaine by HLA-DR molecules to specific αβ+ T cell clones. Immunol Int 1998; 10: 507–15. 33. Britschgi M, Steiner UC, Schmid S, et al. T-cell involvement in druginduced acute generalized exanthematous pustulosis. J Clin Invest 2001; 107: 1433–41. 34. Zanni MP, Mauri-Hellweg D, Brander C, et al. Characterization of lidocaine specific T cells. J Immunol 1997; 158: 1139–48. 35. Viard I, Wehrli P, Bullani R, et al. Inhibition of toxic epidermal necrolysis by blockade of CD95 with human intravenous immunoglobulin. Science 1998; 282: 490–3. 36. Hari Y, Frutig-Schnyder K, Hurni M, et al. T cell involvement in cutaneous drug eruptions. Clin Exp Allergy 2001; 31: 1198–408. 37. Blanca M, Posadas SJ, Torres MJ, et al. Expression of the skin-homing receptor in peripheral blood lymphocytes from subjects with nonimmediate cutaneous drug reactions. Allergy 2000; 55: 998–1004. 38. Posadas SJ, Leyva L, Torres MJ, et al. Subjects with allergic reactions to drugs show in vivo polarized patterns of cytokine expression depending on the chronology of the clinical reactions. J Allergy Clin Imunol 2000; 106: 769–76. 39. Weltzien HU, Padovan E. Molecular features of penicillin allergy. J Invest Dermatol 1998; 110: 203–6. 40. Barbaud A, Béné MC, Reichert-Penetrat S, Jacquin-Petit MA, Schmutz JL, Faure GC. Immunocompetent cells and adhesion molecules in 14 cases of cutaneous drug reactions induced with the use of antibiotics. Arch Dermatol 1998; 134: 1040–1. 41. Hertl M, Bohlen H, Jugert F, Merk HF. Predominance of epidermal CD8+ T lymphocytes in bullous cutaneous reactions caused by β-lactam antibiotics. J Invest Dermatol 1993; 101: 794–9. 42. Reilly TP, Lash LH, Doll MA, et al. A role for bioactivation and covalent binding within epidermal keratinocytes in sulfonamide-induced cutaneous drug reactions. J Invest Dermatol 2000; 114: 1164–73. 43. Demoly P, Kropf R, Bircher A, Pichler WJ. Drug hypersensitivity questionnaire. Allergy 1999; 54: 999–1003. 44. Brochow K, Romano A, Blanca M, Ring J, Pichler WJ, Demoly P. General considerations for skin test procedures in the diagnosis of drug hypersensitivity. Allergy 2003 (sous presse). 45. Barbaud A. Gonçalo M, Bruynzeel D, Bircher A. Guidelines for skin tests with drugs in the investigation of cutaneous adverse drug reactions. Contact Dermatitis 2001; 45: 321–8. 46. Begaud B, Evreux JC, Jouglard J, Lagier G. Imputabilité des effets inattendus ou toxiques des médicaments. Actualisation de la méthode utilisée en France. Therapie 1985; 40: 111–4. 47. Guilloux L, Ricard-Blum S, Ville G, Motin J. Histamine release assay and radioimmunoassay for the detection of IgE antibodies against neuromuscular blocking drugs. Ann Fr Anesth Reanim 1993; 12: 182–6. 48. Lebel B, Messaad D, Kvedariene V, Rongier M, Bousquet J, Demoly P. Cysteinyl-leukotriene release test (CAST) in the diagnosis of immediate drug reactions. Allergy 2001; 56: 688–92. 49. Nyfeler B, Pichler WJ. The lymphocyte transformation test for the diagnosis of drug allergy: sensitivity and specificity. Clin Exp Allergy 1997; 27: 175–81. |