Les dix ans de la découverte du facteur de détermination testiculaire des mammifères SRY (sex determining region Y chromosome) ont été célébrés en 2001 lors d’un symposium organisé par la Fondation Novartis [1]. Cette réunion internationale des principaux acteurs du domaine a permis de mesurer le chemin parcouru depuis le clonage de ce gène, mais aussi le chemin restant à parcourir pour comprendre comment un même tissu embryonnaire simple peut donner naissance à deux organes aussi différents que le testicule et l’ovaire. Dans les deux sexes, la gonade est constituée par l’excroissance de la crête génitale, phénomène détectable dès 10,5 jours postcoïtum chez la souris. Elle constitue alors une ébauche de gonade bi-potente, c’est-à-dire capable de former une gonade mâle ou femelle, qui s’oriente vers un destin testiculaire après expression du gène Sry localisé sur le bras court du chromosome Y. Très tôt, il fut proposé que la protéine SRY pourrait agir comme un facteur de transcription liant et courbant l’ADN par l’intermédiaire d’un domaine protéique caractéristique de la superfamille des protéines de forte mobilité ou famille HMG [2]. L’expression du gène Sry induit un ensemble d’événements morphogénétiques incluant la prolifération et la délamination des cellules de l’épithélium coelomique de la crête neurale, la migration de cellules issues du mésonéphros, l’induction d’une vascularisation spécifique et enfin l’organisation de cordons sexuels entourant les cellules germinales primordiales [3]. Toutefois, SRY n’est retrouvé que chez les mammifères et, sur le plan moléculaire, aucune cible directe n’a pu être décrite à ce jour.
Dans le même temps, d’autres facteurs de transcription à domaine HMG similaire à celui de SRY ont été isolés et caractérisés [4]. En particulier, Sox9, un gène autosomique conservé chez l’ensemble des vertébrés, s’est révélé constituer un autre facteur de détermination testiculaire. Des mutations hétérozygotes de Sox9 engendrent chez l’homme, outre le syndrome campomélique (→), une inversion de sexe chez 75 % des individus XY. Sox9 est également capable d’induire la formation de testicules en l’absence de SRY chez des souris transgéniques de génotype XX (→→). SOX9 contribue à l’activation transcriptionnelle du gène codant pour l’hormone anti-müllérienne (AMH) dans la cellule de Sertoli, conduisant à la régression des conduits müllériens femelles et clôturant ainsi les étapes regroupées sous le terme de détermination du sexe [5, 6]. Sox9 constitue un candidat cible plausible pour SRY car il est surexprimé spécifiquement chez le mâle durant une fenêtre temporelle compatible avec un contrôle direct par SRY [7]. Cependant, SOX9 est déjà exprimé dans les gonades mâles et femelles juste avant l’étape de détermination sexuelle. À ce stade, et malgré la présence de signaux de localisation nucléaire (NLS) [8], la localisation subcellulaire du facteur SOX9 est uniquement cytoplasmique, l’entrée dans le noyau s’opérant dans la seule gonade mâle après l’expression du gène Sry [9]. Une étude récente démontre la présence, dans le domaine de liaison à l’ADN de SOX9, d’un signal d’export nucléaire (NES) fonctionnel [10] et permet d’établir de nouvelles hypothèses sur le mécanisme d’induction de la différenciation testiculaire. L’export nucléaire de SOX9 est dépendant de la protéine d’export CRM1 et peut donc être inhibé par la leptomycine B (LMB). L’inhibition de l’export par la LMB, dans des gonades de souris de génotype XX cultivées in vitro, conduit au maintien de SOX9 dans le noyau et à l’induction d’une détermination mâle attestée par la mise en place de cordons sexuels sécréteurs d’hormone anti-müllérienne (Figure 1). Cette observation suggère que c’est la localisation subcellulaire de SOX9, elle-même dépendante des séquences NLS et NES, qui contrôlerait le mécanisme de détermination du sexe: l’entrée de SOX9 dans le noyau conduirait à la différenciation mâle et son maintien dans le cytoplasme à la différenciation femelle (Figure 2). Ces observations devront être confirmées in vivo, en particulier par des études visant à comprendre dans quelle mesure une altération d’origine génétique ou environnementale de ce transport pourrait expliquer certaines pathologies du développement de l’appareil reproducteur. Quoi qu’il en soit, SOX9 s’ajoute à la longue liste des facteurs de transcription dont la localisation cytoplasmique ou nucléaire permet de moduler des processus fondamentaux de la différenciation et du développement.
(→) m/s 2001, n° 10, p. 1242
(→→) m/s 2002, n° 2, p. 149
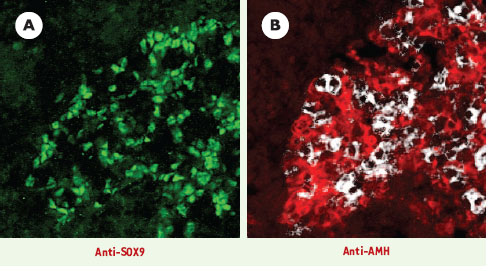
| Figure 1. Différenciation testiculaire dans des gonades XX cultivées en présence de leptomycine B. Cryo-sections adjacentes d’une gonade femelle cultivée in vitro en présence de 5 ng/ml de leptomycine B. Marquage par immunofluorescence avec les anticorps anti-SOX9 (vert) et anti-AMH (rouge). Les cellules germinales primitives sont révélées par l’activité de la phosphatase alkaline (en blanc, montré dans B seulement). Le maintien de la protéine SOX9 dans le noyau des cellules de gonades XX les conduit, après développement in vitro, vers un phénotype de cellule de Sertoli. La protéine SOX9 est maintenue dans le noyau de cellules organisées en structures ressemblant aux cordons sexuels (A). La sécrétion d’AMH est induite dans ces mêmes cellules, autour des cellules germinales (B). |
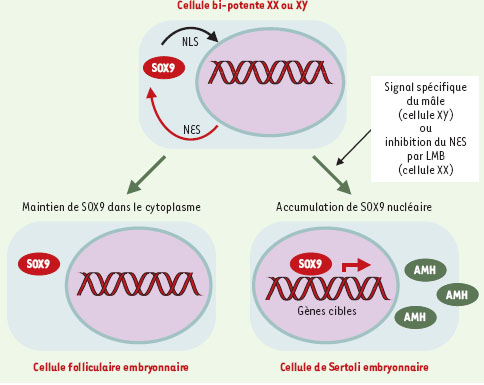
| Figure 2. Modèle de régulation de la détermination sexuelle par la localisation subcellulaire de SOX9. Avant la différenciation sexuelle, dans les cellules bi-potentes précurseurs des cellules folliculaires chez la femelle ou des cellules de Sertoli chez le mâle, la protéine SOX9 est maintenue dans le cytoplasme. Chez la femelle, SOX9 demeure cytoplasmique et disparaît avec la formation des cellules folliculaires embryonnaires. Chez le mâle, l’expression du gène Sry est suivie de l’entrée de SOX9 dans le noyau, ce qui déclenche le programme de différenciation mâle. Dans des cellules précurseurs femelles, la leptomycine B (LMB) provoque la rétention de la protéine SOX9 dans le noyau et provoque ainsi l’induction du programme mâle. L’entrée de SOX9 dans le noyau agirait comme un interrupteur déclenchant la voie de différenciation mâle, nécessaire pour prendre le relais du signal induit par SRY, mais également suffisant pour s’y substituer. AMH: anti-mullerian hormone; NES: nuclear export signal; NLS: nuclear localization signal. |