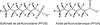2011
→ Aller vers ANALYSE
Selon un certain nombre d’études, une augmentation de la prévalence des troubles du versant masculin de la fonction de reproduction a été observée dans plusieurs pays occidentaux au cours des dernières décennies. Les données les mieux documentées concernent le cancer du testicule.
Il a été montré de manière non ambiguë que l’incidence du cancer du testicule, le cancer le plus fréquent chez l’homme jeune, a augmenté depuis plus de 50 ans dans de nombreux pays d’Europe. Cet accroissement est de 0,1 à 0,2 cas pour 100 000 personne-année, conduisant à un doublement de l’incidence dans les pays européens depuis 1970. En France, on observe une élévation moyenne de 2,5 % par an sur la période 1980-2005. En 2010, le taux d’incidence en France est estimé à 7 cas pour 100 000 personne-année. Cette élévation ne peut être expliquée ni par un vieillissement de la population ni par une évolution des pratiques de dépistage.
Deux types de malformations relativement fréquentes, l’hypospadias (anomalies des voies génitales externes mâles) et la cryptorchidie (anomalie de la descente testiculaire constatée à la naissance) semblent également en augmentation ; les données issues des registres sont cependant moins fiables que pour le cancer du testicule et les études ponctuelles sont en nombre limité. D’importantes variations géographiques sont constatées. Les données disponibles en France montrent une nette augmentation de l’incidence de l’hypospadias depuis la fin des années 1970 jusqu’au début des années 2000. Pour la cryptorchidie, il n’y a pas de données suffisantes en France permettant d’estimer son évolution.
Parallèlement, une baisse de la concentration spermatique a été rapportée en Amérique du Nord et en Europe. En France, les études menées à partir des données des Centres d’études et de conservation des œufs et du sperme (Cecos) indiquent également dans certaines régions, une baisse significative de la concentration spermatique et une baisse de la mobilité des spermatozoïdes morphologiquement normaux. Globalement, la détérioration temporelle de plusieurs caractéristiques spermatiques peut être considérée comme plausible dans certains pays industrialisés.
Les connaissances sur les évolutions temporelles de la fertilité des couples sont beaucoup plus limitées. Les quelques études fondées sur des indicateurs tels que la fécondabilité (estimée à partir du délai nécessaire pour concevoir), et qui avaient souvent des limitations méthodologiques, ne montrent pas de modification dans le temps de la fertilité des couples dans certaines zones de la Suède, du Danemark ou du Royaume-Uni. Des travaux indirects indiquent qu’une détérioration des caractéristiques spermatiques aurait pu avoir un impact sur la proportion de couples souffrant d’infécondité involontaire ou éligibles pour une assistance médicale à la procréation. Dans l’ensemble, ces travaux ne permettent pas d’apporter de conclusion forte concernant l’évolution temporelle de la fertilité des couples au cours des dernières décennies dans les pays industrialisés. En l’absence de système de surveillance de la fertilité dans la plupart de ces pays, une réponse à cette question est peu susceptible d’être apportée prochainement.
Au début des années 2000, l’équipe du professeur Skakkebaek à Copenhague a formulé l’hypothèse que la survenue d’un cancer du testicule, une altération de la production et de la qualité spermatique, la cryptorchidie et l’hypospadias pouvaient avoir une origine et des causes communes résultant d’une perturbation du développement du testicule pendant la vie fœtale. Le concept de « syndrome de dysgénésie testiculaire » qui a été proposé, reste cependant controversé.
Chez les filles, dans les pays occidentaux, l’observation la plus marquante concerne la tendance séculaire à une puberté plus précoce. La courbe de cette évolution varie d’un pays à l’autre. D’après les données norvégiennes, finlandaises et américaines, une diminution est estimée à 0,3 an par décennie ; en France, une diminution de 0,18 an par décennie est observée.
En l’absence de données historiques sur les expositions environnementales à l’échelle des populations, les études descriptives sur les évolutions temporelles de la fonction de reproduction ne permettent pas d’explorer les causes de ces évolutions. De nombreuses études étiologiques ont été réalisées pour tenter d’expliquer les différences observées entre individus ; ces études ne peuvent qu’indirectement renseigner les variations. À l’heure actuelle, c’est pour les facteurs tels que le tabagisme (à l’âge adulte ou subi durant la vie intra-utérine), pour certaines expositions professionnelles et pour les polluants les plus persistants dans l’organisme que les données suggérant un impact éventuel sur la fonction de reproduction sont les plus complètes. Pour analyser l’impact d’une exposition à des composés chimiques sur la santé reproductive, de nombreux travaux en toxicologie animale et en épidémiologie ont été conduits dans différents contextes de recherche ou d’évaluation de risque. La transposition des résultats des travaux d’une espèce à une autre implique une connaissance des similitudes et des différences dans les différentes étapes du développement de la fonction de reproduction.
Fonction de reproduction et différences entre les espèces
Chez tous les vertébrés, le testicule et l’ovaire se développent à partir d’une ébauche embryonnaire initialement bipotentielle mâle et femelle. À différents moments de son développement, variables en fonction des espèces, cette ébauche évolue vers une différenciation mâle ou femelle selon son patrimoine génétique (mammifères, oiseaux) ou des facteurs environnementaux comme la température ou le comportement (certains reptiles et poissons). On distingue donc une détermination génétique du sexe et une détermination environnementale. Il est important de prendre en considération ces différents modes de différenciation sexuelle pour évaluer les effets de facteurs environnementaux comme les perturbateurs endocriniens. Une modification du milieu aura plus de conséquences chez les poissons et les reptiles que dans d’autres espèces de vertébrés.
Chez les mammifères, le sexe est déterminé génétiquement à la fécondation selon que le spermatozoïde est porteur ou non du chromosome Y. Le gène SRY sur le chromosome Y induit la différenciation mâle des cellules somatiques de la gonade en cellules de Sertoli. Chez la femelle, en l’absence de Y, la différenciation de l’ovaire s’effectue à partir de la gonade bipotentielle. Le développement fœtal et néonatal des gonades est une phase particulièrement sensible, et toute substance chimique capable de perturber ces étapes précoces aura des répercussions sur la fonction de reproduction.
En fonction du sexe, les gonades se différencient pour produire des gamètes (gamétogenèse des cellules germinales) et synthétiser des hormones (stéroïdogenèse) sous l’effet desquelles le tractus génital interne et externe va évoluer pour permettre la reproduction : mise en place d’un appareil reproducteur accordé au sexe de la gonade qui assurera les fonctions de maturation des gamètes, insémination, fécondation, gestation ou parturition.
Chez les mâles, la stéroïdogenèse débute pendant la vie fœtale dans toutes les espèces, alors que chez les femelles, sa mise en route varie selon les espèces. Ainsi, les espèces avec un système hormonal actif pendant la vie fœtale (ruminants, espèce humaine) pourraient être plus sensibles aux effets par exemple des perturbateurs endocriniens. Très précocement, le testicule fœtal sécrète deux types d’hormones : l’hormone anti-mullérienne sécrétée par les cellules de Sertoli et la testostérone sécrétée par les cellules de Leydig. La testostérone est responsable de la différenciation des voies génitales mâles. La protéine Insulin-like 3 (INSL3), produite par les cellules de Leydig fœtales et adultes, est responsable du développement du gubernaculum impliqué dans la descente des testicules.
Chez les mammifères, les gonades se forment pendant la vie intra-utérine au cours du premier tiers de la gestation. Il existe un décalage dans le temps entre la différenciation mâle et femelle. La différenciation testiculaire est plus précoce que la différenciation ovarienne. Cela implique qu’une exposition à un perturbateur endocrinien à un moment donné du développement in utero n’aura pas les mêmes effets chez un fœtus mâle ou femelle.
La différenciation du tractus génital mâle est beaucoup plus dépendante de la production d’hormones que ne l’est celui de la femelle. En effet, les ovaires du fœtus ne sont pas indispensables à la féminisation de l’organisme alors que les testicules le sont pour la masculinisation. Cela est à prendre en considération pour comprendre pourquoi certaines substances induisent des effets plus marqués chez le mâle que chez la femelle. Tout dérèglement de la fonction hormonale précoce aura certainement des conséquences plus marquées chez le mâle que chez la femelle.
En revanche, la disparition ou la diminution brutale d’un grand nombre de cellules germinales aura des répercussions sur la différenciation de l’ovaire alors que l’absence de spermatogonies n’influence pas la différenciation du testicule.
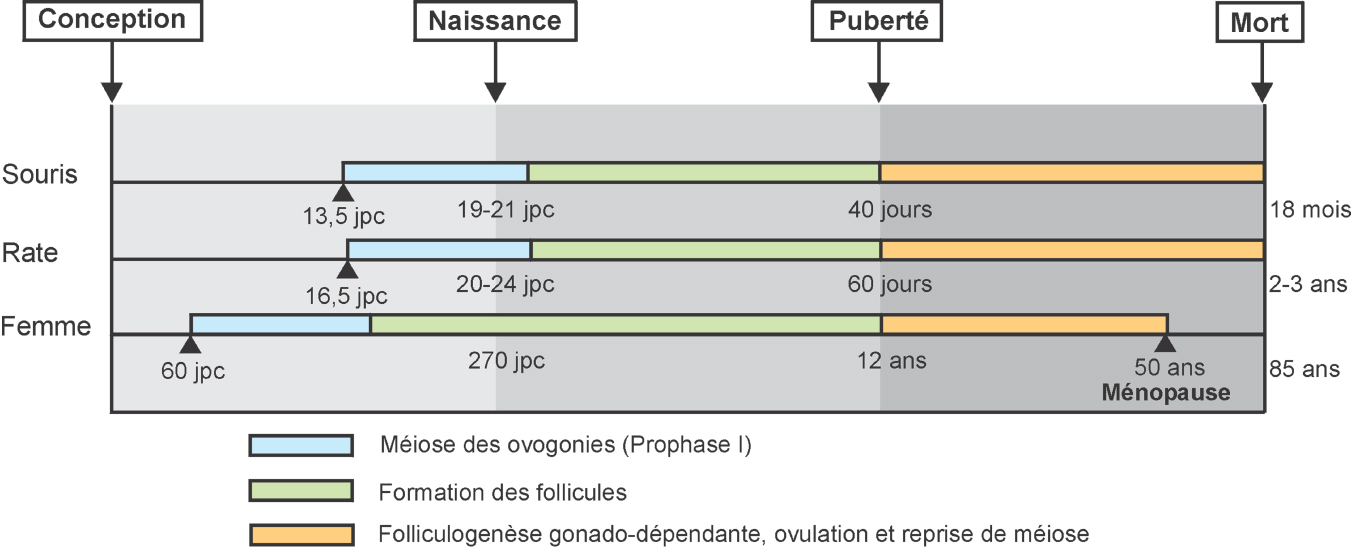
Le stock de follicules primordiaux formé dans l’ovaire fœtal, est fixe et déterminé pour toute la vie reproductive de la femelle tandis que la spermato genèse produit des gamètes de façon continue, de la puberté à la sénescence, chez le mâle. Toute altération quantitative des cellules germinales survenue très tôt chez la femelle sera donc irréversible et peut avoir des effets à très long terme (20 à 30 ans) sur la fertilité. Chez le mâle, ce sont les altérations qualitatives qui risquent d’avoir des effets à long terme.
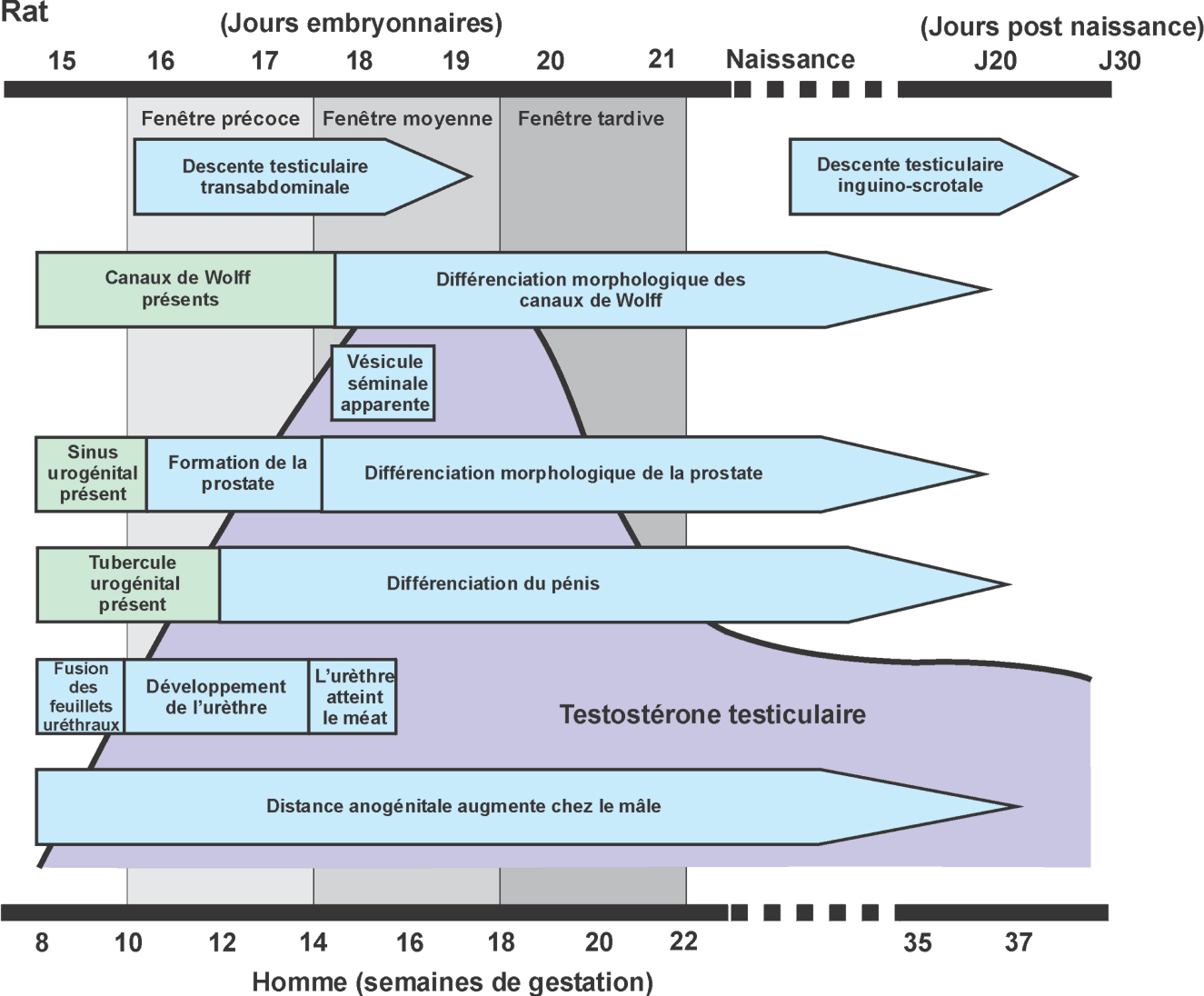
Les différentes étapes du développement ovarien et testiculaire, bien que globalement similaires chez tous les mammifères, présentent des variations importantes entre espèces et ne se déroulent pas pendant des périodes similaires. Ainsi par exemple, la formation des follicules débute dans l’ovaire pendant la vie fœtale chez l’être humain et pendant la vie postnatale chez les rongeurs. Cependant, les rongeurs sont le plus souvent utilisés comme modèles en toxicologie de la reproduction.
Il existe également des différences physiologiques (et pathologiques) au niveau du développement et de la fonction reproductive entre mammifères qui rendent l’extrapolation entre rongeurs et espèce humaine parfois difficile. Ainsi, l’ouverture vaginale qui signe le début de la puberté chez la souris n’existe pas chez les primates. À l’inverse, l’endométriose est une pathologie spécifique des primates.
Par ailleurs, les rongeurs sont des animaux polyovulants : à chaque cycle une dizaine, voire plus, de follicules vont arriver à l’ovulation et une dizaine d’ovocytes seront produits. Les mécanismes qui régulent la folliculogenèse et l’ovulation sont donc différents chez le rat ou la souris et dans les espèces monoovulantes comme l’homme ou les ruminants.
Les rongeurs naissent beaucoup plus immatures que la plupart des autres mammifères, ce qui limite l’extrapolation des expositions reçues après la naissance. La période néonatale des rongeurs correspond du point de vue du développement à la fin de la grossesse chez l’homme. En conséquence, la période où ont lieu, par exemple, la folliculogenèse ovarienne, ou le développement du système nerveux central diffère entre l’homme et le rat, de sorte que des perturbations durant la gestation auront plus d’impact sur ces deux mécanismes chez l’homme que chez les rongeurs.
Chez l’homme, le testicule, comme toutes les glandes endocrines, est sous le contrôle du complexe hypothalamo-hypophysaire. La gonadotrophine (GnRH) libérée par l’hypothalamus stimule la sécrétion de deux hormones hypophysaires : la folliculostimuline (FSH) et l’hormone luthéinisante (LH). La FSH agissant sur les cellules de Sertoli, participe à l’initiation de la spermatogenèse. À la puberté, la LH augmente la production de testostérone qui agit directement sur les cellules de Sertoli pour assurer le bon déroulement de la spermatogenèse.
Chez la femme, les ovaires sécrètent deux hormones, l’œstradiol et la progestérone. Au cours de la folliculogenèse, les cellules de la granulosa (qui ont la même origine que les cellules de Sertoli) deviennent sensibles à la FSH et vont continuer à se multiplier et à se différencier (comme les cellules de Leydig chez le mâle). Les androgènes sécrétés diffusent dans les cellules de la granulosa et, sous l’influence de la FSH, sont transformés en œstradiol. La différenciation des cellules de la granulosa produit également le liquide folliculaire et le follicule devient le follicule à antrum. La sécrétion brutale de LH déclenche la maturation finale de l’ovocyte et l’ovulation.
L’extrapolation des résultats obtenus chez les rongeurs (souris, rat) à l’homme exige de la prudence et doit prendre en compte les différences chronologiques et physiologiques qui existent entre les deux espèces. D’autres animaux apparaissent plus pertinents que les rongeurs, notamment ceux, comme par exemple les ruminants qui présentent de longues durées de gestation et de vie, qui sont mono-ovulants et ne portent qu’un seul petit par portée.
Les effets d’exposition in utero à des substances chimiques peuvent se révéler à très long terme ou parfois s’atténuer avec le temps. Il est donc indispensable de réaliser des études longitudinales avec plusieurs moments d’investigation (à la naissance, au sevrage, à la puberté, à l’âge adulte). L’intervalle de temps entre l’arrêt de l’exposition et le moment de l’étude doit être pris en compte car il peut expliquer une partie des résultats contradictoires de la littérature scientifique.
Devenir d’un xénobiotique dans l’organisme
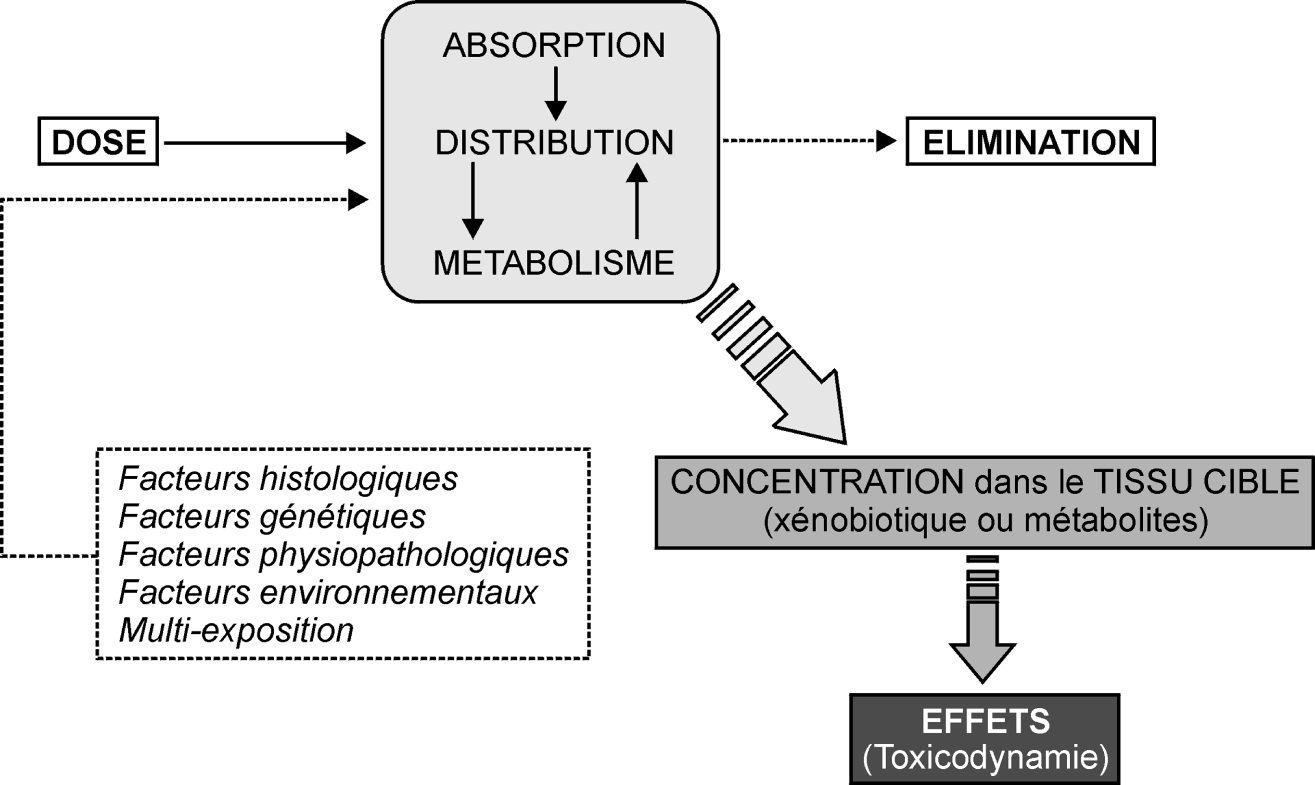
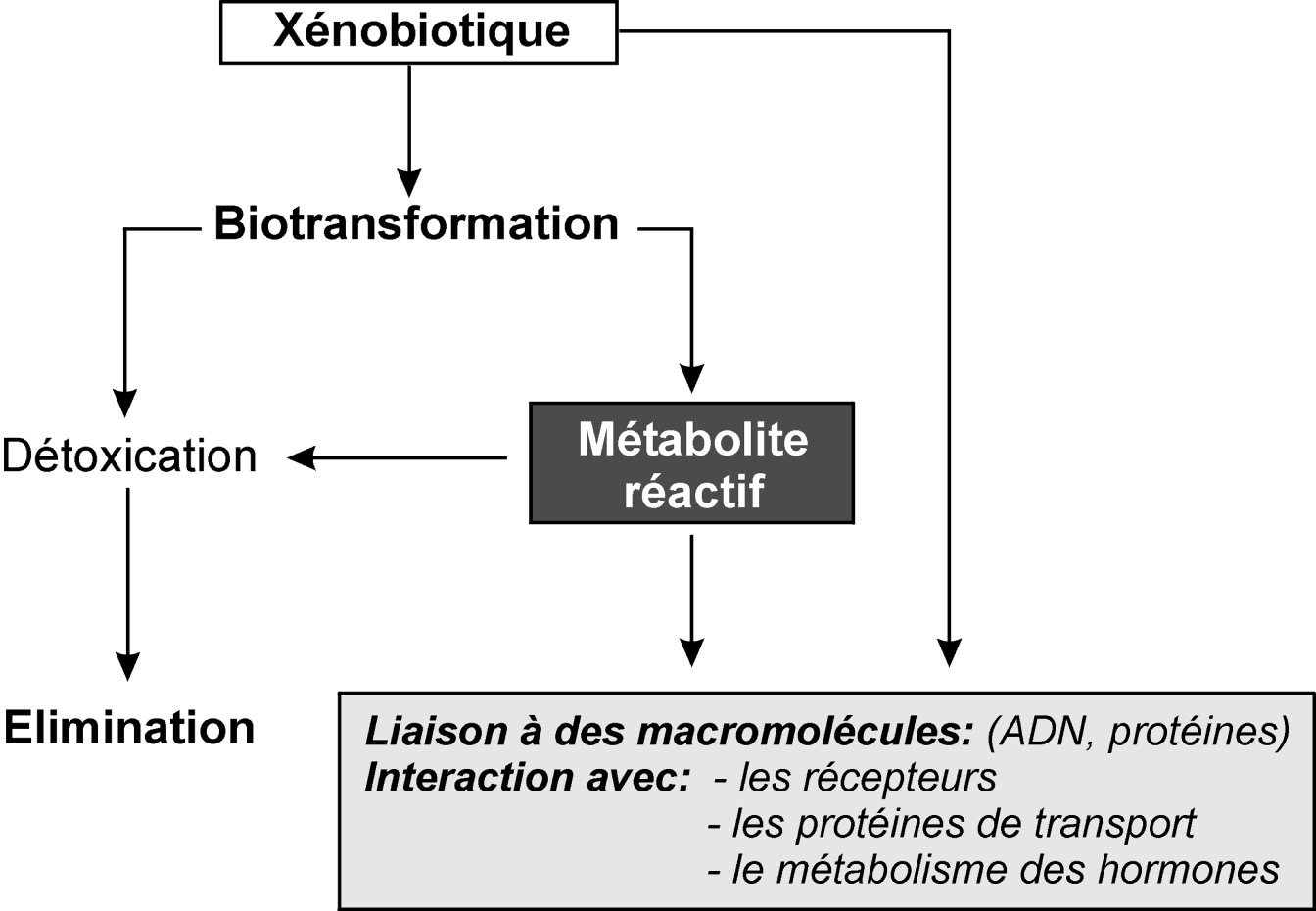
Le devenir d’un xénobiotique dans l’organisme peut se schématiser selon quatre étapes majeures : absorption ; distribution (avec stockage éventuel dans des organes ou des tissus cibles) ; biotransformation de la substance absorbée ; élimination.
L’absorption dépend en premier lieu des propriétés physico-chimiques de la substance elle-même, à savoir sa masse moléculaire, son degré d’ionisation, sa réactivité, sa solubilité. Les agents chimiques lipophiles sont mieux à même de traverser une membrane dont les constituants sont pour l’essentiel des lipides. Toutefois, en particulier au niveau de l’intestin, les substances très lipophiles sont moins bien absorbées en raison de la difficulté à former une solution ou une émulsion dans la lumière intestinale. La relation entre la dose externe et interne dépend donc en grande partie du niveau d’absorption, qui peut être lui-même affecté par le caractère lipophile de la substance ou encore, pour certains composés, de l’efficacité des systèmes de pompe à efflux tels que les P-glycoprotéines.
La différence entre l’absorption orale (c’est-à-dire la présence dans la paroi intestinale et la veine porte) et la biodisponibilité (c’est-à-dire la présence dans le sang systémique et dans les tissus) peut, entre autres facteurs, provenir de la dégradation chimique liée au métabolisme dans la paroi intestinale, de l’efflux vers la lumière intestinale ou encore du métabolisme présystémique dans le foie.
Bien que certaines barrières membranaires soient moins perméables que d’autres, les mécanismes de diffusion obéissent, de façon générale aux mêmes règles que celles qui régissent l’absorption et dépendent en premier lieu des caractéristiques physico-chimiques du xénobiotique. Le franchissement de la barrière placentaire est à examiner avec attention car la vie fœtale constitue une période particulièrement sensible du développement. Si l’exposition du fœtus aux œstrogènes maternels est limitée en raison de leur liaison à l’α-fœtoprotéine (protéine qui n’est normalement produite que par le fœtus au cours de son développement), nombre de substances chimiques (étiquetées comme perturbateurs endocriniens) sont beaucoup moins affines à cette protéine et se retrouvent de ce fait facilement dans la circulation fœtale. C’est ce qui semble se passer pour le bisphénol A.
Afin de pouvoir être excrétées dans l’urine ou dans la bile, les molécules doivent être hydrosolubles. La transformation chimique du xénobiotique est essentiellement catalysée par des enzymes qui fonctionnent avec des co-facteurs endogènes. Conceptuellement, ce processus a été séparé en deux phases au cours desquelles le xénobiotique est oxydé, réduit ou hydrolysé (phase I) et/ou conjugué à l’acide glucuronique, à un groupement sulfate ou acétate, au glutathion ou encore à un acide aminé (phase II). Ces réactions prennent en charge non seulement les xénobiotiques, mais également les composés endogènes comme les stéroïdes, les prostaglandines ou encore certaines vitamines.
Les monooxygénases à cytochrome P450 (CYP), enzymes membranaires localisées dans le réticulum endoplasmique, jouent un rôle majeur dans le métabolisme des xénobiotiques. On dénombre une soixantaine de CYP différents chez l’homme et une douzaine d’entre eux sont utilisés dans le métabolisme des xénobiotiques, parmi lesquels les formes 1A1/2, 2C9, 2C19, 2D6 et 3A4 sont les plus fréquemment impliquées. Une induction du CYP2C19 (aromatase) peut favoriser une surproduction d’œstrogènes et des effets féminisants. Un polymorphisme génétique, fréquent pour les formes 2C9, 2C19 et 2D6, se traduit par des différences interindividuelles de susceptibilité à l’action des toxiques.
Les réactions de phase II les plus fréquemment utilisées par l’organisme sont la glucuronidation et la conjugaison au glutathion et au groupement sulfate. Même si un grand nombre de tissus peuvent exprimer des enzymes de biotransformation, c’est le foie qui est l’organe principal du métabolisme. Il est toutefois possible que certaines isoformes particulières soient spécifiquement exprimées dans un tissu extra-hépatique. C’est par exemple le cas de l’aromatase qui chez l’adulte est exprimée dans les ovaires, le placenta, le tissu adipeux, l’os ou dans une moindre mesure, le testicule, mais non dans le foie, alors que les niveaux d’expression sont très élevés dans le foie fœtal.
Les voies de bioactivation passent le plus souvent par la production d’un métabolite ayant une affinité ou une activité bien plus forte que la substance initiale vis-à-vis d’une protéine de transport ou d’un récepteur nucléaire. Ainsi, des substances, inactives dans leur état initial, peuvent devenir œstrogéniques après l’intervention d’une enzyme, généralement un cytochrome P450, (il en est ainsi pour les phtalates, les composés polybromés...).
Une fois formés, les métabolites sont excrétés dans l’urine par le rein ou éliminés dans les fèces via la bile. L’excrétion dans le lait maternel peut également intervenir de façon substantielle, comme cela a été montré pour les composés polybromés (PBDE), les phtalates ou le bisphénol A. Généralement, les rongeurs excrètent davantage de métabolites par voie biliaire que le chien, le singe ou l’homme. Cela est dû à des différences entre espèces dans le seuil d’excrétion biliaire des métabolites. Après avoir été éliminés dans la bile, les conjugués glucuronides et sulfates peuvent facilement être hydrolysés dans le tube digestif. Les produits de biotransformation ainsi libérés sont ensuite réabsorbés par l’intestin et de nouveau métabolisés au niveau du foie. On parle alors de cycle entéro-hépatique, dont la conséquence première est une augmentation du temps de séjour du xénobiotique dans l’organisme.
Bisphénol A
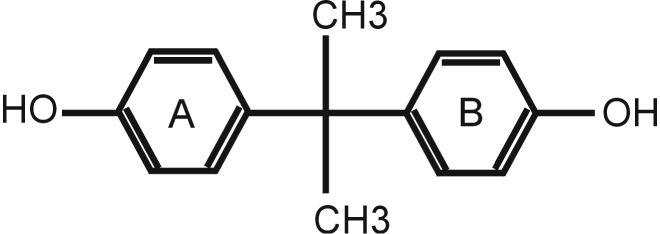
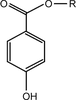
Le 4,4-isopropylidènediphénol, plus couramment appelé bisphénol A (ou BPA), est un composé chimique de synthèse utilisé notamment dans la fabrication industrielle des plastiques de type polycarbonates et de celle des résines époxy.
Les polycarbonates sont présents dans un grand nombre d’objets courants (CD, lunettes, certaines bouteilles plastiques, biberons) ; on retrouve les résines époxy dans les revêtements intérieurs des boîtes de conserve ou les amalgames dentaires. Le bisphénol A entre également dans la composition du PVC et de certains plastifiants ainsi que dans les papiers thermosensibles (délivrés par exemple par les caisses enregistreuses).
Le bisphénol A est actuellement classé en tant que substance reprotoxique de catégorie 3
1
Reprotoxique de catégorie 3 : substance jugée « préoccupante pour la fertilité de l’espèce humaine » en raison « d’effets toxiques possibles » mais non démontrés sur la reproduction
. Les évaluations de risque réalisées à la demande des agences sanitaires internationales (EFSA en Europe) ont conduit à définir une dose journalière tolérable de 50 μg de bisphénol A par kg de poids corporel et par jour, soit 2,5 mg par jour pour un individu de 50 kg. Depuis juillet 2010, la fabrication, l’importation, l’exportation et la mise sur le marché à titre gratuit ou onéreux de biberons produits à base de bisphénol A sont suspendues en France jusqu’à l’adoption par l’Agence française (Anses, Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail) d’un avis motivé autorisant éventuellement à nouveau ces opérations
2
LOI n° 2010-729 du 30 juin 2010
.
Au cours des dernières années, un nombre croissant de travaux menés dans des laboratoires de recherche académiques ont documenté des effets divers du bisphénol A sur la reproduction.
Exposition
Selon les agences sanitaires internationales, la principale source d’exposition de la population générale est alimentaire. Elle résulte du passage du bisphénol A dans l’aliment ou la boisson à partir des polymères plastiques et résines époxy utilisés pour les emballer ou les contenir.
Chez l’adulte, certains auteurs estiment que la consommation de boissons contenues dans des bouteilles en polycarbonates, d’aliments en conserve ou de denrées chauffées au four à micro-ondes dans leur emballage, entraîne une ingestion moyenne de 0,1 μg de bisphénol A par kg de poids corporel et par jour.
Dans son avis de janvier 2010, l’Afssa estime, d’après les données de la littérature, que l’exposition des nourrissons résultant à la fois du biberon et de l’emballage du lait maternisé se situerait entre 0,2 et 2 μg de bisphénol A par kg de poids corporel et par jour. Des données similaires sont présentées dans un récent rapport (Joint FAO/WHO
Expert Meeting to Review Toxicological and Health Aspects of Bisphenol A Summary Report 1-5 novembre 2010)
3
.
La manipulation de papiers thermosensibles (délivrés par les caisses enregistreuses) ou l’inhalation de poussières contaminées par le bisphénol A, pourraient constituer d’autres sources de contamination en particulier pour certaines populations. Par ailleurs, des dérivés du bisphénol A utilisés en tant que composites dentaires induisent des taux salivaires élevés en bisphénol A chez les patients. Ceci suggère que plusieurs voies d’exposition ou encore l’exposition à certains dérivés du bisphénol A doivent être envisagées.
Les mesures de bisphénol A effectuées dans le sang, l’urine, le lait maternel et d’autres tissus indiquent que plus de 90 % des personnes vivant dans les pays occidentaux sont exposées à des niveaux détectables de bisphénol A. Des taux supérieurs à la limite de détection de 0,5 μg/l ont été retrouvés dans le placenta, le liquide amniotique et le fœtus chez les rongeurs et dans l’espèce humaine. Le bisphénol A est donc capable de passer la barrière placentaire et d’atteindre le fœtus.
D’après une étude allemande, les enfants (3-5 ans) constituent le sous-groupe présentant la plus forte imprégnation, avec un taux urinaire moyen de 3,5 μg/l. En France, les taux urinaires dans un échantillon de femmes le jour de l’accouchement en bisphénol A total et libre sont en valeur médiane égales à 2,9 et 0,5 μg/g de créatinine respectivement et le ratio bisphénol A libre/bisphénol A total est de 0,17.
Les niveaux d’exposition chez l’adulte comme chez l’enfant estimés à partir des taux urinaires correspondent à une exposition inférieure à la dose journalière tolérable de 50 μg/kg/j.
Chez l’homme adulte, le bisphénol A absorbé par voie digestive est éliminé rapidement dans l’urine sous forme de BPA-glucuronide. La demi-vie plasmatique est de l’ordre de 4-6 h. Dans le contexte d’une expostion ponctuelle, une grande partie du BPA est éliminée en 24 h. Des valeurs semblables ont été récemment rapportées chez les rongeurs et le singe.
Les extrapolations des données de pharmacocinétique de l’animal à l’homme sont délicates en raison d’importantes différences interespèces dans les processus d’élimination. Des polymorphismes des enzymes de conjugaison chez l’homme pourraient entraîner d’importantes variations individuelles dans la capacité de détoxication. Enfin, des processus de déconjugaison des métabolites (libérant du bisphénol A) pourraient intervenir dans certains organes cibles.
Études épidémiologiques
Peu d’études épidémiologiques ont évalué, à court et à long terme, les effets d’une exposition au bisphénol A sur la fonction de reproduction.
Une étude menée en Chine entre 2004 et 2008 a montré, chez des travailleurs fabriquant des produits à base de bisphénol A, que cette exposition au BPA (environ 50 fois plus élevée qu’en population générale) était associée à une augmentation des troubles déclarés de leur fonction sexuelle (trouble de l’érection, insatisfaction sexuelle). Une seconde publication des mêmes auteurs suggère qu’une association pourrait exister chez des travailleurs non exposés à leur poste de travail entre des niveaux de BPA comparables à ceux de la population générale et l’expression d’une « insatisfaction sexuelle ».
En 2010, deux études ont rapporté chez des hommes consultant pour infertilité ou partenaires de femmes enceintes, des modifications du taux des hormones impliquées dans la reproduction en association avec des niveaux urinaires plus élevés de bisphénol A.
Deux études ont montré une diminution de la concentration spermatique en association avec les taux urinaires de bisphénol A, taux correspondant à ceux rencontrés en population générale. Une autre étude réalisée chez des hommes féconds n’a pas trouvé d’association. Aucune étude longitudinale n’a encore été conduite sur la question, et il n’y a pas non plus de donnée humaine concernant l’impact de l’exposition au bisphénol A durant la vie intra-utérine sur la fonction de reproduction à l’âge adulte. Au total, très peu d’études ont été réalisées et on ne peut pas considérer que le bisphénol A, aux doses auxquelles la population générale est exposée, soit sans danger pour le versant masculin de la fonction de reproduction.
À l’heure actuelle, les études réalisées chez la femme sur le risque de cancer du sein ou d’endométriose reposent toutes sur une approche rétrospective (particulièrement limitée pour un composé non persistant comme le bisphénol A) et des populations cliniques de convenance, sans plan d’échantillonnage précis et ne sont donc pas informatives.
Études chez l’animal
Les deux principales études de toxicité menées chez le rat et la souris selon les lignes directrices de l’OCDE (Organisation de coopération et de développement économique) n’ont pas mis en évidence d’effets significatifs sur la reproduction chez les mâles, les femelles et leur descendance, après une exposition au bisphénol A dès la gestation et sur plusieurs générations, à des doses comparables à une exposition environnementale chez l’homme (entre 3 μg/kg/j et 300 mg/kg/j).
Cependant, au cours des dernières années, plusieurs travaux réalisés dans des laboratoires de recherche académiques sur différentes souches de rats et de souris, et à partir de protocoles expérimentaux diversifiés, ont attiré l’attention sur des effets peu étudiés jusqu’alors et surtout sur des périodes d’exposition particulières. Ces études mettent l’accent sur les conséquences d’une exposition au bisphénol A in utero et pendant la lactation, susceptible d’interférer directement avec le développement de l’embryon, puis du nouveau-né et d’engendrer des effets à long terme sur la reproduction du jeune et de l’adulte (mâle ou femelle).
Chez le rat et la souris mâle, après exposition pendant la gestation et la période postnatale, plusieurs études révèlent des effets du bisphénol A sur l’appareil génital (hypotrophie testiculaire, hypertrophie prostatique, distance anogénitale plus courte, retard à la séparation du prépuce...), sur la production de spermatozoïdes, sur le taux des hormones mâles et sur la fertilité (diminution de la taille des portées...) avec des doses de l’ordre de quelques μg/kg/j. Ces résultats n’ont pas été retrouvés dans toutes les études.
Chez le rat et la souris femelle après exposition pendant la gestation et la période postnatale, le bisphénol A peut induire une puberté précoce, des altérations de l’utérus, du vagin, de l’ovaire, de l’endomètre (effets apparaissant pour des doses variant de 0,2 à 500 μg/kg/j selon les espèces et lignées utilisées).
Par ailleurs, après une exposition in utero, des anomalies du comportement maternel et du comportement sexuel sont observées dans les deux sexes.
La transmission à la descendance de certains de ces effets chez les rongeurs exposés suggère que le bisphénol A peut induire des altérations de l’information épigénétique et perturber l’expression de gènes. Ces études posent le problème de la transmission des effets délétères aux générations suivantes. Ceci justifie que les études longitudinales soient poursuivies sur plusieurs générations.
Enfin, les études réalisées dans plusieurs lignées d’une même espèce de rongeurs, montrent des variabilités intra espèce (et inter individu) de réponse au bisphénol A. Ces variabilités sont le reflet du polymorphisme génétique et pourraient également être attribuées à des expositions antérieures subies au cours des différentes phases de la vie. Le fait que les altérations ne soient pas retrouvées dans toutes les études et la mise en évidence de sensibilité variable de certaines lignées ne peut pas constituer des arguments en faveur de l’absence d’effets ; ceci doit inciter à comprendre comment des facteurs génétiques et environnementaux peuvent moduler la réponse au bisphénol A.
Chez les vertébrés aquatiques, le BPA peut modifier l’action des hormones sexuelles et provoquer des inversions partielles du sexe ainsi que des anomalies du développement embryonnaire, à des doses compatibles avec les quantités retrouvées dans certaines rivières.
Organes et tissus cibles
L’exposition au bisphénol A pendant la phase de constitution des organes au cours de la gestation semble particulièrement critique.
Pour l’appareil reproducteur femelle, l’exposition au BPA pendant la phase de constitution du tissu mammaire in utero peut modifier le développement de cet organe (à des doses de 0,25 μg/kg/j), augmenter sa sensibilité aux œstro gènes durant la puberté et conduire à l’apparition de lésions précancéreuses (à des doses de 25 ou 250 μg/kg/j).
De même, la période fœtale ou néonatale semble constituer une période critique au cours de laquelle une exposition au bisphénol A pourrait altérer le développement de la prostate et favoriser l’apparition de lésions précancéreuses (avec des doses de 10 à 20 μg/kg/j).
La survenue de cancers hormonodépendants (sein ou prostate), de type carcinome semble être favorisée par une altération, due au BPA, dans le développement de l’organe.
Le risque tumoral serait ensuite accru par une exposition à l’âge adulte aux hormones ou à des cancérogènes environnementaux.
Un lien entre une exposition au bisphénol A in utero et des lésions de l’endomètre (de type endométriose) est suspecté.
Phtalates
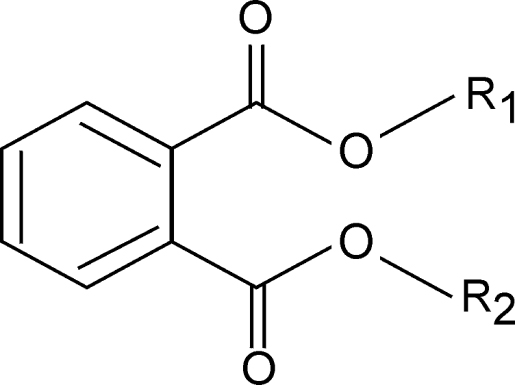
Les phtalates sont le produit d’estérification d’un acide phtalique avec un ou plusieurs alcools. On distingue des esters phtaliques dont les deux fonctions acides sont estérifiées par le même alcool (DEHP, DBP), ou par des alcools différents (BBP) ou encore par des alcools de type oxo (DINP, DIDP).
Parmi les phtalates les plus fréquemment utilisés, outre le DEHP, mentionnons le BBP, le DBP, le DEP et le DINP.
Les phtalates sont retrouvés dans plusieurs produits utilisés couramment tels les adhésifs, les revêtements de sol en vinyle, les huiles lubrifiantes, les condensateurs électriques, les détergents, les solvants, les produits pharmaceutiques, les fils et les câbles électriques et les produits cosmétiques (parfums, déodorants, lotions après rasage, shampooings, aérosols pour cheveux, vernis à ongles...). La particularité des phtalates utilisés en plasturgie tient au fait qu’ils ne sont pas liés de manière covalente aux polymères auxquels ils confèrent leur souplesse. Ils peuvent donc facilement migrer dans les matériaux d’emballages et être relargués dans le milieu environnant, en particulier lorsque les plastiques qui en contiennent sont soumis à des températures élevées.
Des interdictions et restriction d’usage ont été promulguées par la Commission européenne : dans les préparations à destination du grand public (peintures et colles...), tous les phtalates classés CMR1 et 2 sont interdits ; concernant les articles, interdiction du DEHP, DBP et BBP dans la production des jouets et les articles pour enfants ; interdiction du DINP, DIDP et DNOP (di-n-octyl phtalate) pour les jouets des enfants de moins de trois ans. Les phtalates tels que le DBP, DEHP, BBP ne sont pas autorisés dans les produits cosmétiques ; le DEHP est également interdit dans les matériaux de contact alimentaire. L’usage du DEHP dans les dispositifs médicaux est restreint si les nouveau-nés, les femmes enceintes et allaitant, doivent y être exposés.
Les évaluations de risque effectuées par les autorités sanitaires, l’EFSA en Europe, sur le DEHP, le DBP, le DIDP, le BBP et le DINP ont abouti à des doses journalières tolérables (DJT) de respectivement 50, 10, 150, 500 et 150 μg par kg de poids corporel et par jour.
Exposition
L’exposition humaine à certains phtalates est importante et croît régulièrement en raison de la très large utilisation de cette famille de composés et de l’augmentation des niveaux de production au cours des trente dernières années.
Cette exposition peut provenir du contact direct avec l’air, l’eau ou encore la nourriture et résulte à la fois de l’inhalation, de l’ingestion ou encore de l’absorption percutanée de ces produits. L’ingestion d’aliments ayant été en contact avec des emballages contenant des phtalates demeure la principale source d’exposition pour la population générale adulte. L’alimentation est en particulier la principale source d’exposition pour le DEHP, DBP et DIBP (diisobutyl-phtalate). Chez les enfants, l’ingestion via les contacts mains-bouche pourrait être également importante.
L’exposition chez l’adulte au DEHP est estimée en moyenne à environ 2 μg/kg de poids corporel par jour d’après les données de concentrations urinaires en DEHP ou de ses métabolites dans les populations occidentales. Elle est légèrement plus faible pour les autres phtalates. On observe peu de différences entre les hommes et les femmes.
Comparés (dans le même temps et dans les mêmes études) aux adultes, tous les enfants (0-3 ans) présentent des concentrations urinaires 3 à 5 fois plus élevées. D’après des données allemandes, 1,5 % des enfants en Allemagne présentent une exposition au DEHP supérieure au niveau d’exposition pour lequel l’absence d’effet adverse n’est pas certaine. En France, dans un échantillon de femmes le jour de l’accouchement, les taux urinaires en métabolites sont en valeur médiane égales à 42 μg/l et 28 μg/l respectivement pour le 5OH-MEHP et le 5oxo-MEHP.
Sur la base des teneurs en DEHP dans les aliments pour bébés, des auteurs ont estimé que l’exposition par la voie alimentaire des nourrissons de moins de 6 mois était de près de 10 μg/kg pc/j et de près de 20 μg/kg pc/j chez les enfants de plus de 6 mois. Depuis les interdictions et restriction d’usage, d’autres phtalates (DINP) sont plus souvent retrouvés en particulier chez les enfants.
Les dispositifs médicaux (poches de sang, tubulures...) représentent pour certains sous-groupes de la population une source non négligeable d’exposition aux phtalates, en particulier au DEHP. L’exposition via les dispositifs médicaux touche principalement les hémodialysés, les donneurs et receveurs de plaquettes et les enfants prématurés. L’European Chemicals Bureau (ECB) estimait en 2008 que l’exposition pouvait atteindre 3 000 μg/kg pc/j, chez les hémodialysés adultes et 1 700 μg/kg pc/j chez les nouveau-nés transfusés.
Selon les composés, la demi-vie plasmatique chez l’Homme est de 8 à 48 heures. Elle est de 18 heures pour le DEHP. Si on n’observe pas de bioaccumulation, il est important de signaler que comme pour le BPA, l’exposition est continue du fait de la diversité des sources de contamination (alimentaire, environnement, cosmétiques...). Les études réalisées chez l’homme ou la femme montrent que certains phtalates ou leurs métabolites sont retrouvés dans les urines, le plasma sanguin, le plasma séminal, le lait maternel, le liquide amniotique et le sang du cordon.
Le métabolisme des phtalates conduit à la production de métabolites non oxydés et oxydés. Des études récentes semblent indiquer que chez l’homme, les principaux métabolites dans les urines sont les métabolites oxydés. La mesure des métabolites oxydés dans les liquides biologiques permet d’exclure les contaminations liées au matériel utilisé lors du dosage.
La concentration maximum sanguine en MEHP (métabolite du DEHP) est 7,5 fois plus faible chez le primate non humain (singe) que chez le rat. Chez l’homme et le singe, le MEHP est présent dans le sang et l’urine essentiellement comme glucuro-conjugué. Cependant, des métabolites de DEHP, avec des chaînes ester carboxylées, sont retrouvés sous formes conjuguées et libres dans les échantillons urinaires humains. Différents tissus peuvent être la cible de ces métabolites (testicule, ovaire...). Les différences dans l’absorption, la distribution, le métabolisme et l’excrétion entre différentes espèces (rongeurs, singes et humains) peuvent expliquer des différences de sensibilité aux effets des phtalates.
Études épidémiologiques
Quatre études se sont intéressées aux anomalies du nouveau-né et de l’enfant en recherchant une exposition pendant la gestation et au cours des premiers mois de vie.
Pour la première fois en 2008, une étude a montré une relation entre les taux les plus élevés de métabolites (MEP, MBP, MEHP) ainsi que des métabolites oxydés (MEHHP, MEOHP) chez les mères à 29 semaines de gestation (en moyenne) et une « distance anogénitale » (mesurée entre le centre de l’anus et la base du pénis) plus courte chez les nourrissons mâles. Concernant les anomalies de l’appareil génital du petit garçon (hypospadias, cryptorchidie), très peu d’etudes avec un nombre suffisant de cas ont été réalisées et ne permettent pas de conclure à l’existence d’un rôle des phtalates sur la survenue de ces troubles.
Chez les fillettes, un effet sur la puberté précoce a été analysé et les résultats des études ne sont pas concluants.
Chez l’homme adulte, plusieurs études transversales retrouvent un lien entre les concentrations de métabolites urinaires des phtalates et une altération des paramètres du sperme parmi lesquels la concentration et la morphologie des spermatozoïdes ainsi qu’une augmentation de la fragmentation de l’ADN du gamète mâle. Deux études ne mettent pas en évidence de relation entre les concentrations urinaires en phtalates et les paramètres du sperme. Par ailleurs, une étude de type exposé/non exposé met en évidence une relation entre les concentrations plus élevées de métabolites urinaires en phtalates et les concentrations basses de testostérone.
Chez les femmes, peu d’études ont évalué le rôle possible de l’exposition aux phtalates sur la santé reproductive. Seul le risque d’endométriose a été spécifiquement évalué et les preuves apportées par ces quelques études de l’existence possible d’un lien entre phtalates et endométriose sont insuffisantes. Les effets de l’exposition aux phtalates sur la fonction ovulatoire et certains niveaux hormonaux (œstradiol, progestérone, LH, FSH) suggérés dans les études animales ne sont pas relatés chez la femme.
L’évaluation des effets des phtalates est rendue complexe du fait de la diversité au niveau des études, des populations étudiées, de la méthodologie des dosages et des limites de détection ainsi que des paramètres phénotypiques pris en compte.
Études chez l’animal mâle
Les études de références ayant servi à la détermination de la DJT pour le DEHP et le DBP ont été conduites dans trois lignées de rat (Sprague-Dawley, Wistar, Fisher). Les expositions ont été effectuées pendant la gestation et/ou la période néonatale ou encore sur plusieurs générations. Une atteinte testiculaire et des pathologies des organes sexuels mâles accessoires tels que vésicules séminales, prostate, épididyme ont été rapportées à différents stades du développement. De nombreuses études rapportent une baisse du poids de la prostate, une diminution de la distance anogénitale, une augmentation des hypospadias ou cryptorchidies, une rétention d’aréoles mammaires ou de mamelons, une diminution de la longueur du pénis... Les effets sont signalés aux doses de DEHP et de DBP de 150 et 500 mg/kg/j. Les mêmes effets peuvent être obtenus à des doses plus faibles (100 mg) en présence des deux phtalates. Par ailleurs, il semble que certaines lignées de rat puissent être sensibles à des doses de 10 à 100 mg/kg/j.
Des modifications des caractéristiques spermatiques (taux de spermatozoïdes, morphologie) et des altérations des taux d’hormones (testostérone, LH...) sont observées après exposition au DEHP et au DPB (doses supérieures à 100 mg/kg/j) chez le rat ou le lapin. Le DBP réduit la production de testostérone fœtale, mais cet effet disparaît rapidement après l’arrêt du gavage. La plupart des études ayant suivi la production de testostérone pendant la vie postnatale montre qu’à l’âge adulte les taux plasmatiques de testostérone des mâles traités in utero sont comparables à ceux d’animaux non exposés. Une baisse de la fertilité n’est rapportée que pour des doses élevées (doses supérieures à 500mg/kg/j).
Chez le singe mâle (marmouset, cynomolgus), ces effets sont retrouvés après exposition à ces deux phtalates (aux mêmes doses) mais de manière moins évidente que chez le rat.
Organes et tissus cibles chez le mâle
La très grande majorité des études chez le rat, réalisées par gavage durant la gestation, rapportent des effets sur les trois principaux types cellulaires du testicule fœtal : cellules de Leydig, cellules de Sertoli et cellules germinales. Les travaux signalent de manière cohérente une agrégation des cellules de Leydig et la diminution de la production de testostérone et d’INSL3 de ces cellules pendant la vie fœtale ce qui conduit à inhiber la masculinisation ou le développement des organes reproducteurs androgéno-dépendants. Cet effet n’est pas observé chez la souris. Concernant les cellules de Sertoli, leur nombre et leur prolifération peuvent être inhibés transitoirement lors d’une exposition in utero chez le rat sans que l’on sache s’il s’agit d’un effet direct ou indirect via l’inhibition de la synthèse d’androgène.
Concernant les cellules germinales fœtales, on observe l’apparition de cellules multinucléées chez le rat et la souris après une exposition in utero avec le DEHP et le DPB. Le DEHP augmente également l’apoptose de ces cellules. Ce dernier effet est décrit chez le rat et également retrouvé dans les cultures organotypiques de testicule fœtal humain et murin.
Chez le singe (marmouset) comme chez le rat, un retard de différenciation des cellules germinales fœtales a été rapporté mais aucun effet notable sur la prolifération des cellules de Sertoli n’est décrit.
Études chez l’animal femelle
Peu d’études se sont intéressées aux effets des phtalates sur l’appareil reproducteur des animaux femelles.
Chez le rat femelle, après exposition in utero et néonatale au DEHP, on observe une puberté avancée ou retardée selon le moment d’administration (pour des doses de 15 ou 150 mg/kg/j) et des modifications des taux d’hormones (œstradiol, progestérone). Une réduction de la fertilité est rapportée avec le DBP après une exposition à partir du sevrage (500 mg/kg/j).
Chez les femelles marmouset exposées au DEHP juste après le sevrage (3 mois) et jusqu’à la maturité sexuelle (18 mois), les analyses morphologiques du tractus génital femelle révèlent une augmentation du poids des ovaires et de l’utérus aux doses élevées ainsi qu’une augmentation des niveaux d’œstradiol circulant. En revanche, aucun changement significatif n’est observé en histologie dans les utérus et ovaires, si ce n’est un nombre un peu plus élevé de corps jaunes.
L’augmentation des niveaux d’œstradiol observée chez le rat comme chez le marmouset pourrait être à l’origine de l’atrophie folliculaire décrite dans l’ovaire.
Organes et tissus cibles chez la femelle
Les données chez l’animal femelle indiquent que l’ovaire est un organe cible de l’action des phtalates (DEHP, DBP). Les études in vitro montrent clairement une diminution de la production d’œstradiol par les cellules folliculaires ovariennes suite à l’exposition au DEHP et son principal métabolite le MEHP. L’aromatase (enzyme qui convertit la testostérone en œstradiol) pourrait être une cible directe du DEHP.
D’autres organes que l’ovaire sont également des cibles potentielles comme l’hypophyse ou l’hypothalamus au niveau cérébral ou encore l’utérus et la glande mammaire comme en témoignent quelques études in vitro.
Études chez les poissons
Chez le poisson zèbre (zebrafish) mâle, une exposition au DEHP induit une réduction du succès de fécondation d’œufs pondus par des femelles non traitées et des anomalies de la spermatogénèse (suggérant que la progression de la méiose pourrait être perturbée). D’autres effets sont fréquemment observés après un traitement au BBP : une altération de la qualité (mobilité, forme) des spermatozoïdes, une faible quantité d’ovotestis (gonade comprenant à la fois des aspects de testicule et d’ovaire), des anomalies histologiques de la gonade mâle, des anomalies de la différenciation des testicules.
Chez le zebrafish femelle, les effets observés après traitement par le DEHP sont plus évidents que ceux décrits chez le mâle : diminution forte du nombre d’ovocytes matures, altération de la croissance des ovocytes, de leur maturation, de l’ovulation elle-même et plus généralement de la capacité à produire des embryons.
Composés polybromés (retardateurs de flamme)
Il existe aujourd’hui de nombreux types de retardateurs de flamme, agissant soit par voie chimique soit par voie physique. Ceux-ci sont incorporés dans les produits et matériaux concernés (textiles, rideaux, vêtements, sièges, plastiques, mousses, capitonnages, résines, circuits imprimés, câbles, téléviseurs, ordinateurs...) à des teneurs allant en général de 5 à 20 %.
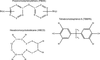
Les retardateurs de flamme chimiques appartiennent à différentes familles dont les plus utilisées sont les composés polybromés (RFB) tels que les polybromodiphényléthers (PBDE), le 1,2,5,6,9,10 hexabromocyclododécane (HBCD) et le tétrabromobisphénol A (TBBPA). Ils représentent 30 % des retardateurs de flamme au niveau européen.
Du point de vue de leur structure chimique, les PBDE sont des éthers aromatiques bicycliques. Leur classification s’appuie sur le nombre et la position des atomes de brome dans le cycle. Pour les différencier, la nomenclature usuelle consiste à les désigner par un nombre donnant des informations sur le degré de bromation (nombre d’atomes de brome dans la molécule) et sur la position des atomes de brome sur les cycles benzéniques.
Depuis août 2004, la règlementation européenne interdit les deux mélanges « techniques » de PBDE utilisés industriellement, l’octa-BDE et le penta-BDE, mais autorise toujours le deca-BDE. Ce dernier est essentiellement constitué de BDE 209 ou décabromodiphényléther, celui-ci pouvant se décomposer en congénères plus faiblement bromés par dégradation physique (notamment sous l’influence des rayonnements UV).
Le TBBPA a une structure chimique proche de celle du BPA, avec deux cycles aromatiques liés par un pont carbone. La présence de deux groupements hydroxyles rend ce composé plus polaire que les autres représentants de la famille des retardateurs de flamme bromés, et le distingue donc sur le plan des propriétés physico-chimiques. Le TBBPA est en particulier moins bioaccumulable dans les tissus gras et plus sujet aux réactions de métabolisme de phase II (conjugaison) que les PBDE.
L’HBCD occupe la troisième place au classement des retardateurs de flamme bromés les plus utilisés. L’HBCD « technique » est un mélange principalement constitué de trois diastéréoisomères (composés identiques sauf sur le plan de la disposition spatiale de leurs atomes). C’est l’isomère γ que l’on retrouve de façon prédominante dans les échantillons biologiques d’origine animale.
Les retardateurs de flamme polybromés se caractérisent globalement par des propriétés physico-chimiques qui les rendent lipophiles et bioaccumulables, au même titre que certains autres polluants organiques persistants (POP) halogénés (dioxines, polychlorobisphényls).
Bien que la production de certains RFB (notamment mélanges Penta-BDE et Octa-BDE) ait été stoppée dans certains pays dont l’Europe, leur présence s’est accrue ces dernières décennies dans l’environnement, dans la faune, mais également chez l’Homme.
Il n’y a pas à l’heure actuelle de DJT définie par les Agences sanitaires. Les évaluations sont en cours. |$$|AGA titre d’indication, les valeurs de référence émises par l’agence américaine (US-EPA) sont de 0,1 μg/kg pc/j pour le BDE 99 et de 7 μg/kg pc/j pour le BDE 209.
Exposition
En raison du caractère lipophile de ces polluants, les produits alimentaires riches en lipides (viande, poisson, lait) contribuent de façon majeure à l’exposition de l’Homme aux retardateurs de flamme bromés. Toutefois, les habitudes alimentaires très diverses d’un continent à l’autre expliquent une disparité observée parmi les principaux contributeurs à l’exposition.
Les voies d’exposition aérienne (par l’ingestion de poussières) et directe (par contact avec certains matériaux plastiques) représentent d’autres voies d’exposition aux congénères les plus hautement bromés comme le BDE 209, en particulier chez les jeunes enfants.
En population générale, les niveaux d’exposition aux PBDE estimés sont de l’ordre de 1 ng/kg de poids corporel/jour.
La présence de plusieurs congénères dans certains fluides et tissus biologiques humains est avérée. Dans le sérum ou le lait maternel, les teneurs observées sont de l’ordre de quelques ng/g de lipide.
Depuis le début des années 2000, une tendance à une diminution des niveaux d’imprégnation a été rapportée pour les principaux congénères de type PBDE, correspondant à un arrêt de la production et de l’utilisation des deux mélanges industriels Penta- et Octa-BDE. En revanche, cette diminution ne semble pas concerner les autres composés toujours utilisés, en particulier le BDE 209, l’HBCD ou encore le TBBPA, mais pour lesquels les données disponibles sont limitées. D’après les rapports d’évaluations disponibles, les niveaux d’exposition à l’HBCD sont de 2 à 10 ng/kg/jour pour l’exposition provenant des poussières de textiles et de 20 ng/kg/jour via l’alimentation. Pour le TBBPA, le niveau d’exposition est de 80 ng/kg/jour via l’environnement.
Les études conduites chez le rat indiquent qu’après administration orale le BDE 209 est éliminé principalement dans les fécès alors que l’élimination urinaire est négligeable. La demi-vie du BDE 209 est estimée à 2 jours chez le rat et 14 jours chez l’homme. Globalement, les demi-vies des PBDE varient de quelques semaines (BDE 209) à quelques années (BDE 47). Pour les différents congénères, des métabolites hydroxylés se forment et des conjugués sulfates et glucuronides sont éliminés dans l’urine.
Études épidémiologiques
Les seuls composés bromés analysés sont les PBDE. L’étude de la cohorte mère-enfant finlandaise et danoise rapporte une relation entre cryptorchidie observée chez les nouveau-nés et 7 composés de la famille des PBDE mesurés dans le lait maternel recueilli entre 1 et 3 mois. Les auteurs indiquent également une augmentation des taux de l’hormone luthéinisante (LH). Dans une autre cohorte mère-enfant en Californie, une augmentation du délai pour concevoir a été notée chez certaines femmes en relation avec les taux sanguins plus élevés de PBDE. Cependant, ces études sont encore trop peu nombreuses pour constituer une preuve suffisante d’un rôle des PBDE sur la santé reproductive de l’homme et de la femme. Aucune étude n’a pris en considération les expositions à d’autres retardateurs de flamme polybromés (HBCD et TBBPA).
Études chez l’animal
Les études animales disponibles sont très peu nombreuses et la plupart proviennent du même laboratoire.
Chez le rat mâle, avec les composés BDE 99 et 209 (500 et 1 500 mg/kg/jour) après exposition in utero, des anomalies ont été observées : diminution de la distance anogénitale, altération de la production spermatique et de certains paramètres fonctionnels spermatiques, diminution des taux de testostérone.
Chez le rat femelle, une diminution du nombre de follicules ovariens a été rapportée avec ces mêmes composés. Les doses utilisées (1 à 10 mg/kg en sous-cutané) sont cependant très supérieures aux expositions estimées chez l’homme.
Organes et tissus cibles
Chez la femelle, l’ovaire est un organe cible. Sur une culture de cellules isolées de truie (ou en co-culture), en présence d’un mélange de PBDE, il est montré, une modification stable après 48 h des taux de testostérone et progestérone susceptibles d’engendrer une lutéïnisation prématurée des follicules pré-ovulatoires. Après une exposition chronique des rates à HBCD (140 mg/kg/jour), une étude rapporte, à l’examen histologique des ovaires, une diminution d’un tiers des follicules primordiaux constituant la réserve des follicules de l’ovaire. Une diminution du nombre de follicules primordiaux est considérée comme un biomarqueur des effets adverses sur la reproduction femelle, car non réversible. Cependant, ces animaux femelles ont un nombre normal d’implantations au cours de leur première gestation. Une étude sur une période plus longue de la vie de l’animal permettrait de voir si la diminution de la réserve folliculaire entraîne une insuffisance ovarienne précoce.
Chez le mâle, l’organe cible est le testicule. Chez la souris, l’exposition au BDE 209 (500 et 1 500 mg/kg/jour) entraîne une modification du potentiel membranaire mitochondrial des spermatozoïdes épididymaires et de l’amplitude de déplacement latéral de la tête suggérant un stress oxydatif. Des études in vitro avec TBBPA sur les cellules de Sertoli de souris ont montré une mort cellulaire en partie par apoptose, impliquant une dépolarisation mitochondriale Ca2+ dépendante. Ces effets se produisent à des concentrations environ 100 fois plus élevées que les plus hauts niveaux de TBBPA mesurés chez l’homme.
Composés perfluorés
Le terme « composés perfluorés » (PFC) se réfère à une vaste famille de molécules chimiques comprenant des oligomères et des polymères. Il s’agit de composés tensio-actifs, neutres ou anioniques, présentant une grande stabilité sur les plans thermique, chimique et biologique.
Les composés perfluorés ont été ou sont utilisés dans de nombreuse applications industrielles, notamment pour les traitements anti-taches et imperméabilisants de textiles (vêtements, tissus, tapis, moquettes...), les enduits résistants aux matières grasses, les emballages en papier et/ou carton autorisés pour le contact alimentaire, les revêtements anti-adhésifs, les mousses anti-incendie, les tensioactifs utilisés dans l’exploitation minière et les puits de pétrole, les cires à parquet, ou encore certaines formulations d’insecticides. En conséquence, les consommateurs des pays industrialisés sont aujourd’hui en contact avec ces composés dans leur vie quotidienne, à travers un grand nombre de produits manufacturés. Comme beaucoup d’autres polluants chimiques d’origine anthropique, les composés perfluorés peuvent être relargués dans l’environnement à chaque étape de leur cycle de vie, puis retrouvés dans la chaîne alimentaire et in fine dans les organismes vivants.
Un sous-groupe important au sein de cette famille de polluants chimiques émergents depuis quelques années, est celui des tensio-actifs organiques tels que le sulfonate de perfluorooctane (PFOS) et l’acide perfluorooctanoïque (PFOA), qui présentent une chaîne carbonée à huit atomes de carbone. Ces deux substances étant les principaux produits de dégradation finaux de nombreux composés perfluorés, elles sont retrouvées de façon généralement prépondérante dans les matrices environnementales ou biologiques, et sont le plus souvent les seules étudiées.
Par leur structure chimique comportant d’une part une chaîne carbonée polyfluorée apolaire et d’autre part un groupement fortement polaire, les PFC se caractérisent par des propriétés à la fois hydrophobes et lipophobes, et de ce fait ne s’accumulent pas dans les tissus adipeux. La demi-vie du PFOS et du PFOA est toutefois de plusieurs années chez l’Homme. Le PFOS a été récemment inclus dans la liste des polluants persistants de la convention de Stockholm (UNEP
United Nations Environment Programme4
). Depuis 2006, le PFOS est interdit dans certains usages par la réglementation européenne.
Dans son rapport scientifique rendu public en 2008, le panel Contam de l’EFSA a établi une valeur de dose journalière tolérable pour le PFOS égale à 0,15 μg/kg/jour et pour le PFOA de 1,5 μg/kg/jour.
Exposition
La source alimentaire apparaît comme la voie d’exposition principale aux composés perfluorés, en particulier pour l’adulte. D’autres sources notamment via le contact direct avec certains revêtements de type tapis ou moquette, représentent toutefois une voie non négligeable d’exposition pour les jeunes enfants. De façon générale, les valeurs estimées d’exposition aux composés perfluorés varient de quelques ng à quelques dizaines de ng/kg/jour. Elles apparaissent en deçà des limites tolérées pour l’adulte en population générale mais proches des limites pour des sous-populations particulièrement exposées. Pour les gros consommateurs de poisson, l’apport alimentaire en PFOS via le poisson a été estimé à 0,2 μg/kg/jour.
La présence de plusieurs représentants de cette classe de composés dans des fluides et tissus biologiques humains est avérée. Dans le sérum, les teneurs observées sont de l’ordre de quelques ng à quelques dizaines de ng/ml. Le PFOS et le PFOA apparaissent comme étant deux principaux biomarqueurs d’exposition aux composés perfluorés.
Une tendance à la diminution des niveaux d’imprégnation en population générale est observée aux États-Unis depuis 2002, date correspondant à l’arrêt de la production d’une des principales sociétés productrices. En revanche, l’absence de données concernant les autres pays ne permet pas de généraliser cette observation.
Plusieurs études ont fait état d’un transfert mère-fœtus via le sang du cordon. Toutefois, les niveaux de concentration rapportés dans le sang du cordon sont systématiquement inférieurs aux teneurs observées dans le sang maternel (d’un facteur 1,5 à 3,5). L’existence d’une exposition du nourisson allaité via le lait maternel est de même démontrée, même si cette voie de transfert de la mère à l’enfant apparaît plus limitée que pour d’autres classes de polluants organiques halogénés tels que les dioxines, les PCB, ou les retardateurs de flamme bromés.
Les demi-vies plasmatiques estimées pour le PFOS et le PFOA sont de l’ordre de quelques heures chez le rongeur, quelques jours chez le primate et quelques années chez l’homme. Parmi les polluants bioaccumulables, ils sont moins persistants que d’autres substances plus lipophiles tels les dioxines ou les PCB. Une élimination plus rapide chez la femelle a été montrée chez l’animal, cette différence étant toutefois moins significative dans l’espèce humaine. Par ailleurs, on observe une importante variabilité inter et intra-espèce des paramètres pharmacocinétiques selon les composés et en particulier selon la longueur de la chaîne carbonée, les composés à plus longue chaîne présentant un caractère plus persistant.
Études épidémiologiques
Le nombre d’études concernant les effets potentiels du PFOA et du PFOS sur la fonction de reproduction humaine est très limité. Une étude réalisée sur une cohorte de naissance danoise rapporte une association entre les taux plasmatiques de PFOS et PFOA et la fertilité des couples (augmentation du risque d’infécondité involontaire). Une autre étude danoise suggère un lien entre les taux cumulés de PFOS et PFOA et une modification de la morphologie spermatique.
Études chez l’animal
Des études menées sur deux générations indiquent que, même à de très fortes doses, le PFOA ne modifie pas la fertilité des rats mâles. Il s’agit de doses 30 000 fois plus fortes que les concentrations mesurées chez l’être humain. Il n’a pas été rapporté d’effet néfaste du PFOA ou PFOS sur la production spermatique des rongeurs. Il faut souligner les différences interespèces pour les durées de demi-vie et le métabolisme en particulier entre l’homme et les rongeurs.
Chez le rat, deux études concernant le PFDoA (acide perfluorododécanoïque) administré par gavage indiquent une diminution de la production de testostérone (avec réduction de l’expression des gènes codant pour les enzymes de la biosynthèse de la testostérone) dès la dose de 0,2 mg/kg/j. Plus de 40 protéines (impliquées dans le stress oxydatif et la chaîne respiratoire mitochondriale) sont modifiées dans les testicules de rats traités de manière chronique.
Les composés perfluorés (PFOA et PFOS) ne semblent pas modifier la fertilité femelle ou la morphologie ovarienne mais peuvent altérer la stéroïdogenèse ovarienne. Chez la souris, on observe un retard de la maturité sexuelle des femelles traitées (10 mg/kg/jour) in utero : l’âge de l’ouverture vaginale et celui du premier œstrus est retardé. Un effet sur la régularité des cycles oestriens est rapporté avec le PFOS (1 à 10 mg/kg/jour) administré à des rates adultes. Ces effets apparaîssent variables en fonction de l’espèce (rat ou souris).
Organes et tissus cibles
Dans le testicule de rat adulte après traitement par le PFDoA, la diminution de la production de testostérone est associée à une augmentation de l’apoptose dans les différents types de cellules.
Chez la souris, plusieurs travaux montrent des effets du PFOA sur le développement ou la différenciation de la glande mammaire (augmentation du nombre de bourgeons terminaux). Ceci serait en relation avec l’augmentation de la synthèse de la progestérone ovarienne sous l’effet du PFOA. Des différences selon les lignées de souris sont rapportées.
D’une façon générale, les effets des composés perfluorés dépendent de leur structure chimique et varient selon l’espèce (rat, souris) ou la lignée.
Chez le vairon mâle adulte, une augmentation de la vitellogénine a été observée après traitement au PFOA. Des signes d’ovotestis ont également été observés, ce qui suggère clairement une activité œstrogénique. Chez les femelles traitées par du PFOS, une étude décrit une diminution de la croissance de la gonade et une altération du développement des embryons pondus par ces femelles. Par ailleurs, le PFOS induit des anomalies histologiques des ovaires chez les femelles traitées.
Parabènes
Les parabènes sont des esters de l’acide 4-hydroxybenzoïque, présentant un cycle benzénique substitué en para par un groupement ester avec des chaînes alkyles de taille variable. Les structures les plus courantes sont : méthyl parabène, éthyl parabène, propyl parabène, butyl parabène, benzyl parabène.
En raison de leurs propriétés antibactériennes et antifongiques, les parabènes sont très largement utilisés comme conservateurs dans les cosmétiques, les médicaments et les aliments. Leur première utilisation en tant que conservateur remonte à 1920.
Les composés de la famille des parabènes autorisés comme additifs alimentaires sont : le méthyl parabène (E218) et son sel de sodium (E219) et l’éthyl parabène (E214) et son sel de sodium (E215). Leur emploi en tant qu’additifs alimentaires est régi par la directive européenne 95/2/CE du 20 février 1995.
Les parabènes les plus utilisés en cosmétique sont le méthyl, l’éthyl, le propyl, le butyl et l’isobutyl parabène. La directive 76/768/CEE régit l’utilisation des parabènes dans les produits cosmétiques et fixe leur emploi à 0,4 % (en acide) pour un ester et 0,8 % (en acide) pour les mélanges d’esters. Dans les médicaments, c’est le propyl parabène qui est principalement utilisé.
Les autorités sanitaires européennes (EFSA) ont défini une dose journalière tolérable pouvant aller jusqu’à 10 000 μg/kg/jour pour le mélange méthyl et éthyl parabènes.
Exposition
Du fait de leur emploi comme conservateurs dans plus de 80 % des produits cosmétiques (shampooings, crèmes hydratantes, mousses à raser...), dans de nombreuses spécialités pharmaceutiques, et comme additif alimentaire, l’être humain est régulièrement exposé aux parabènes.
L’exposition aux méthyl, éthyl, propyl, et butyl parabènes a été évaluée dans un échantillon représentatif de la population générale des États-Unis (personnes âgées de 6 ans et plus) entre 2005 et 2006. Le méthyl et le propyl parabène ont été détectés dans plus de 90 % des échantillons, l’éthyl et le butyl dans un peu moins de 50 %. La concentration médiane du méthyl parabènes était de 63,5 μg/l d’urine et celle du propyl parabène de 8,7 μg/l. Les adolescentes et les femmes adultes avaient des concentrations significativement plus fortes que les adolescents et hommes adultes.
Une estimation à partir des différentes sources possibles d’exposition indique un taux de 1 300 μg/kg/jour pour la population américaine.
La confirmation de la capacité des parabènes d’être absorbés systématiquement à partir d’applications topiques a été démontrée chez l’homme. Le n-butyl parabène est détecté dans le sérum en 1 h et dans l’urine avec un pic à 8-12 h, dont la majorité conjuguée sous forme de glucuronide.
Études épidémiologiques
En ce qui concerne le butyl parabène, une étude menée chez une centaine d’hommes consultant pour infertilité a montré que sa présence dans le sérum est significativement associée aux altérations de l’ADN des spermatozoïdes. Une relation dose dépendante est observée avec l’augmentation de la fragmentation de l’ADN. Cependant, les données épidémiologiques sont insuffisantes pour confirmer l’impact des parabènes sur la qualité spermatique.
En 2004, la mise en évidence des cinq parabènes les plus utilisés (méthyl, éthyl, n-propyl, n-butyl et isobutyl parabènes) dans la graisse de carcinomes mammaires a déclenché un débat scientifique et sociétal concernant l’effet possible de certains composés de la famille des parabènes utilisés en application cutanée locale sous les aisselles (notamment du fait de leur présence dans les déodorants) sur le risque de survenue de cancer du sein. Cette étude a été critiquée du fait qu’elle comportait peu d’échantillons et pas de témoins.
Par ailleurs, deux études épidémiologiques (2002, 2003) n’apportent pas d’éléments concernant l’impact possible des parabènes présents dans les déodorants ou anti-transpirants sur la survenue de cancer du sein. La première, une étude cas-témoins, ne rapporte aucune augmentation du risque associé à l’usage de déodorants/antitranspirants. La seconde constate seulement chez les femmes ayant un cancer du sein, une relation entre l’âge de survenue de ce cancer et la précocité de l’utilisation des déodorants/antitranspirants (associée au rasage). Aujourd’hui, les résultats disponibles ne sont donc pas en mesure de répondre à la question.
Études chez l’animal
Concernant le méthyl parabène, une étude menée par un consortium industriel a confirmé récemment l’absence d’effet sur les organes reproducteurs mâles après administration par voie orale chez le rat juvénile (1 000 mg/kg/jour).
Pour le propyl parabène, un effet sur la spermatogenèse sans altération du poids des organes reproducteurs mâles a été rapporté : diminution de la quantité testiculaire et épididymaire de spermatozoïdes (environ 50 % des témoins à la dose de 1 000 mg/kg/jour) ; diminution de la production journalière de spermatozoïdes dans tous les groupes (environ 70 % des témoins) ; diminution dose dépendante de la concentration sérique en testostérone. Cette étude a été critiquée dans de nombreuses évaluations des agences sanitaires, en raison du faible nombre d’animaux utilisés, du manque de détails fournis, de variations importantes dans les poids des animaux, et dans les dosages hormonaux... Il faut également noter que la durée de l’étude ne couvre pas un cycle complet de spermatogenèse (52 jours chez le rat).
Concernant le butyl parabène, une étude récente chez le rat menée dans des conditions expérimentales satisfaisantes, a montré l’absence d’effet sur les organes reproducteurs mâles. Chez la souris, aucun effet du butyl parabène n’a été décrit sur le poids de la prostate, des vésicules séminales, et des glandes préputiales. Cependant, le poids de l’épididyme apparaît légèrement augmenté à la dose la plus forte (1 000 mg/kg/jour). Une diminution dose dépendante des spermatides dans les tubes séminifères, sans modification du nombre des spermatogonies et spermatocytes, est observée. La testostérone sérique est significativement diminuée à la dose de 1 000 mg/kg/jour.
Quelques études ont analysé l’effet des parabènes sur les paramètres reproducteurs de la femelle. Une étude récente indique qu’une forte dose de méthyl et d’isopropyl parabène (1 000 mg/kg/jour) entraîne un retard significatif dans la survenue de l’ouverture vaginale (signe de la puberté chez les rongeurs femelles) ainsi qu’une diminution de la longueur de l’œstrus. Cette forte dose des deux composés est responsable d’une diminution du poids des ovaires, d’un manque de corps jaune, et d’une augmentation du nombre de follicules kystiques. L’analyse histologique révèle des anomalies au niveau de l’utérus, à savoir une hypertrophie du myomètre, pour la dose la plus élevée de propyl et d’isopropyl parabène (1 000 mg/kg/jour) et pour toutes les doses de butyl and isobutyl parabène (62,5, 250, 1 000 mg/kg/jour). Les niveaux d’œstradiol sont significativement réduits chez les animaux traités par méthyl, éthyl, propyl, isopropyl et isobutyl parabènes. Les autres études montrent principalement une augmentation du poids de l’utérus.
Bilan et limites des études chez l’homme et l’animal
Les études épidémiologiques ayant recherché des liens entre les cinq familles chimiques analysées dans cette expertise (bisphénol A, phtalates, composés polybromés, composés perfluorés, parabènes) et des anomalies de l’appareil reproducteur mâle et femelle, des troubles de la fonction de reproduction et la fertilité dans l’espèce humaine sont encore trop peu nombreuses à ce jour pour permettre de conclure sur les effets de l’exposition à ces composés relativement récents. Dans l’attente de nouvelles études épidémiologiques, l’expérimentation animale reste une source précieuse de données.
Des études chez l’animal en particulier le rat et la souris (parfois le primate non humain) réalisées dans différents contextes ont rapporté des effets sur l’appareil reproducteur mâle et femelle, sur la production et la qualité des spermatozoïdes et quelquefois sur la fertilité. Dans les études ayant montré des effets, la période d’exposition in utero et jusqu’au sevrage apparaît comme celle la plus critique. Certains effets sont associés à des périodes d’exposition très précises (en termes de jours) en fin de gestation par exemple (phtalates). Des modifications dans les taux d’hormones comme la testostérone, dont le rôle est essentiel dans la masculinisation du tractus génital, peuvent redevenir normaux à l’âge adulte. À l’inverse, d’autres effets précoces peuvent donner lieu à des conséquences pathologiques à distance de l’exposition.
Un des premiers paramètres compliquant l’analyse des effets des substances chimiques potentiellement « reprotoxiques » est leur spécificité d’action en fonction du stade de développement. Par exemple, certaines substances affectent plus fortement ou spécifiquement la gonade fœtale en comparaison de la gonade adulte. Il est même possible d’observer des différences d’effet à quelques jours d’écart au cours du développement de la gonade fœtale.
Types d’effets au niveau cellulaire des différentes substances chimiques
La perturbation de processus au niveau cellulaire peut être à l’origine des troubles de la fertilité ou bien expliquer la survenue de lésions précancéreuses. Les effets des substances chimiques peuvent s’exercer sans modifier les hormones en agissant directement sur certains types cellulaires via leur différenciation, prolifération, interaction et survie.
Apoptose ou mort cellulaire programmée
Dans le cas du développement des gonades, plusieurs substances chimiques sont suspectées d’augmenter l’apoptose au sein de la lignée germinale, ce qui conduit à une diminution du nombre de ces cellules et donc du potentiel reproducteur d’un individu. Ce processus, s’il n’est pas compensé par la prolifération des cellules survivantes, peut entraîner une diminution du nombre de gamètes et donc une hypofertilité. Le bisphénol A et certains phtalates peuvent augmenter l’apoptose des cellules germinales mâles au cours du développement.
À l’inverse, une diminution de l’apoptose peut avoir des conséquences pathologiques. Ainsi, l’apparition ou le développement de lésions « précancéreuses » sont parfois attribués à un défaut d’apoptose. Cette hypothèse a été émise dans le cas des souris femelles exposées au bisphénol A en fin de vie fœtale ou au moment de la puberté, concourant au développement de lésions observées plus tard dans les glandes mammaires.
Par ailleurs, l’effet sur l’apoptose peut varier selon l’âge ou le stade de développement. Chez la souris, le MEHP (métabolite de phtalate) augmente l’apoptose des cellules germinales fœtales mâles à 13,5 et à 18,5 jours post-conception mais il a très peu d’effet, à dose équivalente, à 15,5 jours post-conception. De telles fenêtres d’action très spécifiques sont couramment décrites pour la gamétogenèse et la stéroïdogenèse fœtale (conduisant à la masculinisation).
Prolifération cellulaire
Un dérèglement de la prolifération cellulaire peut également induire des troubles de la fertilité ou être suspecté dans la survenue de cancers. Le bisphénol A stimule la prolifération de cellules séminomateuses humaines. Des phtalates (tels que le DBP) sont capables de diminuer la prolifération des cellules de Sertoli chez le rat et l’on sait que de celle-ci dépend la réserve spermatique de l’adulte.
Différenciation cellulaire
Chez le mâle, dans la lignée germinale, les cellules en division mitotique (cellules souches germinales fœtales ou adultes) expriment de nombreux marqueurs de cellules souches. Au moment de la différenciation de ces cellules, celles-ci perdent ces marqueurs de pluripotence. Le blocage de la différenciation de cellules germinales fœtales est corrélé à la survenue de tumeurs testiculaires. Il a été proposé que des phtalates (DBP) bloquent ou retardent la différenciation des cellules germinales fœtales mâles chez le rat. Cependant, il n’a pas été retrouvé de cancers testiculaires chez les rats exposés aux phtalates, peut-être en raison de la rareté de ce type de cancer chez les rongeurs en dehors de certains fonds génétiques très spécifiques.
Chez la femelle, le recrutement accéléré des follicules primordiaux suite à une exposition au bisphénol A, et leur engagement prématuré vers des stades de différenciation ultérieur vont entraîner une diminution du stock de gamètes et aboutir à une ménopause prématurée. Enfin, il a été montré chez l’animal dans les deux sexes des altérations de la différenciation des neurones hypothalamiques ayant des conséquences à long terme sur la sécrétion des hormones gonadotropes à la puberté et à l’age adulte.
Mécanisme d’action : modification de la fonction hormonale (perturbation endocrinienne)
La plupart des substances chimiques qui font l’objet de cette expertise sont citées comme des perturbateurs endocriniens. Plusieurs définitions sont proposées pour les perturbateurs endocriniens. Selon la Commission européenne, un perturbateur endocrinien est une substance étrangère à l’organisme qui produit des effets pathologiques sur l’organisme ou sur sa descendance à la suite d’une modification de la fonction hormonale (European workshop on the impact of endocrine disrupters on human health and wildlife, Weybridge, UK, 1996). Selon l’Agence américaine de l’environnement (EPA), un perturbateur endocrinien est un agent exogène qui interfère avec la production, la libération, le transport, le métabolisme, la liaison, l’action ou l’élimination des ligands naturels responsables du maintien de l’homéostasie et de la régulation du développement de l’organisme. La définition américaine ne fait pas mention d’un effet pathologique sur l’organisme ou sa descendance.
La première définition pose des difficultés méthodologiques car elle impose de connaître à la fois l’impact d’une substance au niveau fondamental et de vérifier que cette substance a un effet sur la survenue de pathologie passant par ce mécanisme. Or, parmi les nombreux mécanismes d’actions potentiels des perturbateurs endocriniens, seuls quelques uns ont été associés à des « phénotypes » au niveau de l’appareil reproducteur.
L’action des substances chimiques sur la reproduction peut être directe ou indirecte selon que ces substances agissent sur les gonades ou sur l’axe hypothalamo-hypophysaire qui contrôle les sécrétions hormonales gonadiques. Elles peuvent agir à ces deux niveaux mais aussi sur d’autres organes tels que la thyroïde qui aura un effet, par exemple, sur la fonction testiculaire.
La majorité des études se focalise sur la liaison des substances aux récepteurs nucléaires des hormones stéroïdes (ER et AR) perturbant ainsi la liaison des ligands naturels que sont les hormones. Les effets peuvent être de type œstrogénique ou anti-androgénique. Les substances de type œstrogènes peuvent causer des anomalies structurelles ou fonctionnelles chez le mâle et la femelle au cours du développement alors que les substances de type androgènes affectent essentiellement les femelles et les anti-androgènes essentiellement les mâles.
Un effort de recherche important a été mis en œuvre pour la caractérisation des substances altérant la signalisation des récepteurs nucléaires « canoniques » aux œstrogènes et aux androgènes.
Activité hormonale potentielle des 5 familles étudiées
|
Activité hormonale
|
Agoniste
|
Antagoniste
|
|
Œstrogénique
|
BPA, Phtalates, Parabènes
| |
|
Androgénique
| |
Phtalates, BPA, Parabènes
|
|
Thyroïdienne
| |
TBBPA
|
Cependant, d’autres modes d’actions sont possibles via des récepteurs hormonaux moins classiques (formes membranaires de ces récepteurs nucléaires, GPR30), via d’autres récepteurs nucléaires orphelins tels que ERR ou PXR ou CAR responsables de l’induction de système enzymatique pour l’élimination des substances exogènes, ou encore via les récepteurs contrôlant l’activation de la prolifération des peroxysomes (PPAR).
Selon la dose, les substances chimiques peuvent avoir des affinités différentes pour les récepteurs, ce qui peut expliquer les courbes de liaison ou d’activité en U inversé, et peuvent agir par différents mécanismes d’action.
Les récepteurs nucléaires sont au cœur de la régulation de nombreux réseaux de gènes impliqués dans la prolifération et la différenciation cellulaire, le developpement, l’homéostasie et le métabolisme.
Cependant, dans de nombreux cas, une altération du poids ou de la structure des organes reproducteurs, ou encore de la prolifération des cellules, ou de la sécrétion hormonale d’un tissu, est rapportée sans que le mécanisme d’action n’ait été élucidé. Ceci est en partie dû au fait que la connaissance fondamentale, y compris sur les fonctions des récepteurs nucléaires, est encore incomplète.
L’effet sur les voies de signalisation des hormones thyroïdiennes, importantes pour la taille des testicules et la production spermatique (prolifération des cellules de Sertoli) ou des rétinoïdes, acteurs centraux de la détermination du sexe des cellules germinales, est très peu étudié.
Par ailleurs, une substance peut agir sur plusieurs voies de signalisation comme par exemple la signalisation stéroïdienne et la signalisation rétinoïdienne par la liaison à un même récepteur (SHP, short heterodimer partner).
Bisphénol A
Le bisphénol A est un agoniste faible des œstrogènes pouvant se lier aux récepteurs nucléaires des œstrogènes α et β (ERα et β). L’affinité du bisphénol A pour ERα et β est plusieurs milliers de fois plus faible que celle de l’œstradiol. Certaines études in vitro ont montré que le bisphénol A a des effets anti-androgéniques et peut se lier au récepteur des androgènes (AR) mais les preuves d’effets anti-androgéniques in vivo chez l’animal sont rares. Plus récemment, des liaisons du bisphénol A à d’autres récepteurs nucléaires ou membranaires ont été décrites.
Récepteurs nucléaires impliqués pour les différentes substances étudiées
| |
BPA
|
Phtalates
(DEHP, DBP...)
|
Retardateur de flamme (PBDE, TBBPA, HBCD)
|
Perfluorés
(PFOA, PFOS)
|
Parabènes
|
|
ER
|
(+)
|
(+)
|
(+) (-)
| |
(+)
|
|
AR
|
(-)
|
(-)
|
(+) (-)
| |
(-)
|
|
PPAR α ou γ
| |
(+)
|
(+) pour TBBPA
|
(+)
| |
|
PXR
|
(+)
|
(+)
|
(+) (-)
| | |
|
ERRγ
|
(+)
| | | | |
|
TR
| | |
(+) (-)
| | |
|
CAR
| |
(+)
| |
(+)
| |
(+) : agoniste ; (-) : antagoniste ER : récepteur aux œstrogènes ; AR : récepteur aux androgènes ; PPAR : récepteur contrôlant l’activation de la prolifération des peroxysomes ; PXR : pregnan X receptor ; ERR : estrogen related receptor ; TR : récepteur aux hormones thyroïdiennes ; CAR : constitutive activated receptor
Bien que les affinités de liaison ne soient pas très fortes (excepté pour GPR30 si l’interaction est confirmée), des synergies d’action entre récepteurs nucléaires (récepteurs ERα, ERβ et AR) pourraient expliquer les effets à faible dose. De plus, le fait que le bisphénol A se lie à des formes membranaires des récepteurs des œstrogènes suggère qu’il pourrait également interagir avec des formes membranaires d’autres récepteurs nucléaires comme AR, TRα ou β.
La présence d’un groupement aromatique hydroxylé (cycle phénolique) et d’un squelette hydrophobe, caractéristiques essentielles pour l’activité œstrogénique, se retrouvent dans les bisphénols. Par ailleurs, la nature des substituants liés au pont carbone est importante pour déterminer l’activité œstrogénique. Les dérivés chlorés qui peuvent se former lors du recyclage du papier thermique (par blanchissage à l’hypochlorite de sodium) ont été décrits, dans certaines études, comme 28 fois plus œstrogéniques que le bisphénol A.
Phtalates
La perturbation endocrine des phtalates semble être essentiellement due à leur activité d’agonistes des récepteurs PPAR (PPARα et PPARγ). Par cette liaison aux récepteurs PPAR, l’effet majeur des phtalates pourrait être une inhibition de l’expression de l’aromatase. Cet effet antiœstrogènique peut être partiellement compensé par l’activation des récepteurs des œstrogènes et au contraire potentialisé par l’inhibition du récepteur des androgènes. Les récepteurs des œstrogènes alpha et bêta, le récepteur des androgènes, les récepteurs des xénobiotiques CAR (constitutive activated receptor) et PXR (pregnan X receptor) ont été identifiés comme des médiateurs possibles des effets de ces molécules. Il faut noter que les divers phtalates n’ont pas le même profil d’interaction avec les différents récepteurs nucléaires. Ainsi, le MEHP est essentiellement actif sur PPARγ et n’interagit pas avec les récepteurs ER. Au contraire, le BBP et le DBP sont actifs sur ER et interagissent très peu avec PPARγ. Des études sur des modèles de souris déficientes pour un ou plusieurs de ces récepteurs permettraient d’approfondir le mécanisme d’action de différents phtalates (MEHP versus BBP par exemple).
Certains phtalates présentent in vitro, une affinité de liaison au récepteur AR modérée, voire basse, par rapport aux stéroïdes. Deux points d’ancrage sont nécessaires pour avoir une forte interaction (type liaison hydrogène) avec le récepteur AR, et donc une activité anti-androgénique importante. En absence de ces caractéristiques chimiques, seules les inter actions hydrophobes permettent une interaction avec le récepteur. Pour les phtalates, le cycle aromatique peut être impliqué dans ce type d’interaction et un deuxième cycle benzénique à distance de trois atomes de carbone du cycle principal, comme dans BBP, pourrait renforcer cette interaction.
Retardateurs de flamme polybromés
Les cibles des retardateurs de flamme (PBDE, TBBPA, HBCD) au niveau des récepteurs nucléaires ne sont pas encore complètement identifiées. Les récepteurs ER, AR, PXR semblent impliqués pour les PBDE. Les résultats de plusieurs travaux de criblage in vitro suggèrent que l’activité œstrogénique est associée à une faible bromation des PBDE alors que l’activité anti-œstrogénique est déterminée par un degré élevé de bromation. Les molécules substituées aux positions [2,2’,6] ou [2,2’,4] ont une activité ER-agoniste. De même, le modèle QSAR (Quantitative Structure Activity Relationships) lie l’activité AR-antagoniste à un bas degré de bromation et aux substitutions en ortho (positions 2, 2’, 6 et 6’) ou ortho et para (positions 4 et 4’). Les récepteurs TR et PPAR sont des cibles du TBBPA.
Composés perfluorés
Chez l’Homme, les cibles principales des composés perfluorés semblent être les PPAR et parmi eux, PPARα et PPARγ. Les études ont montré que le récepteur PPARα est la cible principale de PFOA et PFOS bien que le récepteur PPARγ soit également activé dans une plus faible mesure.
Cependant, des expériences réalisées sur des souris déficientes en PPARα indiquent qu’une partie des gènes (5-10 %) dont l’expression est modulée par les composés perfluorés serait sous le contrôle du récepteur nucléaire CAR (Constitutive activated receptor). Une étude récente a montré un effet proliférateur de tumeur de PFOA qui serait également indépendant de PPARα.
Parabènes
Dès 1998, des études ont mis en évidence la capacité des parabènes à se lier au récepteur des œstrogènes (ER). Leur affinité de liaison au récepteur des œstrogènes est cependant 10 000, 30 000, 150 00 et 2 500 000 fois plus faible respectivement pour le butyl, le propyl, l’éthyl et le méthyl parabène que le ligand naturel, le 17β-œstradiol. Dans les tests in vitro, l’intensité de l’activité œstrogénique mesurée augmente avec la longueur de la chaîne (méthyl<éthyl <propyl<butyl parabène). Compte tenu de leur petite taille, deux parabènes (du méthyl parabène au n-butyl parabène) pourraient entrer à l’intérieur de la poche du récepteur et donner lieu à des effets de synergie. Une très faible activité anti-androgénique a également été observée in vitro avec le méthyl, propyl et butyl parabène.
Autres mécanismes d’action
Depuis quelques années a émergé l’idée que les effets sur les organes reproducteurs et la fonction de reproduction des composés chimiques pouvaient s’exercer sans passer obligatoirement par la liaison à un récepteur hormonal, qu’il soit nucléaire ou membranaire.
Il a également été proposé que les composés chimiques puissent entrer en compétition pour la liaison à des protéines de transport (SHBG, Sex hormone binding globulin) ou altérer le métabolisme intracellulaire des hormones (aromatase), moduler l’expression des co-activateurs des récepteurs nucléaires, la dégradation de ceux-ci ou encore modifier l’expression de gènes à travers des mécanismes épigénétiques. Plusieurs études ont décrit des altérations des mécanismes épigénétiques impliquant la méthylation de l’ADN, qui pourraient rendre compte de la transmission aux générations futures de certains phénotypes.
Des hypothèses ont également été formulées sur l’altération du cytosquelette de certains types cellulaires et sur une action directe ciblant les cellules germinales sans passer par une perturbation stéroïdienne. Ces quelques pistes méritent d’être poursuivies et approfondies.
Nouveaux enjeux de recherches
Les méthodes d’étude des substances chimiques ayant potentiellement un impact sur la reproduction peuvent être destinées au criblage pour la caractérisation du danger et/ou à l’étude des mécanismes d’action.
Les méthodes de criblage incluent des tests in vivo et in vitro. Des méthodes d’études réglementaires ont été définies et correspondent aux lignes OCDE (Organisation de coopération et de développement économique). Les méthodes OCDE sont au nombre de 6 (plus une 7e dont la validation est en cours) en ce qui concerne l’impact des produits chimiques sur la reproduction. Les méthodes in vitro ne permettent pas de comprendre comment les substances chimiques sont métabolisées et stockées dans l’organisme alors que les études in vivo prennent en compte l’ensemble des interactions.
Dans le cadre d’un criblage, on peut structurer les méthodes d’études en deux niveaux complémentaires. À un premier niveau, des tests simples et rapides permettent d’identifier des molécules chimiques ayant un potentiel de perturbation endocrine. C’est par exemple la liaison aux récepteurs d’hormones stéroïdes. Les tests in vitro présentent l’avantage de travailler sur un nombre très grand d’échantillons et de respecter la règle des trois R (édictée par la législation européenne sur la protection des animaux : reduce/replace/refine) : réduction du nombre d’animaux ; remplacement des animaux quand cela est possible ; raffinement de la méthodologie utilisée.
À un deuxième niveau, des tests plus perfectionnés comme les cultures organotypiques et les tests in vivo, moins adaptés à un criblage à haut débit, sont plus informatifs sur les effets complexes mettant en jeu des interactions au niveau d’organes ou de tout l’organisme. Ces tests sont à l’heure actuelle les seuls pouvant tracer le lien avec une atteinte possible de la fertilité ou un changement pathologique.
La sélection des tests pour la prédiction d’éventuels effets délétères sur la fonction de reproduction requiert à la fois une meilleure connaissance des mécanismes fondamentaux en jeu (les voies de signalisation impliquées dans les étapes clefs de la reproduction des mammifères sont loin d’être toutes identifiées) et une meilleure compréhension des mécanismes d’action des substances reprotoxiques in situ dans leur(s) tissu(s) cible(s).
Pour étudier ces mécanismes d’action, le développement de lignées cellulaires correspondant à divers tissus reproducteurs est important, mais pour appréhender le lien avec la fertilité il est nécessaire d’avoir recours à des modèles plus proches de la physiologie tels que les co-cultures, la culture organo typique ou l’expérimentation in vivo.
En complément des études in vitro et in vivo, sont apparues plus récemment les méthodes in silico ou « systèmes experts » qui font appel à des outils informatiques. Ces méthodes telles que les QSAR apportent des informations sur la nature des interactions chimiques entre les substances et leurs récepteurs et sont précieuses pour appréhender ces mêmes mécanismes. Par la suite, de telles études peuvent être utilisées pour mettre sur pieds de nouvelles expériences ou lors de la sélection de molécules à tester et également favoriser la recherche de substituts plus sûrs (répondant aux exigences du règlement européen REACH).
Il est souvent nécessaire de disposer d’un faisceau d’arguments pour conforter la relation entre les propriétés biologiques d’une substance chimique et son rôle dans la pathologie. Par ailleurs, la connaissance du mode d’action permet de savoir si des observations faites chez l’animal sont transposables à l’homme.
Cependant, le transfert des travaux réalisés dans des modèles in vitro ou à l’aide d’animaux de laboratoire à l’être humain doit tenir compte de l’hétérogénéité génétique de la population humaine. En effet, divers polymorphismes dans des acteurs clefs de la fonction de reproduction sont maintenant connus. Des polymorphismes ont également été décrits pour les récepteurs aux androgènes (AR) et aux œstrogènes (ER) ainsi que pour SF1 (steroidogenic factor 1). Pour plusieurs substances chimiques notamment des phtalates, des effets très différents ont été rapportés d’une espèce à l’autre, parfois même entre deux lignées animales différentes d’une même espèce.
Peu d’études (in vivo comme in vitro) ont abordé la problématique cruciale des effets de mélanges complexes. Les effets de mélange (liés à une réalité de multi-exposition), les effets de faibles doses en condition d’exposition chronique, les relations dose-effet non conventionnelles, ou encore l’existence de cibles biologiques multiples pour une même substance, sont autant d’éléments illustrant la complexité de la problématique d’étude des substances chimiques et en particulier des perturbateurs endocriniens et de l’évaluation des risques potentiels.
De fait, les approches méthodologiques fondées sur la mesure ou le suivi d’un paramètre unique, qu’il s’agisse d’un agent chimique (caractérisation d’exposition, études métaboliques et/ou pharmacocinétiques) ou bien d’un « end-point » clinique (caractérisation du danger, études pharmacodynamiques) particuliers, sont dans ce cas le plus souvent inadaptées.
Des évolutions de la toxicologie vers des approches, outils et concepts plus intégratifs se dessinent. Dans ce cadre, l’exploitation des technologies de profilage global de type « omique » représente probablement une voie d’évolution majeure pour la toxicologie dans les années à venir. Si les deux premiers niveaux de description des systèmes biologiques que sont la transcriptomique et la protéomique sont déjà assez largement utilisés, le troisième niveau qui est celui du métabolome est encore émergent. Les approches de type métabolomique s’intéressent plus particulièrement aux petites molécules (métabolites) présentes au sein des systèmes biologiques après la mise en jeu des phénomènes complexes de transcription et de traduction. L’objectif de la métabolomique est également d’identifier des biomarqueurs d’exposition aux différentes substances dans des fluides biologiques tels que le sang ou l’urine. Ainsi la recherche de ces biomarqueurs chez un individu permettrait de déterminer s’il a été exposé à un moment de sa vie et de prédire les conséquences de cette exposition sur sa fertilité.
La mesure de ces biomarqueurs dans le cadre des études épidémiologiques constitue une source de données importantes sur les niveaux d’exposition des populations aux polluants environnementaux. Les approches de type cohorte prospective, adossées à d’importantes biothèques, ont l’avantage de permettre d’étudier simultanément différents paramètres de santé et d’évaluer de façon prospective l’exposition aux substances chimiques. De même, il faut souligner l’intérêt des cohortes mères-enfants permettant de suivre à moyen et long terme la santé de l’enfant et sa sensibilité aux expositions subies durant la vie intra-utérine.
Les approches par des disciplines complémentaires et l’interaction entre les épidémiologistes, physiologistes, toxicologues et biologistes de la reproduction devraient conduire à une vision plus intégrée des effets des substances et devraient permettre de répondre aux défis sociétaux de la santé reproductive grâce à un ensemble de méthodologies :
• approches classiques d’étude de l’absorption, distribution et métabolisme des toxiques ;
• utilisation de modèles biologiques cellulaires proches des états physiologiques humains (organotypique) et prise en compte de l’intervariabilité individuelle (cellules iPS) ;
• utilisation de modèles animaux pertinents (souris transgéniques mutantes pour un récepteur) permettant d’appréhender les mécanismes d’action sur les tissus cibles ; ou de mammifères non rongeurs ou encore d’animaux transgéniques humanisés plus représentatifs de la situation humaine ;
• exploration de la perturbation des voies de biosynthèse des hormones naturelles pour identifier les différents niveaux de modification avec des outils de quantification ;
• biologie structurale qui permet de comprendre les interactions des substances avec leurs cibles protéiques cellulaires ;
• techniques haut débit, génomique, protéomique, métabolomique qui permettent une analyse à grande échelle des effets moléculaires potentiels et de rechercher des biomarqueurs d’expositions multiples ;
• application des outils de la biochimie et de la biologie moléculaire aux biothèques constituées dans le cadre des cohortes épidémiologiques ;
• biologie de systèmes qui permet d’intégrer ces informations dans un modèle mathématique global et de prédire les effets à long terme ;
• prise en compte des multi-expositions et utilisation d’indicateurs sensibles et faciles à obtenir comme le spermatozoïde ou la durée nécessaire pour avoir un enfant.