Fonction de reproduction et différences entre espèces
2011
| ANALYSE |
8-
Malformations des voies génitales chez l’homme et la femme
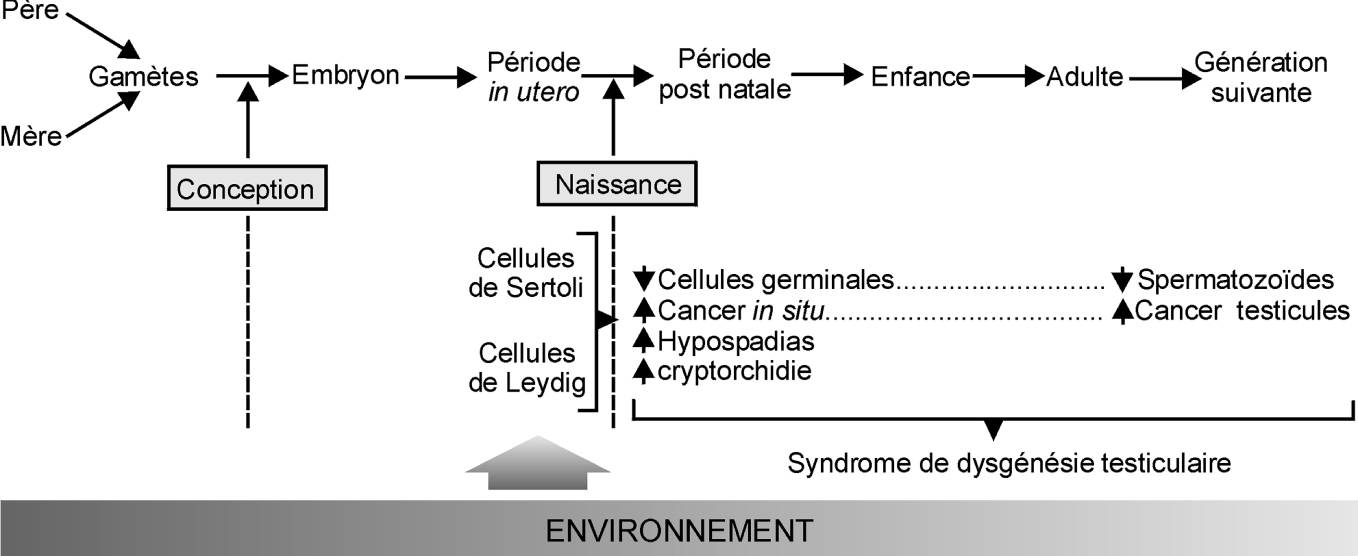
Dans ce chapitre ne seront abordées que les malformations en relation avec l’exposition à des perturbateurs endocriniens et plus particulièrement celles survenant dans le « syndrome de dysgénésie testiculaire » ou TDS (abréviation de l’expression « Testicular dysgenesis syndrome » pour les anglophones) (figure 8.1 ). Le TDS est un syndrome associant chez les sujets masculins au moins deux des anomalies suivantes :
). Le TDS est un syndrome associant chez les sujets masculins au moins deux des anomalies suivantes :
 ). Le TDS est un syndrome associant chez les sujets masculins au moins deux des anomalies suivantes :
). Le TDS est un syndrome associant chez les sujets masculins au moins deux des anomalies suivantes :À la naissance, puis toute la vie (sauf correction chirurgicale) :
• pénis mal formé (avec notamment hypospadias) ;
• pénis anormalement petit ;
• testicule non descendu (cryptorchidie, généralement chirurgicalement corrigée dans l’enfance) ;
À partir de l’adolescence :
• moindre qualité du sperme ;
• moindre quantité de spermatozoïdes produits par millilitre de sperme ;
• nombre anormal (à très élevé) de spermatozoïdes mal formés ;
• sous fécondité (ou infertilité) masculine ;
• avec éventuellement cancer du testicule.
Ces symptômes semblent pouvoir être rapportés à une modification (inhibition) de la production de testostérone à un moment critique de la vie fœtale qui est celui du lancement du « programme » de « masculinisation » de l’embryon (Sharpe et Skakkebaek, 2008 ).
).
 ).
).L’environnement doit être considéré au sens large, de nombreux agents exogènes pouvant moduler la fonction de reproduction. L’exposition à un facteur exogène peut être présente durant la vie in utero (exemple du DES) mais également durant l’enfance (exemple Seveso, Mocarelli et coll., 1996 ) ou bien chez l’adulte (exemple le dibromochloropropane, Whorton et coll., 1979
) ou bien chez l’adulte (exemple le dibromochloropropane, Whorton et coll., 1979 ).
).
 ) ou bien chez l’adulte (exemple le dibromochloropropane, Whorton et coll., 1979
) ou bien chez l’adulte (exemple le dibromochloropropane, Whorton et coll., 1979 ).
).L’hypothèse du syndrome de dysgénésie testiculaire émise par Sharpe et Skakkebæk (2008 ) permet d’intégrer différentes conséquences constatées dans les études épidémiologiques (baisse de la production de spermatozoïdes, augmentation de la fréquence de l’hypospade, de la cryptorchidie et du cancer du testicule). Cette hypothèse est d’autant plus séduisante que l’action de perturbateurs endocriniens chez l’animal a pu mettre en évidence en partie des manifestations allant dans le même sens. Cependant, l’exposition de l’adulte peut avoir pour conséquence des perturbations de la fonction de reproduction. Les facteurs de risques peuvent être multiples chez l’adulte (exposition à des substances chimiques, abordées par exemple dans cet ouvrage, mais également à des facteurs physiques par exemple l’hyperthermie ou des styles/habitudes de vie comme par exemple le tabac...). Il semble nécessaire d’avoir à l’esprit la notion d’une possible continuité décrite dans ce schéma et la notion d’expositions multiples à différentes périodes de la vie, de la conception jusqu’à la ou les générations suivantes. Enfin, savoir comment intervient le fond génétique reste une vraie question. Le schéma n’aborde que la fonction de reproduction masculine et se réduit à certains critères ; d’autres critères peuvent être envisagés comme par exemple la modification du taux de testostérone ou les altérations de l’ADN du gamète.
) permet d’intégrer différentes conséquences constatées dans les études épidémiologiques (baisse de la production de spermatozoïdes, augmentation de la fréquence de l’hypospade, de la cryptorchidie et du cancer du testicule). Cette hypothèse est d’autant plus séduisante que l’action de perturbateurs endocriniens chez l’animal a pu mettre en évidence en partie des manifestations allant dans le même sens. Cependant, l’exposition de l’adulte peut avoir pour conséquence des perturbations de la fonction de reproduction. Les facteurs de risques peuvent être multiples chez l’adulte (exposition à des substances chimiques, abordées par exemple dans cet ouvrage, mais également à des facteurs physiques par exemple l’hyperthermie ou des styles/habitudes de vie comme par exemple le tabac...). Il semble nécessaire d’avoir à l’esprit la notion d’une possible continuité décrite dans ce schéma et la notion d’expositions multiples à différentes périodes de la vie, de la conception jusqu’à la ou les générations suivantes. Enfin, savoir comment intervient le fond génétique reste une vraie question. Le schéma n’aborde que la fonction de reproduction masculine et se réduit à certains critères ; d’autres critères peuvent être envisagés comme par exemple la modification du taux de testostérone ou les altérations de l’ADN du gamète.
 ) permet d’intégrer différentes conséquences constatées dans les études épidémiologiques (baisse de la production de spermatozoïdes, augmentation de la fréquence de l’hypospade, de la cryptorchidie et du cancer du testicule). Cette hypothèse est d’autant plus séduisante que l’action de perturbateurs endocriniens chez l’animal a pu mettre en évidence en partie des manifestations allant dans le même sens. Cependant, l’exposition de l’adulte peut avoir pour conséquence des perturbations de la fonction de reproduction. Les facteurs de risques peuvent être multiples chez l’adulte (exposition à des substances chimiques, abordées par exemple dans cet ouvrage, mais également à des facteurs physiques par exemple l’hyperthermie ou des styles/habitudes de vie comme par exemple le tabac...). Il semble nécessaire d’avoir à l’esprit la notion d’une possible continuité décrite dans ce schéma et la notion d’expositions multiples à différentes périodes de la vie, de la conception jusqu’à la ou les générations suivantes. Enfin, savoir comment intervient le fond génétique reste une vraie question. Le schéma n’aborde que la fonction de reproduction masculine et se réduit à certains critères ; d’autres critères peuvent être envisagés comme par exemple la modification du taux de testostérone ou les altérations de l’ADN du gamète.
) permet d’intégrer différentes conséquences constatées dans les études épidémiologiques (baisse de la production de spermatozoïdes, augmentation de la fréquence de l’hypospade, de la cryptorchidie et du cancer du testicule). Cette hypothèse est d’autant plus séduisante que l’action de perturbateurs endocriniens chez l’animal a pu mettre en évidence en partie des manifestations allant dans le même sens. Cependant, l’exposition de l’adulte peut avoir pour conséquence des perturbations de la fonction de reproduction. Les facteurs de risques peuvent être multiples chez l’adulte (exposition à des substances chimiques, abordées par exemple dans cet ouvrage, mais également à des facteurs physiques par exemple l’hyperthermie ou des styles/habitudes de vie comme par exemple le tabac...). Il semble nécessaire d’avoir à l’esprit la notion d’une possible continuité décrite dans ce schéma et la notion d’expositions multiples à différentes périodes de la vie, de la conception jusqu’à la ou les générations suivantes. Enfin, savoir comment intervient le fond génétique reste une vraie question. Le schéma n’aborde que la fonction de reproduction masculine et se réduit à certains critères ; d’autres critères peuvent être envisagés comme par exemple la modification du taux de testostérone ou les altérations de l’ADN du gamète.Hypospadias
L’hypospadias est une affection des voies génitales externes relativement fréquente (3/1 000 naissances), c’est l’affection la plus fréquente du pénis, son incidence oscille selon les auteurs entre 1 à 8/1 000 enfants de sexe masculin. Il s’agit d’une anomalie de la fermeture de la gouttière urogénitale à la face inférieure du pénis (figure 8.2 ). D’un point de vue embryologique, l’hypospadias pénien et pénoscrotal résultent d’une anomalie de la fermeture de la gouttière urogénitale issue de la lame urétrale d’origine entoblastique, qui se ferme d’arrière en avant en constituant un tube jusqu’à la base du gland. L’étiologie est multifactorielle, outre les facteurs génétiques, le rôle nocif d’un traitement hormonal au cours des premiers mois de la grossesse ou encore une altération de la synthèse de la testostérone (ou de ses dérivés) et/ou d’une anomalie des récepteurs pour ces hormones ont été incriminés.
). D’un point de vue embryologique, l’hypospadias pénien et pénoscrotal résultent d’une anomalie de la fermeture de la gouttière urogénitale issue de la lame urétrale d’origine entoblastique, qui se ferme d’arrière en avant en constituant un tube jusqu’à la base du gland. L’étiologie est multifactorielle, outre les facteurs génétiques, le rôle nocif d’un traitement hormonal au cours des premiers mois de la grossesse ou encore une altération de la synthèse de la testostérone (ou de ses dérivés) et/ou d’une anomalie des récepteurs pour ces hormones ont été incriminés.
 ). D’un point de vue embryologique, l’hypospadias pénien et pénoscrotal résultent d’une anomalie de la fermeture de la gouttière urogénitale issue de la lame urétrale d’origine entoblastique, qui se ferme d’arrière en avant en constituant un tube jusqu’à la base du gland. L’étiologie est multifactorielle, outre les facteurs génétiques, le rôle nocif d’un traitement hormonal au cours des premiers mois de la grossesse ou encore une altération de la synthèse de la testostérone (ou de ses dérivés) et/ou d’une anomalie des récepteurs pour ces hormones ont été incriminés.
). D’un point de vue embryologique, l’hypospadias pénien et pénoscrotal résultent d’une anomalie de la fermeture de la gouttière urogénitale issue de la lame urétrale d’origine entoblastique, qui se ferme d’arrière en avant en constituant un tube jusqu’à la base du gland. L’étiologie est multifactorielle, outre les facteurs génétiques, le rôle nocif d’un traitement hormonal au cours des premiers mois de la grossesse ou encore une altération de la synthèse de la testostérone (ou de ses dérivés) et/ou d’une anomalie des récepteurs pour ces hormones ont été incriminés.Plusieurs formes anatomiques ont été mises en évidence. L’hypospadias balanique se caractérise par une ouverture du méat urétral sous le gland. L’hypo spadias pénien se caractérise par une ouverture de l’urètre au milieu du pénis. L’hypospadias pénoscrotal résulte en une fusion incomplète des plis labio scrotaux et se caractérise par une ouverture de l’urètre à la face inférieure du pénis au niveau du scrotum.
Cryptorchidie /ectopie testiculaire
Descente testiculaire
Entre le troisième mois et le terme de la grossesse, les testicules descendent depuis la région lombaire (à la face ventro-médiane du mésonéphros) vers le futur scrotum. Ce déplacement se fait sous l’action conjuguée de la croissance et de facteurs hormonaux (testostérone, INSL3), le gubernaculum testis jouant un rôle décisif. Ce cordon ligamentaire apparaît au cours de la 7e semaine suite à la dégénérescence du mésonéphros en substitution au ligament inguinal. L’extrémité céphalique du gubernaculum se fixe au testicule, alors que son extrémité caudale s’attache dans la région des bourrelets labioscrotaux (futur scrotum).
Au même moment apparaît une petite évagination du péritoine appelée processus vaginal, le long duquel le testicule va glisser à travers le canal inguinal, dans sa position définitive.
Entre la 7e et la 12e semaine de gestation, le gubernaculum se raccourcit le long de sa portion extra-inguinale et attire les testicules, leurs canaux déférents et leurs vaisseaux vers le bas. Les testicules restent dans le voisinage du canal inguinal du 3e au 7e mois puis entrent dans le canal inguinal. Ils ne pénètrent dans le scrotum qu’autour du 9e mois. L’action de la testostérone et des androgènes (hormones sexuelles stéroïdes masculines), semble favoriser cette dernière phase de la descente testiculaire.
La cryptorchidie (non descente des testicules en position scrotale) touche environ 30 % des nouveau-nés prématurés et 4 % des nouveau-nés à terme. Il ne faut pas confondre la cryptorchidie avec l’ectopie testiculaire où le testicule est dans une position anormale, conséquence d’une migration aberrante. La cryptorchidie peut être unilatérale ou bilatérale dans 20-40 % des cas.
L’étiologie de cette affection reste inconnue mais semble liée à une production insuffisante d’androgènes. Les testicules restent dans la cavité abdominale, ou n’importe où sur leur trajet de migration normale, le plus souvent dans le canal inguinal (60 % des cas). Si les testicules cryptorchides sont en général normaux à la naissance, des altérations histologiques apparaissent fréquemment au cours de la première année de vie (incidence du cancer testiculaire accrue de 20-40 %, risque de stérilité).
Malformations des voies génitales chez la femme
Endométriose
L’endométriose est caractérisée par la présence de tissu endométrial ectopique (localisé en dehors de l’utérus), soit au niveau des ovaires, des trompes, des ligaments utérins, du septum recto-vaginal, du péritoine pelvien. Comme l’endomètre utérin, ce tissu est soumis au cycle menstruel. L’étiologie de l’endométriose reste toujours très controversée.
Selon la théorie de la métaplasie, l’épithélium cœlomique, s’invaginant pour former les canaux de Müller (qui vont donner naissances à l’utérus et donc à l’endomètre), garde la potentialité de se différencier en tissu endométrial. Cependant, le principal mécanisme responsable de l’endométriose pelvienne pourrait être le reflux menstruel de débris endométriaux et leur implantation secondaire au niveau pelvien. Des mécanismes génétiques et immunologiques mettant en jeu l’adhérence cellulaire sont probablement également impliqués.
Bibliographie
[1] MOCARELLI P, BRAMBILLA P, GERTHOUX PM, PATTERSON DG JR, NEEDHAM LL. Change in sex ratio with exposure to dioxin.
The Lancet. 1996;
348:409

[2] SHARPE RM, SKAKKEBAEK NE. Testicular dysgenesis syndrome: mechanistic insights and potential new downstream effects.
Fertil Steril. 2008;
89:e33- e38

[3] WHORTON D, MILBY TH, KRAUSS RM, STUBBS HA. Testicular function in DBCP exposed pesticide workers.
J Occup Med. 1979;
21:161- 166

→ Aller vers SYNTHESE