Phtalates
2011
| ANALYSE |
41-
Relation structure-fonction et études in silico
Au cours de ces dernières années, des articles sont apparus dans la littérature concernant l’étude de la toxicité des phtalates par des méthodes SAR (structure-activity relationship) et QSAR (quantitative structure-activity relationship) (Netzeva et coll., 2005 et 2006
et 2006 ). Les « end points » typiques de la toxicité ou de l’écotoxicité comme la solubilité dans l’eau ou le coefficient de partition eau/octanol ont été considérés (Thomsen et coll., 1999
). Les « end points » typiques de la toxicité ou de l’écotoxicité comme la solubilité dans l’eau ou le coefficient de partition eau/octanol ont été considérés (Thomsen et coll., 1999 ).
).
 et 2006
et 2006 ). Les « end points » typiques de la toxicité ou de l’écotoxicité comme la solubilité dans l’eau ou le coefficient de partition eau/octanol ont été considérés (Thomsen et coll., 1999
). Les « end points » typiques de la toxicité ou de l’écotoxicité comme la solubilité dans l’eau ou le coefficient de partition eau/octanol ont été considérés (Thomsen et coll., 1999 ).
).Nous n’avons pas trouvé dans la littérature d’études dédiées complètement aux relations entre la structure des phtalates et leurs interactions avec les récepteurs endocriniens. Deux articles de Tong et de ses collaborateurs (Fang et coll., 2001 et 2003
et 2003 ) rapportent une analyse détaillée de l’activité anti-androgénique d’environ deux cent substances chimiques dont sept phtalates (Fang et coll., 2003
) rapportent une analyse détaillée de l’activité anti-androgénique d’environ deux cent substances chimiques dont sept phtalates (Fang et coll., 2003 ). L’activité est mesurée en termes de compétition vis-à-vis d’un agoniste synthétique (R1881) pour le site du récepteur aux androgènes (AR). Les phtalates testés présentent in vitro, une affinité relative (relative binding affinity, RBA) de liaison au récepteur AR modérée, voire basse, par rapport aux stéroïdes (RBA moyenne de 0,0045 versus 14,7 pour les stéroïdes) (Fang et coll., 2003
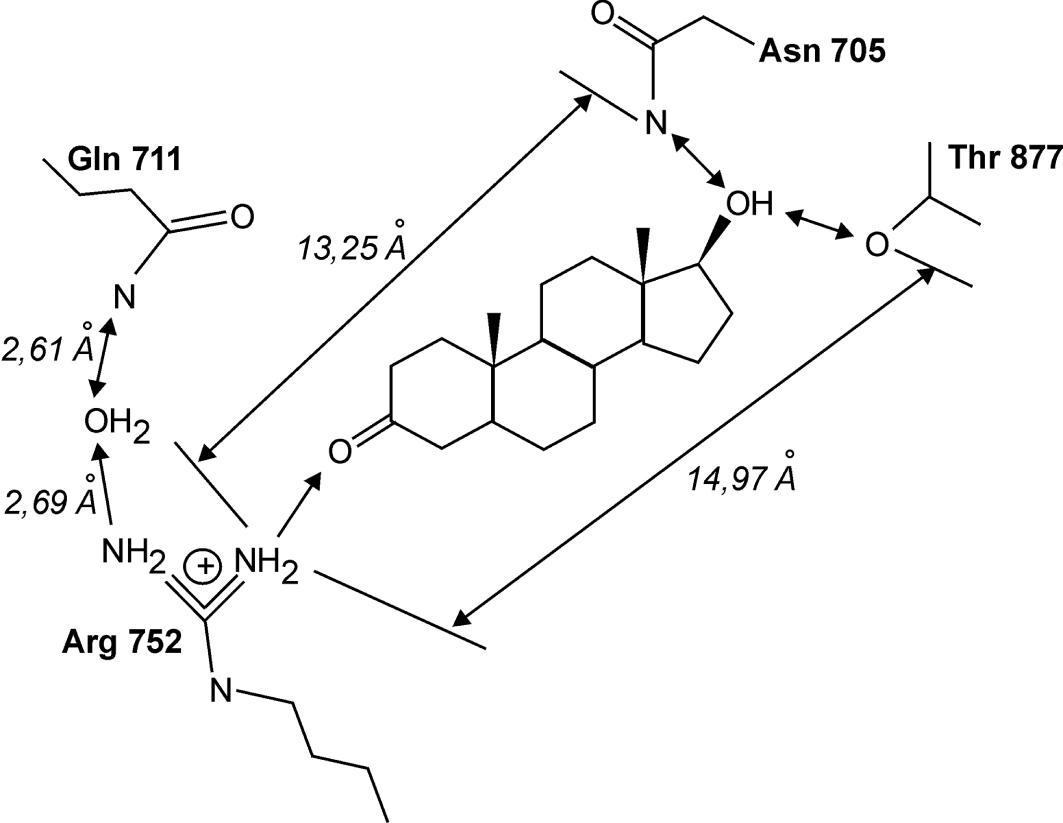
). L’activité est mesurée en termes de compétition vis-à-vis d’un agoniste synthétique (R1881) pour le site du récepteur aux androgènes (AR). Les phtalates testés présentent in vitro, une affinité relative (relative binding affinity, RBA) de liaison au récepteur AR modérée, voire basse, par rapport aux stéroïdes (RBA moyenne de 0,0045 versus 14,7 pour les stéroïdes) (Fang et coll., 2003 ). Comme pour les ligands du récepteur ER, deux points d’ancrage sont nécessaires pour avoir une forte interaction (type liaison hydrogène) avec le récepteur AR, et donc une activité anti-androgénique importante (figure 41.1
). Comme pour les ligands du récepteur ER, deux points d’ancrage sont nécessaires pour avoir une forte interaction (type liaison hydrogène) avec le récepteur AR, et donc une activité anti-androgénique importante (figure 41.1 ). En absence de ces caractéristiques chimiques, seules les interactions hydrophobes permettent une interaction avec le récepteur. Ceci est le cas de phtalates testés, où le cycle aromatique peut être impliqué dans ce type d’interaction (Nakai et coll., 1999
). En absence de ces caractéristiques chimiques, seules les interactions hydrophobes permettent une interaction avec le récepteur. Ceci est le cas de phtalates testés, où le cycle aromatique peut être impliqué dans ce type d’interaction (Nakai et coll., 1999 ; Fang et coll., 2003
; Fang et coll., 2003 ). Éventuellement, un deuxième cycle benzénique, lié sur une chaîne latérale et à distance de trois atomes de carbone du cycle principal, comme dans le BBP, pourrait renforcer cette interaction (Fang et coll., 2001
). Éventuellement, un deuxième cycle benzénique, lié sur une chaîne latérale et à distance de trois atomes de carbone du cycle principal, comme dans le BBP, pourrait renforcer cette interaction (Fang et coll., 2001 ). Le niveau modeste de cette interaction explique les faibles activités in vitro (Fang et coll., 2003
). Le niveau modeste de cette interaction explique les faibles activités in vitro (Fang et coll., 2003 ).
).
 et 2003
et 2003 ) rapportent une analyse détaillée de l’activité anti-androgénique d’environ deux cent substances chimiques dont sept phtalates (Fang et coll., 2003
) rapportent une analyse détaillée de l’activité anti-androgénique d’environ deux cent substances chimiques dont sept phtalates (Fang et coll., 2003 ). L’activité est mesurée en termes de compétition vis-à-vis d’un agoniste synthétique (R1881) pour le site du récepteur aux androgènes (AR). Les phtalates testés présentent in vitro, une affinité relative (relative binding affinity, RBA) de liaison au récepteur AR modérée, voire basse, par rapport aux stéroïdes (RBA moyenne de 0,0045 versus 14,7 pour les stéroïdes) (Fang et coll., 2003
). L’activité est mesurée en termes de compétition vis-à-vis d’un agoniste synthétique (R1881) pour le site du récepteur aux androgènes (AR). Les phtalates testés présentent in vitro, une affinité relative (relative binding affinity, RBA) de liaison au récepteur AR modérée, voire basse, par rapport aux stéroïdes (RBA moyenne de 0,0045 versus 14,7 pour les stéroïdes) (Fang et coll., 2003 ). Comme pour les ligands du récepteur ER, deux points d’ancrage sont nécessaires pour avoir une forte interaction (type liaison hydrogène) avec le récepteur AR, et donc une activité anti-androgénique importante (figure 41.1
). Comme pour les ligands du récepteur ER, deux points d’ancrage sont nécessaires pour avoir une forte interaction (type liaison hydrogène) avec le récepteur AR, et donc une activité anti-androgénique importante (figure 41.1 ). En absence de ces caractéristiques chimiques, seules les interactions hydrophobes permettent une interaction avec le récepteur. Ceci est le cas de phtalates testés, où le cycle aromatique peut être impliqué dans ce type d’interaction (Nakai et coll., 1999
). En absence de ces caractéristiques chimiques, seules les interactions hydrophobes permettent une interaction avec le récepteur. Ceci est le cas de phtalates testés, où le cycle aromatique peut être impliqué dans ce type d’interaction (Nakai et coll., 1999 ; Fang et coll., 2003
; Fang et coll., 2003 ). Éventuellement, un deuxième cycle benzénique, lié sur une chaîne latérale et à distance de trois atomes de carbone du cycle principal, comme dans le BBP, pourrait renforcer cette interaction (Fang et coll., 2001
). Éventuellement, un deuxième cycle benzénique, lié sur une chaîne latérale et à distance de trois atomes de carbone du cycle principal, comme dans le BBP, pourrait renforcer cette interaction (Fang et coll., 2001 ). Le niveau modeste de cette interaction explique les faibles activités in vitro (Fang et coll., 2003
). Le niveau modeste de cette interaction explique les faibles activités in vitro (Fang et coll., 2003 ).
). | Figure 41.1 Réseau des liaisons hydrogène dans l’interaction du récepteur AR avec le dihydrotestostérone (Fang et coll., 2003 ) ) |
Dans leur étude datant de l’année 2003, Klopman et Chakravarti ont considéré 313 produits chimiques classés comme actifs ou non actifs pour développer un modèle SAR (Klopman et Chakravarti, 2003 ). Dans les douze phalates considérés, un a été classé comme actif, le n-butylbenzylphtalate diester et un autre le DBP comme faiblement actif. Cette classification a été faite en termes de RBA in vitro sur la base du travail de Tong et de ses collaborateurs (Fang et coll., 2001
). Dans les douze phalates considérés, un a été classé comme actif, le n-butylbenzylphtalate diester et un autre le DBP comme faiblement actif. Cette classification a été faite en termes de RBA in vitro sur la base du travail de Tong et de ses collaborateurs (Fang et coll., 2001 ).
).
 ). Dans les douze phalates considérés, un a été classé comme actif, le n-butylbenzylphtalate diester et un autre le DBP comme faiblement actif. Cette classification a été faite en termes de RBA in vitro sur la base du travail de Tong et de ses collaborateurs (Fang et coll., 2001
). Dans les douze phalates considérés, un a été classé comme actif, le n-butylbenzylphtalate diester et un autre le DBP comme faiblement actif. Cette classification a été faite en termes de RBA in vitro sur la base du travail de Tong et de ses collaborateurs (Fang et coll., 2001 ).
).Dans une étude plus récente (Li et coll., 2009 ), l’activité œstrogénique, caractérisée par la concentration du phtalate à la moitié de la concentration maximale effective (EC50) par rapport à celle du ligand naturel E2, du BBP et du di-propylphtalate est calculée avec une erreur moyenne de 35 %. Un modèle QSAR fiable et robuste (R2=0,90 et Q2LOO=0,90) a été ensuite développé sur la base de 25 œstrogènes (dont les deux phtalates) et validé sur 8 œstrogènes. Cependant, il n’a pas été possible de déterminer à partir de ce modèle, un mécanisme sous-jacent concernant l’interaction spécifique phtalate-récepteur.
), l’activité œstrogénique, caractérisée par la concentration du phtalate à la moitié de la concentration maximale effective (EC50) par rapport à celle du ligand naturel E2, du BBP et du di-propylphtalate est calculée avec une erreur moyenne de 35 %. Un modèle QSAR fiable et robuste (R2=0,90 et Q2LOO=0,90) a été ensuite développé sur la base de 25 œstrogènes (dont les deux phtalates) et validé sur 8 œstrogènes. Cependant, il n’a pas été possible de déterminer à partir de ce modèle, un mécanisme sous-jacent concernant l’interaction spécifique phtalate-récepteur.
 ), l’activité œstrogénique, caractérisée par la concentration du phtalate à la moitié de la concentration maximale effective (EC50) par rapport à celle du ligand naturel E2, du BBP et du di-propylphtalate est calculée avec une erreur moyenne de 35 %. Un modèle QSAR fiable et robuste (R2=0,90 et Q2LOO=0,90) a été ensuite développé sur la base de 25 œstrogènes (dont les deux phtalates) et validé sur 8 œstrogènes. Cependant, il n’a pas été possible de déterminer à partir de ce modèle, un mécanisme sous-jacent concernant l’interaction spécifique phtalate-récepteur.
), l’activité œstrogénique, caractérisée par la concentration du phtalate à la moitié de la concentration maximale effective (EC50) par rapport à celle du ligand naturel E2, du BBP et du di-propylphtalate est calculée avec une erreur moyenne de 35 %. Un modèle QSAR fiable et robuste (R2=0,90 et Q2LOO=0,90) a été ensuite développé sur la base de 25 œstrogènes (dont les deux phtalates) et validé sur 8 œstrogènes. Cependant, il n’a pas été possible de déterminer à partir de ce modèle, un mécanisme sous-jacent concernant l’interaction spécifique phtalate-récepteur.
En conclusion, les études actuelles sur les interactions entre les phtalates et les récepteurs ER ou AR sont insuffisantes. Une faible affinité a été mise en évidence avec le récepteur AR pour le BBP, renforcée par la présence d’un double cycle benzénique.
Bibliographie
[1] FANG H, TONG W, SHI LM, BLAIR R, PERKINS R, et coll. Structure-activity relationships for a large diverse set of natural, synthetic, and environmental estrogens.
Chem Res Toxicol. 2001;
14:280- 294

[2] FANG H, TONG WG, BRANHAM WS, MOLAND CL, DIAL SL, et coll. Study of 202 natural, synthetic, and environmental chemicals for binding to the androgen receptor.
Chem Res Toxicol. 2003;
16:1338- 1358

[3] KLOPMAN G, CHAKRAVARTI SK. Structure-activity relationship study of a diverse set of estrogen receptor ligands (I) using MultiCASE expert system.
Chemosphere. 2003;
51:445- 459

[4] LI F, CHEN J, WANG Z, LI J, QIAO X. Determination and prediction of xenœogens by recombinant yeast-based assay and QSAR.
Chemosphere. 2009;
74:1152- 1157

[5] NAKAI M, TABIRA Y, ASAI D, YAKABE Y, SHIMYOZU T, et coll. Binding characteristics of dialkyl phthalates for the estrogen receptor.
Biochem Biophys Res Commun. 1999;
254:311- 314

[6] NETZEVA TI, APTULA AO, BENFENATI E, CRONIN MTD, GINI G, et coll. Description of the electronic structure of organic chemicals using semiempirical and ab initio methods for development of toxicological QSARs.
J Chem Inf Model. 2005;
45:106- 114

[7] NETZEVA TI, GALLEGOS SALINER A, WORTH AP. Comparison of the applicability domain of a quantitative structure-activity relationship for estrogenicity with a large chemical inventory.
Env Tox Chem. 2006;
25:1223- 1230

[8] THOMSEN M, RASMUSSEN AG, CARLSEN L. SAR/QSAR approaches to solubility, partitioning and sorption of phthalates.
Chemosphere. 1999;
38:2613- 2624

→ Aller vers SYNTHESE