Phtalates
2011
| ANALYSE |
40-
Mécanismes d’action
De nombreux résultats semblent indiquer que les récepteurs nucléaires PPAR (peroxysome proliferator activated receptor) sont des cibles privilégiées des phtalates chez les mammifères. Chez les poissons téléostéens ou chez les amphibiens, un certain nombre de pistes et notamment les gènes induits après une exposition à certains phtalates (DEHP), sont cohérents avec un effet possible via les PPAR mais cela n’est pas encore été étayé directement par des résultats tangibles.
Principales cibles des phtalates chez les mammifères
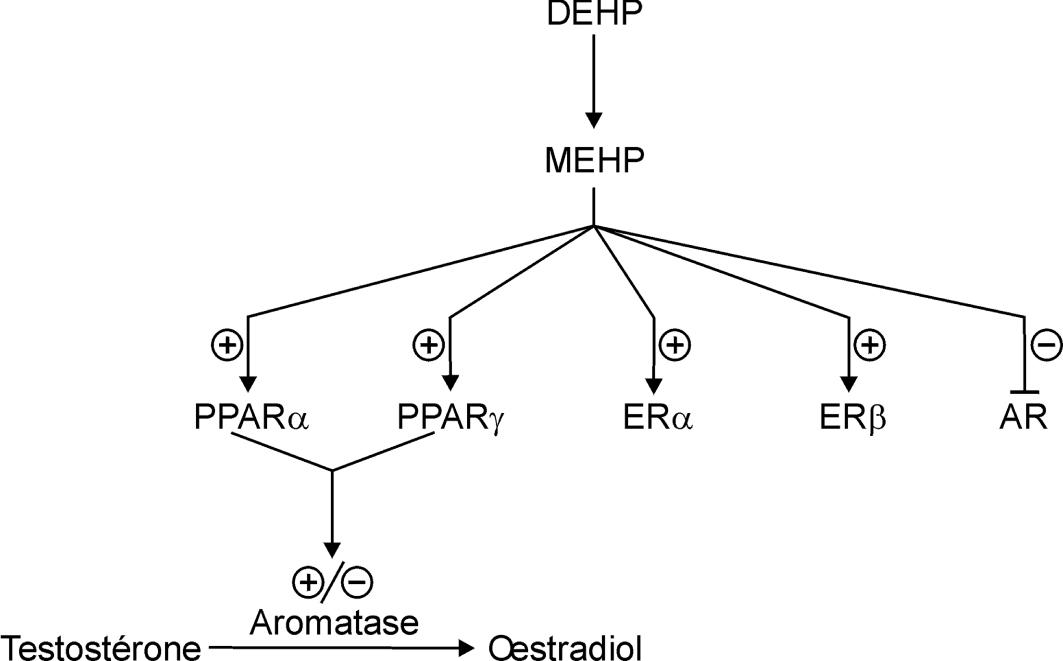
Les cibles principales des phtalates parmi les récepteurs nucléaires sont les récepteurs PPAR α et γ. Les récepteurs des œstrogènes α et β, le récepteur des androgènes, les récepteurs des xénobiotiques CAR (constitutive activated receptor) et PXR (pregnan X receptor) ont été également identifiés comme des médiateurs possibles des effets de ces molécules.
Récepteurs PPAR
Les phtalates les plus actifs sur les récepteurs PPAR sont le DEHP et son métabolite le MEHP, le BBP, le dibutylbenzyl-phtalate (DBBP) et le DIBP.
Le groupe de recherche de W. Whali (un des spécialistes mondiaux des PPAR) a récemment étudié les effets du MEHP sur les récepteurs PPAR γ et α (Desvergne et coll., 2009 ). Cette équipe a démontré que le MEHP était un agoniste partiel de PPARγ (SnuRM ou SPPARM pour selective PPAR modulator) (Feige et coll., 2007
). Cette équipe a démontré que le MEHP était un agoniste partiel de PPARγ (SnuRM ou SPPARM pour selective PPAR modulator) (Feige et coll., 2007 ) et que son activité était plus faible sur le PPARγ de souris que sur le PPARγ humain. La nature agoniste partielle du MEHP a été confirmée par le fait que PPARγ interagit différemment avec des coactivateurs de récepteurs nucléaires selon qu’il est lié à la rosiglitazone ou au MEHP. Cependant, dans un modèle de lignée cellulaire humaine, le MEHP induit l’adipogénèse à une dose à peine 100 fois plus élevée que la rosiglitazone, le ligand de référence pharmaceutique de PPARγ.
) et que son activité était plus faible sur le PPARγ de souris que sur le PPARγ humain. La nature agoniste partielle du MEHP a été confirmée par le fait que PPARγ interagit différemment avec des coactivateurs de récepteurs nucléaires selon qu’il est lié à la rosiglitazone ou au MEHP. Cependant, dans un modèle de lignée cellulaire humaine, le MEHP induit l’adipogénèse à une dose à peine 100 fois plus élevée que la rosiglitazone, le ligand de référence pharmaceutique de PPARγ.
 ). Cette équipe a démontré que le MEHP était un agoniste partiel de PPARγ (SnuRM ou SPPARM pour selective PPAR modulator) (Feige et coll., 2007
). Cette équipe a démontré que le MEHP était un agoniste partiel de PPARγ (SnuRM ou SPPARM pour selective PPAR modulator) (Feige et coll., 2007 ) et que son activité était plus faible sur le PPARγ de souris que sur le PPARγ humain. La nature agoniste partielle du MEHP a été confirmée par le fait que PPARγ interagit différemment avec des coactivateurs de récepteurs nucléaires selon qu’il est lié à la rosiglitazone ou au MEHP. Cependant, dans un modèle de lignée cellulaire humaine, le MEHP induit l’adipogénèse à une dose à peine 100 fois plus élevée que la rosiglitazone, le ligand de référence pharmaceutique de PPARγ.
) et que son activité était plus faible sur le PPARγ de souris que sur le PPARγ humain. La nature agoniste partielle du MEHP a été confirmée par le fait que PPARγ interagit différemment avec des coactivateurs de récepteurs nucléaires selon qu’il est lié à la rosiglitazone ou au MEHP. Cependant, dans un modèle de lignée cellulaire humaine, le MEHP induit l’adipogénèse à une dose à peine 100 fois plus élevée que la rosiglitazone, le ligand de référence pharmaceutique de PPARγ.Le groupe de W. Whali a également montré que le MEHP en interagissant avec PPARα induisait une carcinogenèse hépatique chez la souris (Feige et coll., 2010 ). Dans cette étude, ils ont montré que le MEHP n’entraînait pas d’obésité chez la souris. Ce manque d’effet obésogène chez les rongeurs pourrait être dû au fait que l’activation de PPARα provoque l’oxydation hépatique des acides gras. En revanche, dans les souris exprimant un PPARα humain, l’obésité est observée car le DEHP (ou son métabolite actif le MEHP) n’induit pas l’oxydation hépatique. Ces différences d’effets observés entre PPARα murin et humain au niveau de l’oxydation hépatique pourraient être dues à la nature d’agoniste partiel du MEHP.
). Dans cette étude, ils ont montré que le MEHP n’entraînait pas d’obésité chez la souris. Ce manque d’effet obésogène chez les rongeurs pourrait être dû au fait que l’activation de PPARα provoque l’oxydation hépatique des acides gras. En revanche, dans les souris exprimant un PPARα humain, l’obésité est observée car le DEHP (ou son métabolite actif le MEHP) n’induit pas l’oxydation hépatique. Ces différences d’effets observés entre PPARα murin et humain au niveau de l’oxydation hépatique pourraient être dues à la nature d’agoniste partiel du MEHP.
 ). Dans cette étude, ils ont montré que le MEHP n’entraînait pas d’obésité chez la souris. Ce manque d’effet obésogène chez les rongeurs pourrait être dû au fait que l’activation de PPARα provoque l’oxydation hépatique des acides gras. En revanche, dans les souris exprimant un PPARα humain, l’obésité est observée car le DEHP (ou son métabolite actif le MEHP) n’induit pas l’oxydation hépatique. Ces différences d’effets observés entre PPARα murin et humain au niveau de l’oxydation hépatique pourraient être dues à la nature d’agoniste partiel du MEHP.
). Dans cette étude, ils ont montré que le MEHP n’entraînait pas d’obésité chez la souris. Ce manque d’effet obésogène chez les rongeurs pourrait être dû au fait que l’activation de PPARα provoque l’oxydation hépatique des acides gras. En revanche, dans les souris exprimant un PPARα humain, l’obésité est observée car le DEHP (ou son métabolite actif le MEHP) n’induit pas l’oxydation hépatique. Ces différences d’effets observés entre PPARα murin et humain au niveau de l’oxydation hépatique pourraient être dues à la nature d’agoniste partiel du MEHP.Autres cibles
Des résultats contradictoires ont été obtenus en fonction du composé (MEHP ou DiBP) sur l’expression du gène de l’aromatase dans l’ovaire. La transcription de celui-ci pouvant être activée ou réprimée et aboutir à une augmentation ou une diminution des œstrogènes (LoveKamp-Swan et coll., 2003 ; Boberg et coll., 2008
; Boberg et coll., 2008 ). Cet effet pourrait être relayé par un des récepteurs PPAR (Latini et coll., 2008
). Cet effet pourrait être relayé par un des récepteurs PPAR (Latini et coll., 2008 ). Cependant, des travaux récents ont indiqué que l’effet des phtalates sur les enzymes de la stéroïdogenèse ne passait pas uniquement par PPAR mais pourrait être partiellement médié par le récepteur nucléaire CAR et éventuellement PXR (DeKeyser et coll., 2009
). Cependant, des travaux récents ont indiqué que l’effet des phtalates sur les enzymes de la stéroïdogenèse ne passait pas uniquement par PPAR mais pourrait être partiellement médié par le récepteur nucléaire CAR et éventuellement PXR (DeKeyser et coll., 2009 ; Eveillard et coll., 2009
; Eveillard et coll., 2009 ; Ren et coll., 2010
; Ren et coll., 2010 ). Dans le testicule fœtal de souris en culture avec ou sans LH (13,5 et 18,5 jpc), le MEHP inhibe fortement l’expression de Cyp19A1, le gène de l’aromatase (Lehriaki et coll., 2009
). Dans le testicule fœtal de souris en culture avec ou sans LH (13,5 et 18,5 jpc), le MEHP inhibe fortement l’expression de Cyp19A1, le gène de l’aromatase (Lehriaki et coll., 2009 ). Cet effet n’est pas corrélé avec la synthèse de testostérone et la production d’œstrogène n’a pas été dosée dans ce modèle, ni l’implication des PPAR recherchée.
). Cet effet n’est pas corrélé avec la synthèse de testostérone et la production d’œstrogène n’a pas été dosée dans ce modèle, ni l’implication des PPAR recherchée.
 ; Boberg et coll., 2008
; Boberg et coll., 2008 ). Cet effet pourrait être relayé par un des récepteurs PPAR (Latini et coll., 2008
). Cet effet pourrait être relayé par un des récepteurs PPAR (Latini et coll., 2008 ). Cependant, des travaux récents ont indiqué que l’effet des phtalates sur les enzymes de la stéroïdogenèse ne passait pas uniquement par PPAR mais pourrait être partiellement médié par le récepteur nucléaire CAR et éventuellement PXR (DeKeyser et coll., 2009
). Cependant, des travaux récents ont indiqué que l’effet des phtalates sur les enzymes de la stéroïdogenèse ne passait pas uniquement par PPAR mais pourrait être partiellement médié par le récepteur nucléaire CAR et éventuellement PXR (DeKeyser et coll., 2009 ; Eveillard et coll., 2009
; Eveillard et coll., 2009 ; Ren et coll., 2010
; Ren et coll., 2010 ). Dans le testicule fœtal de souris en culture avec ou sans LH (13,5 et 18,5 jpc), le MEHP inhibe fortement l’expression de Cyp19A1, le gène de l’aromatase (Lehriaki et coll., 2009
). Dans le testicule fœtal de souris en culture avec ou sans LH (13,5 et 18,5 jpc), le MEHP inhibe fortement l’expression de Cyp19A1, le gène de l’aromatase (Lehriaki et coll., 2009 ). Cet effet n’est pas corrélé avec la synthèse de testostérone et la production d’œstrogène n’a pas été dosée dans ce modèle, ni l’implication des PPAR recherchée.
). Cet effet n’est pas corrélé avec la synthèse de testostérone et la production d’œstrogène n’a pas été dosée dans ce modèle, ni l’implication des PPAR recherchée.Parmi les récepteurs nucléaires, les récepteurs des œstrogènes (ER) et des androgènes (AR) sont également des cibles des phtalates (figure 40.1 ). En effet, les phtalates sont des activateurs de faible affinité des récepteurs des œstrogènes (Ghisari et coll., 2009
). En effet, les phtalates sont des activateurs de faible affinité des récepteurs des œstrogènes (Ghisari et coll., 2009 ) et des anti-androgènes de très faible affinité in vitro (Stroheker et coll., 2005
) et des anti-androgènes de très faible affinité in vitro (Stroheker et coll., 2005 ; Kruger et coll., 2008
; Kruger et coll., 2008 ) et in vivo (Jarfelt et coll., 2005
) et in vivo (Jarfelt et coll., 2005 ).
).
 ). En effet, les phtalates sont des activateurs de faible affinité des récepteurs des œstrogènes (Ghisari et coll., 2009
). En effet, les phtalates sont des activateurs de faible affinité des récepteurs des œstrogènes (Ghisari et coll., 2009 ) et des anti-androgènes de très faible affinité in vitro (Stroheker et coll., 2005
) et des anti-androgènes de très faible affinité in vitro (Stroheker et coll., 2005 ; Kruger et coll., 2008
; Kruger et coll., 2008 ) et in vivo (Jarfelt et coll., 2005
) et in vivo (Jarfelt et coll., 2005 ).
).En résumé, la perturbation endocrine des phtalates semble être majoritairement due à leur activité d’agonistes des récepteurs PPAR (alpha et gamma). L’effet majeur des phtalates pourrait être une inhibition de l’expression de l’aromatase médiée majoritairement par l’intermédiaire des récepteurs PPAR. Cet effet antiœstrogénique peut être partiellement compensé par l’activation des récepteurs des œstrogènes et au contraire potentialisé par l’inhibition du récepteur des androgènes.
Il est intéressant de constater que les cibles des phtalates sont (pour certaines) différentes de celles du bisphénol A. Ce constat renforce l’hypothèse que la perturbation endocrine pourrait résulter de l’action d’un cocktail de molécules agissant sur de nombreuses cibles.
Cibles chez les poissons téléostéens et chez les amphibiens
Plusieurs articles suggèrent une régulation de plusieurs enzymes du métabolisme par les phtalates chez diverses espèces (voir par exemple Ortiz-Zarragoitia et coll., 2006 ), de façon tout à fait cohérente via les PPAR mais le lien direct n’est pas encore fait et c’est à l’évidence une direction de recherche très prometteuse.
), de façon tout à fait cohérente via les PPAR mais le lien direct n’est pas encore fait et c’est à l’évidence une direction de recherche très prometteuse.
 ), de façon tout à fait cohérente via les PPAR mais le lien direct n’est pas encore fait et c’est à l’évidence une direction de recherche très prometteuse.
), de façon tout à fait cohérente via les PPAR mais le lien direct n’est pas encore fait et c’est à l’évidence une direction de recherche très prometteuse.Trois types de récepteurs nucléaires différents ont fait l’objet d’investigations quant à leur rôle éventuel de médiateurs des effets des phtalates dans les espèces aquatiques : les récepteurs des œstrogènes (ER), des androgènes (AR) et des hormones thyroïdiennes (TR). Il faut noter que d’autres cibles, notamment vis-à-vis de récepteurs membranaires comme le récepteur GABA, ont été récemment évoquées chez le xénope sans qu’aucune confirmation ne soit venue renforcer ces données préliminaires (Yang et coll., 2007 ).
).
 ).
).En ce qui concerne la liaison avec les récepteurs des œstrogènes, de nombreuses données suggèrent que les phtalates sont faiblement œstrogéniques chez les poissons téléostéens et les amphibiens. La capacité de plusieurs phtalates (DEHP et BBP) à déplacer le ligand naturel (17β-œstradiol) marqué du ERα de truite a été mise en évidence dès 1995 par Jobling et coll. (1995 ). Cet effet est visible à des concentrations élevées d’au moins 50 μM. Un effet similaire a été observé chez le xénope pour le DEP (Lutz et Kloas, 1999
). Cet effet est visible à des concentrations élevées d’au moins 50 μM. Un effet similaire a été observé chez le xénope pour le DEP (Lutz et Kloas, 1999 ) et pour le DBP sur le récepteur ERα de vairon (Pimephales promelas) (Rider et coll., 2009
) et pour le DBP sur le récepteur ERα de vairon (Pimephales promelas) (Rider et coll., 2009 ). De façon cohérente avec ces données suggérant une faible interaction avec les récepteurs des œstrogènes, le BBP a été démontré capable de se fixer faiblement à la protéine de transport des stéroïdes (sex-steroid binding protein) de la truite arc-en-ciel.
). De façon cohérente avec ces données suggérant une faible interaction avec les récepteurs des œstrogènes, le BBP a été démontré capable de se fixer faiblement à la protéine de transport des stéroïdes (sex-steroid binding protein) de la truite arc-en-ciel.
 ). Cet effet est visible à des concentrations élevées d’au moins 50 μM. Un effet similaire a été observé chez le xénope pour le DEP (Lutz et Kloas, 1999
). Cet effet est visible à des concentrations élevées d’au moins 50 μM. Un effet similaire a été observé chez le xénope pour le DEP (Lutz et Kloas, 1999 ) et pour le DBP sur le récepteur ERα de vairon (Pimephales promelas) (Rider et coll., 2009
) et pour le DBP sur le récepteur ERα de vairon (Pimephales promelas) (Rider et coll., 2009 ). De façon cohérente avec ces données suggérant une faible interaction avec les récepteurs des œstrogènes, le BBP a été démontré capable de se fixer faiblement à la protéine de transport des stéroïdes (sex-steroid binding protein) de la truite arc-en-ciel.
). De façon cohérente avec ces données suggérant une faible interaction avec les récepteurs des œstrogènes, le BBP a été démontré capable de se fixer faiblement à la protéine de transport des stéroïdes (sex-steroid binding protein) de la truite arc-en-ciel.Un certain nombre d’indications suggèrent une capacité des phtalates à induire l’expression de la vitellogénine chez les poissons ou les amphibiens, ce qui est un test classique d’effet œstrogénique mais ces données indiquent toutes un effet assez faible voire franchement négatif (Harries et coll., 2000 ; Metcalfe et coll., 2001 ; Nozaka et coll., 2004
; Nozaka et coll., 2004 ; Nomura et coll., 2006
; Nomura et coll., 2006 ; Barse et coll., 2007
; Barse et coll., 2007 ). Si une interaction entre les phtalates et les récepteurs des œstrogènes semble pouvoir être mise en évidence in vitro, sa pertinence in vivo est loin d’être démontrée. De fait, Legler et coll. (2002
). Si une interaction entre les phtalates et les récepteurs des œstrogènes semble pouvoir être mise en évidence in vitro, sa pertinence in vivo est loin d’être démontrée. De fait, Legler et coll. (2002 ) en utilisant une lignée transgénique de zebrafish de type ERE-Luc concluent que le DEHP n’a pas d’activité œstrogénique significative in vivo.
) en utilisant une lignée transgénique de zebrafish de type ERE-Luc concluent que le DEHP n’a pas d’activité œstrogénique significative in vivo.
 ; Nozaka et coll., 2004
; Nozaka et coll., 2004 ; Nomura et coll., 2006
; Nomura et coll., 2006 ; Barse et coll., 2007
; Barse et coll., 2007 ). Si une interaction entre les phtalates et les récepteurs des œstrogènes semble pouvoir être mise en évidence in vitro, sa pertinence in vivo est loin d’être démontrée. De fait, Legler et coll. (2002
). Si une interaction entre les phtalates et les récepteurs des œstrogènes semble pouvoir être mise en évidence in vitro, sa pertinence in vivo est loin d’être démontrée. De fait, Legler et coll. (2002 ) en utilisant une lignée transgénique de zebrafish de type ERE-Luc concluent que le DEHP n’a pas d’activité œstrogénique significative in vivo.
) en utilisant une lignée transgénique de zebrafish de type ERE-Luc concluent que le DEHP n’a pas d’activité œstrogénique significative in vivo.En ce qui concerne les androgènes, même si les phtalates semblent avoir un effet à plusieurs niveaux sur le métabolisme des hormones stéroïdes, notamment au niveau de l’aromatase (Thibaut et Porte, 2004 ; Patyna et coll., 2006
; Patyna et coll., 2006 ; Ortiz-Zarragoitia et coll., 2006
; Ortiz-Zarragoitia et coll., 2006 ), aucune donnée ne vient étayer la thèse d’une fixation directe de l’un des phtalates sur les récepteurs des androgènes de poissons téléostéens ou sur celui des amphibiens. Des données de modélisation structurale in silico suggèrent que cela pourrait être possible pour le BBP mais elles n’ont reçu à ce jour aucune confirmation expérimentale (Wu et coll., 2010
), aucune donnée ne vient étayer la thèse d’une fixation directe de l’un des phtalates sur les récepteurs des androgènes de poissons téléostéens ou sur celui des amphibiens. Des données de modélisation structurale in silico suggèrent que cela pourrait être possible pour le BBP mais elles n’ont reçu à ce jour aucune confirmation expérimentale (Wu et coll., 2010 ).
).
 ; Patyna et coll., 2006
; Patyna et coll., 2006 ; Ortiz-Zarragoitia et coll., 2006
; Ortiz-Zarragoitia et coll., 2006 ), aucune donnée ne vient étayer la thèse d’une fixation directe de l’un des phtalates sur les récepteurs des androgènes de poissons téléostéens ou sur celui des amphibiens. Des données de modélisation structurale in silico suggèrent que cela pourrait être possible pour le BBP mais elles n’ont reçu à ce jour aucune confirmation expérimentale (Wu et coll., 2010
), aucune donnée ne vient étayer la thèse d’une fixation directe de l’un des phtalates sur les récepteurs des androgènes de poissons téléostéens ou sur celui des amphibiens. Des données de modélisation structurale in silico suggèrent que cela pourrait être possible pour le BBP mais elles n’ont reçu à ce jour aucune confirmation expérimentale (Wu et coll., 2010 ).
).En ce qui concerne une interaction possible avec les récepteurs des hormones thyroïdiennes, il a été montré que le BBP est capable d’interférer avec la fixation de la T3 sur la transthyrétine de caille (Ishihara et coll., 2003 ). Les données de Sugiyama et coll. (2005
). Les données de Sugiyama et coll. (2005 ) chez le xénope suggèrent que plusieurs phtalates (DCHP, BBP, DBP) montrent une action antagoniste in vivo sur une réponse aux hormones thyroïdiennes à des concentrations de l’ordre de 1 à 10 μM. Ces molécules sont également capables de diminuer l’activité du récepteur TRβ induite par la T3 ce qui pourrait suggérer que les TR sont des cibles des phtalates même si à notre connaissance une fixation directe n’est pas encore démontrée.
) chez le xénope suggèrent que plusieurs phtalates (DCHP, BBP, DBP) montrent une action antagoniste in vivo sur une réponse aux hormones thyroïdiennes à des concentrations de l’ordre de 1 à 10 μM. Ces molécules sont également capables de diminuer l’activité du récepteur TRβ induite par la T3 ce qui pourrait suggérer que les TR sont des cibles des phtalates même si à notre connaissance une fixation directe n’est pas encore démontrée.
 ). Les données de Sugiyama et coll. (2005
). Les données de Sugiyama et coll. (2005 ) chez le xénope suggèrent que plusieurs phtalates (DCHP, BBP, DBP) montrent une action antagoniste in vivo sur une réponse aux hormones thyroïdiennes à des concentrations de l’ordre de 1 à 10 μM. Ces molécules sont également capables de diminuer l’activité du récepteur TRβ induite par la T3 ce qui pourrait suggérer que les TR sont des cibles des phtalates même si à notre connaissance une fixation directe n’est pas encore démontrée.
) chez le xénope suggèrent que plusieurs phtalates (DCHP, BBP, DBP) montrent une action antagoniste in vivo sur une réponse aux hormones thyroïdiennes à des concentrations de l’ordre de 1 à 10 μM. Ces molécules sont également capables de diminuer l’activité du récepteur TRβ induite par la T3 ce qui pourrait suggérer que les TR sont des cibles des phtalates même si à notre connaissance une fixation directe n’est pas encore démontrée.Une expérience récente de microarrays menée chez la carpe a permis de mettre en évidence les gènes régulés dans le foie suite à une exposition au DBP (Moens et coll., 2006 ). De façon intéressante, le profil de gène régulé par cette molécule est distinct des 13 autres molécules testées (ligands naturels et divers perturbateurs endocriniens) ce qui suggère que le mode d’action des phtalates est bien distinct de celui de ces autres molécules, et notamment des xéno-œstrogènes classiques. Dans une analyse de clustering, les effets du DBP sont en fait rapprochés de ceux des hormones thyroïdiennes, ce qui renforce la notion que les TR pourraient être des cibles intéressantes. Notons toutefois qu’aucun ligand des PPAR n’a été intégré dans cette expérience et que cette cible, reste, au vu des données disponibles chez les mammifères, la plus crédible actuellement.
). De façon intéressante, le profil de gène régulé par cette molécule est distinct des 13 autres molécules testées (ligands naturels et divers perturbateurs endocriniens) ce qui suggère que le mode d’action des phtalates est bien distinct de celui de ces autres molécules, et notamment des xéno-œstrogènes classiques. Dans une analyse de clustering, les effets du DBP sont en fait rapprochés de ceux des hormones thyroïdiennes, ce qui renforce la notion que les TR pourraient être des cibles intéressantes. Notons toutefois qu’aucun ligand des PPAR n’a été intégré dans cette expérience et que cette cible, reste, au vu des données disponibles chez les mammifères, la plus crédible actuellement.
 ). De façon intéressante, le profil de gène régulé par cette molécule est distinct des 13 autres molécules testées (ligands naturels et divers perturbateurs endocriniens) ce qui suggère que le mode d’action des phtalates est bien distinct de celui de ces autres molécules, et notamment des xéno-œstrogènes classiques. Dans une analyse de clustering, les effets du DBP sont en fait rapprochés de ceux des hormones thyroïdiennes, ce qui renforce la notion que les TR pourraient être des cibles intéressantes. Notons toutefois qu’aucun ligand des PPAR n’a été intégré dans cette expérience et que cette cible, reste, au vu des données disponibles chez les mammifères, la plus crédible actuellement.
). De façon intéressante, le profil de gène régulé par cette molécule est distinct des 13 autres molécules testées (ligands naturels et divers perturbateurs endocriniens) ce qui suggère que le mode d’action des phtalates est bien distinct de celui de ces autres molécules, et notamment des xéno-œstrogènes classiques. Dans une analyse de clustering, les effets du DBP sont en fait rapprochés de ceux des hormones thyroïdiennes, ce qui renforce la notion que les TR pourraient être des cibles intéressantes. Notons toutefois qu’aucun ligand des PPAR n’a été intégré dans cette expérience et que cette cible, reste, au vu des données disponibles chez les mammifères, la plus crédible actuellement.
En conclusion, l’ensemble de la bibliographie étudiée indique que les récepteurs nucléaires PPAR sont les cibles privilégiées des phtalates. Cependant, les phtalates sont également capables d’activer les récepteurs des œstrogènes et d’inhiber le récepteur des androgènes. Les différents pthalates n’ont pas le même profil d’interaction avec les différents récepteurs nucléaires. Ainsi, le MEHP est essentiellement actif sur PPARγ et n’interagit pas avec les récepteurs ER. Au contraire, le BBP ou le DBP sont actifs sur les ER et interagissent très peu avec PPARγ. Des études in vivo sur des modèles de souris Knock Out (déficientes) pour un ou plusieurs de ces récepteurs mériteraient d’être réalisées avec des phtalates de profil différent (MEHP versus BBP par exemple).
Bibliographie
[1] BARSE AV, CHAKRABARTI T, GHOSH TK, PAL AK, JADHAO SB. Endocrine disruption and metabolic changes following exposure of Cyprinus carpio to diethyl phthalate.
Pest Biochem Physiol. 2007;
88:36- 42

[2] BOBERG J, METZDORFF S, WORTZIGER R, AXELSTAD M, BROKKEN L, et coll. Impact of diisobutyl phthalate and other PPAR agonists on steroidogenesis and plasma insulin and leptin levels in fetal rats.
Toxicology. 2008;
250:75- 81

[3] DEKEYSER JG, STAGLIANO MC, AUERBACH SS, PRABHU KS, JONES AD, OMIECINSKI CJ. Di(2-ethylhexyl) phthalate is a highly potent agonist for the human constitutive androstane receptor splice variant CAR2.
Mol Pharmacol. 2009;
75:1005- 1013

[4] DESVERGNE B, FEIGE JN, CASALS-CASAS C. PPAR-mediated activity of phthalates: A link to the obesity epidemic?.
Mol Cell Endocrinol. 2009;
304:43- 48

[5] EVEILLARD A, LASSERRE F, DE TAYRAC M, POLIZZI A, CLAUS S, et coll. Identification of potential mechanisms of toxicity after di-(2-ethylhexyl)-phthalate (DEHP) adult exposure in the liver using a systems biology approach.
Toxicol Appl Pharmacol. 2009;
236:282- 292

[6] FEIGE JN, GELMAN L, ROSSI D, ZOETE V, MÉTIVIER R, et coll. The endocrine disruptor monoethyl-hexyl-phthalate is a selective peroxisome proliferator-activated receptor gamma modulator that promotes adipogenesis.
J Biol Chem. 2007;
282:19152- 19166

[7] FEIGE JN, GERBER A, CASALS-CASAS C, YANG Q, WINKLER C et coll. The pollutant diethylhexyl phthalate regulates hepatic energy metabolism via species-specific PPARalpha-dependent mechanisms.
Environ Health Perspect. 2010;
118:234- 241

[8] GHISARI M, BONEFELD-JORGENSEN EC. Effects of plasticizers and their mixtures on estrogen receptor and thyroid hormone functions.
Toxicol Lett. 2009;
189:67- 77

[9] ISHIHARA A, NISHIYAMA N, SUGIYAMA S, YAMAUCHI K. The effect of endocrine disrupting chemicals on thyroid hormone binding to Japanese quail transthyretin and thyroid hormone receptor.
Gen Comp Endocrinol. 2003;
134:36- 43

[10] JARFELT K, DALGAARD M, HASS U, BORCH J, JACOBSEN H, LADEFOGED O. Antiandrogenic effects in male rats perinatally exposed to a mixture of di(2-ethylhexyl) phthalate and di(2-ethylhexyl) adipate.
Reprod Toxicol. 2005;
19:505- 515

[11] JOBLING S, REYNOLDS T, WHITE R, PARKER MG, SUMPTER JP. A variety of environmentally persistent chemicals, including some phthalate plasticizers, are weakly estrogenic.
Environ Health Perspect. 1995;
103:582- 587

[12] KRUGER T, LONG M, BONEFELD-JORGENSEN EC. Plastic components affect the activation of the aryl hydrocarbon and the androgen receptor.
Toxicology. 2008;
246:112- 123

[13] LATINI G, SCODITTI E, VERROTTI A, DE FC, MASSARO M. Peroxisome proliferator-activated receptors as mediators of phthalate-induced effects in the male and female reproductive tract: epidemiological and experimental evidence.
PPAR Res. 2008;
2008:- 359267

[14] LEGLER J, ZEINSTRA LM, SCHUITEMAKER F, LANSER PH, BOGERD J, et coll. Comparison of in vivo and in vitro reporter gene assays for short-term screening of estrogenic activity.
Environ Sci Technol. 2002;
36:4410- 4415

[15] LEHRAIKI A, RACINE C, KRUST A, HABERT R, LEVACHER C. Phthalates impair germ cell number in the mouse fetal testis by an androgen- and estrogen-independent mechanism.
Toxicol Sci. 2009;
111:372- 382

[16] LOVEKAMP-SWAN T, JETTEN AM, DAVIS BJ. Dual activation of PPARalpha and PPARgamma by mono-(2-ethylhexyl) phthalate in rat ovarian granulosa cells.
Mol Cell Endocrinol. 2003;
201:133- 141

[17] LUTZ I, KLOAS W. Amphibians as a model to study endocrine disruptors: I. Environmental pollution and estrogen receptor binding.
Sci Total Environ. 1999;
225:49- 57

[18] METCALFE CD, METCALFE TL, KIPARISSIS Y, KOENIG BG, KHAN C, et coll. Estrogenic potency of chemicals detected in sewage treatment plant effluents as determined by in vivo assays with Japanese medaka (Oryzias latipes).
Environ Toxicol Chem. 2001;
20:297- 308

[19] MOENS LN, VAN DER VEN K, VAN REMORTEL P, DEL-FAVERO J, DE COEN WM. Expression profiling of endocrine-disrupting compounds using a customized Cyprinus carpio cDNA microarray.
Toxicol Sci. 2006;
93:298- 310

[20] NOMURA Y, MITSUI N, BHAWAL UK, SAWAJIRI M, TOOI O, et coll. Estrogenic activity of phthalate esters by in vitro VTG assay using primary-cultured Xenopus hepatocytes.
Dent Mater J. 2006;
25:533- 537

[21] NOZAKA T, ABE T, MATSUURA T, SAKAMOTO T, NAKANO N, et coll. Development of vitellogenin assay for endocrine disrupters using medaka (Oryzias latipes).
Environ Sci. 2004;
11:99- 121

[22] ORTIZ-ZARRAGOITIA M, TRANT JM, CAJARAVILLE MP. Effects of dibutylphthalate and ethynylestradiol on liver peroxisomes, reproduction, and development of zebrafish (Danio rerio).
Environ Toxicol Chem. 2006;
25:2394- 2404

[23] PATYNA PJ, BROWN RP, DAVI RA, LETINSKI DJ, THOMAS PE, et coll. Hazard evaluation of diisononyl phthalate and diisodecyl phthalate in a Japanese medaka multigenerational assay.
Ecotoxicol Environ Saf. 2006;
65:36- 47

[24] REN H, ALEKSUNES LM, WOOD C, VALLANAT B, GEORGE MH, et coll. Characterization of Peroxisome Proliferator-Activated Receptor {alpha} (PPAR{alpha}) - Independent Effects of PPAR{alpha} Activators in the Rodent Liver: Di-(2-ethylhexyl) phthalate Also Activates the Constitutive Activated Receptor.
Toxicol Sci. 2010;
113:45- 59

[25] RIDER CV, HARTIG PC, CARDON MC, WILSON VS. Comparison of chemical binding to recombinant fathead minnow and human estrogen receptors alpha in whole cell and cell-free binding assays.
Environ Toxicol Chem. 2009;
28:2175- 2181

[26] STROHEKER T, CABATON N, NOURDIN G, REGNIER JF, LHUGUENOT JC, et coll. Evaluation of anti-androgenic activity of di-(2-ethylhexyl) phthalate.
Toxicology. 2005;
208:115- 121

[27] SUGIYAMA S, SHIMADA N, MIYOSHI H, YAMAUCHI K. Detection of thyroid system-disrupting chemicals using in vitro and in vivo screening assays in Xenopus laevis.
Toxicol Sci. 2005;
88:367- 374

[28] THIBAUT R, PORTE C. Effects of endocrine disrupters on sex steroid synthesis and metabolism pathways in fish.
J Steroid Biochem Mol Biol. 2004;
92:485- 494

[29] WU B, FORD T, GU JD, ZHANG XX, LI AM, CHENG SP. Computational studies of interactions between endocrine disrupting chemicals and androgen receptor of different vertebrate species.
Chemosphere. 2010;
80:535- 541

[30] YANG L, MILUTINOVIC PS, BROSNAN RJ, EGER EI 2ND, SONNER JM. The plasticizer di(2-ethylhexyl) phthalate modulates gamma-aminobutyric acid type A and glycine receptor function.
Anesth Analg. 2007;
105:393- 396

→ Aller vers SYNTHESE