Évolutions temporelles des altérations de la fonction de reproduction humaine
2011
| ANALYSE |
1-
Malformations génitales du garçon, hypospadias et cryptorchidie
 ). Pour de telles malformations génitales, qui n’engagent pas le pronostic vital de l’enfant, les données de registre sont généralement considérées comme étant, lorsqu’elles existent, moins exhaustives que les données de registre concernant le cancer (Toppari et coll., 2001
). Pour de telles malformations génitales, qui n’engagent pas le pronostic vital de l’enfant, les données de registre sont généralement considérées comme étant, lorsqu’elles existent, moins exhaustives que les données de registre concernant le cancer (Toppari et coll., 2001 ; Dolk et coll., 2004
; Dolk et coll., 2004 ). Ceci entraîne des difficultés d’interprétation et des controverses car il est difficile d’établir avec certitude à partir de ces registres s’il existe bien réellement une augmentation des malformations congénitales de l’appareil génital du garçon. Un point très important et pas toujours souligné dans les études ou les revues sur le sujet est que les critères définissant la cryptorchidie et l’hypospadias peuvent varier considérablement en fonction des équipes, et que, par exemple, s’agissant de l’hypospadias, les cas les moins graves puissent être déclarés dans certains registres et pas dans d’autres. Concernant la cryptorchidie, son caractère évolutif avec l’âge (descente spontanée du testicule par exemple) ajoute à cette complexité.
). Ceci entraîne des difficultés d’interprétation et des controverses car il est difficile d’établir avec certitude à partir de ces registres s’il existe bien réellement une augmentation des malformations congénitales de l’appareil génital du garçon. Un point très important et pas toujours souligné dans les études ou les revues sur le sujet est que les critères définissant la cryptorchidie et l’hypospadias peuvent varier considérablement en fonction des équipes, et que, par exemple, s’agissant de l’hypospadias, les cas les moins graves puissent être déclarés dans certains registres et pas dans d’autres. Concernant la cryptorchidie, son caractère évolutif avec l’âge (descente spontanée du testicule par exemple) ajoute à cette complexité. et 1.III
et 1.III ) et de la cryptorchidie (tableaux 1.II
) et de la cryptorchidie (tableaux 1.II et 1.III
et 1.III ).
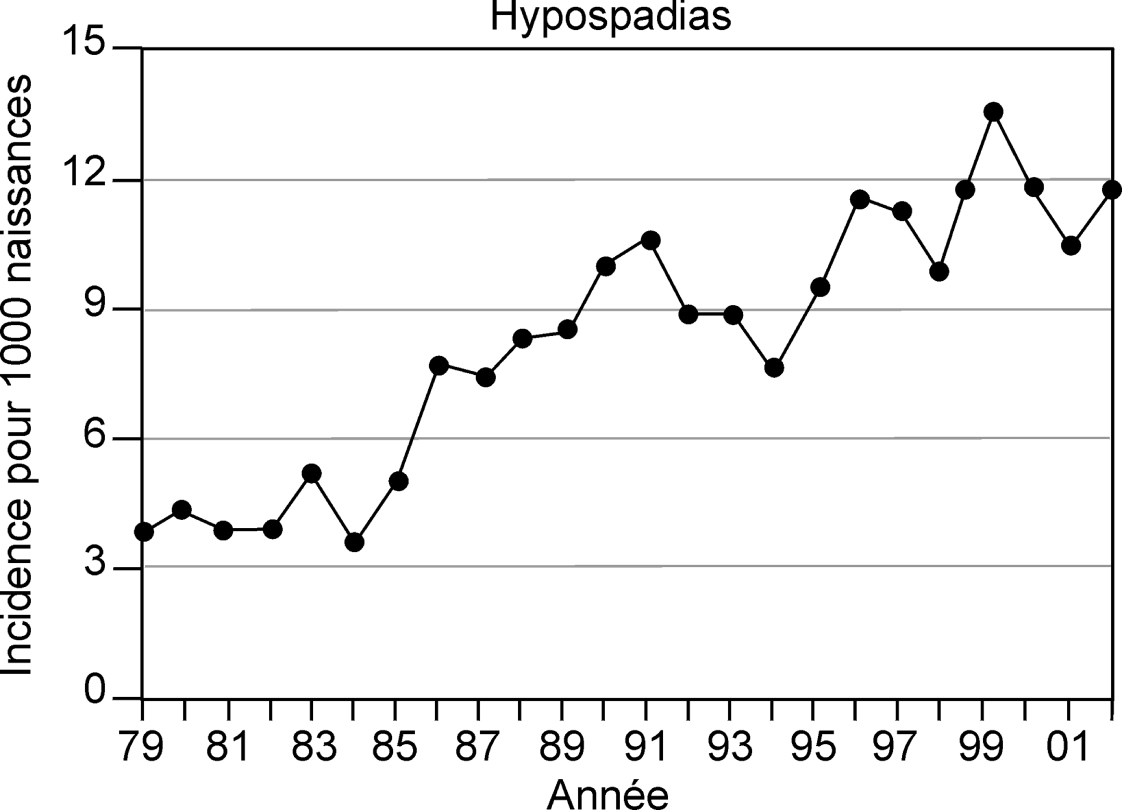
).Hypospadias
 ), bien que ce degré d’hypospadias soit très commun dans les enquêtes en population (Virtanen et coll., 2001
), bien que ce degré d’hypospadias soit très commun dans les enquêtes en population (Virtanen et coll., 2001 ; Pierik et coll., 2002
; Pierik et coll., 2002 ; Boisen et coll., 2005
; Boisen et coll., 2005 ). Selon les registres, la prévalence de l’hypospadias en Europe serait comprise entre 0,8 et 1,7 pour 1 000 naissances des deux sexes ou 1,6 à 3,4 pour 1 000 nouveau-nés mâles, soit des taux considérablement plus faibles que ceux rapportés dans les études prospectives de population de plusieurs pays (tableau 1.I
). Selon les registres, la prévalence de l’hypospadias en Europe serait comprise entre 0,8 et 1,7 pour 1 000 naissances des deux sexes ou 1,6 à 3,4 pour 1 000 nouveau-nés mâles, soit des taux considérablement plus faibles que ceux rapportés dans les études prospectives de population de plusieurs pays (tableau 1.I ). Au sein d’un même pays, comme le Danemark, en fonction des critères utilisés, des taux différents d’hypospadias à la naissance sont rapportés dans les registres des hôpitaux (0,52 %) en comparaison à une étude prospective (1,03 % à la naissance ; Boisen et coll., 2005
). Au sein d’un même pays, comme le Danemark, en fonction des critères utilisés, des taux différents d’hypospadias à la naissance sont rapportés dans les registres des hôpitaux (0,52 %) en comparaison à une étude prospective (1,03 % à la naissance ; Boisen et coll., 2005 ).
). ).
). ; Porter et coll., 2005
; Porter et coll., 2005 ; Nassar et coll., 2007
; Nassar et coll., 2007 ) (tableau 1.III
) (tableau 1.III ). La standardisation récente des critères de diagnostic et d’enregistrement des cas peut avoir pour conséquence une augmentation artificielle dans l’évolution de la prévalence.
). La standardisation récente des critères de diagnostic et d’enregistrement des cas peut avoir pour conséquence une augmentation artificielle dans l’évolution de la prévalence.Tableau 1.I Données sur la fréquence de l’hypospadias et son évolution au cours des années récentes
|
Étude
Lieu
|
Période
|
Nombre de cas/ naissance
|
Prévalence
(%)
|
Taux pour 10 000 naissances
|
Évolution
|
|---|---|---|---|---|---|
|
Hollande
|
1998-2000
|
53/ 7 292
|
0,73
|
38
|
?
|
|
État de Washington (États-Unis)
|
1987-2002
|
-
|
-
|
46 en 1987
50 en 2002
|
=
|
|
État de Californie (États-Unis)
|
1984-1997
|
5 838/1 791 659
|
0,33
|
-
|
= (1989-1997)
|
|
Danemark
|
1977-2005
|
3 490/ 921 745
|
0,38
|
-
|
↑
|
|
Hangzhou (Chine)
|
1998-2007
|
0,90
|
-
|
↑
|
|
|
Nord de l’Angleterre (Royaume-Uni)
|
1993-2000
|
-
|
-
|
31
|
↑
|
|
Espagne
|
1978-2001
|
0,35
|
↓
|
= stable ; ↓ évolution générale à la baisse ; ↑ évolution générale à la hausse
Cryptorchidie
 et 1.III
et 1.III ). Il faut noter que tous les registres de malformations en Europe n’enregistrent pas les cryptorchidies. Des données indicatives mais indirectes, comme les taux publiés d’orchidopexie ne sont généralement pas en faveur d’une augmentation du nombre d’opérations pour fixation de testicules non descendus, indiquant même qu’il pourrait y avoir une diminution de cette chirurgie depuis les années 1990 (Toledano et coll., 2003
). Il faut noter que tous les registres de malformations en Europe n’enregistrent pas les cryptorchidies. Des données indicatives mais indirectes, comme les taux publiés d’orchidopexie ne sont généralement pas en faveur d’une augmentation du nombre d’opérations pour fixation de testicules non descendus, indiquant même qu’il pourrait y avoir une diminution de cette chirurgie depuis les années 1990 (Toledano et coll., 2003 ; Richiardi et coll., 2009
; Richiardi et coll., 2009 ). Ces différences pourraient être dues en partie à des changements dans les stratégies de traitement et/ou à la disponibilité de ces traitements au cours du temps. Toutefois, l’explication la plus probable réside dans le fait que les formes légères de la cryptorchidie, comme les testicules placés haut dans le scrotum et les testicules descendant spontanément dans les premières années de la vie, ne sont pas traitées chirurgicalement. Or, ce sous-groupe de cryptorchidies semble être celui qui a la plus forte augmentation dans le temps, au moins au Danemark. Dans ce pays, la prévalence de la cryptorchidie à la naissance est de 9 % (Boisen et coll., 2004
). Ces différences pourraient être dues en partie à des changements dans les stratégies de traitement et/ou à la disponibilité de ces traitements au cours du temps. Toutefois, l’explication la plus probable réside dans le fait que les formes légères de la cryptorchidie, comme les testicules placés haut dans le scrotum et les testicules descendant spontanément dans les premières années de la vie, ne sont pas traitées chirurgicalement. Or, ce sous-groupe de cryptorchidies semble être celui qui a la plus forte augmentation dans le temps, au moins au Danemark. Dans ce pays, la prévalence de la cryptorchidie à la naissance est de 9 % (Boisen et coll., 2004 ), un pourcentage bien supérieur à celui déclaré par d’autres pays (par exemple les Pays-Bas, Pierik et coll., 2005
), un pourcentage bien supérieur à celui déclaré par d’autres pays (par exemple les Pays-Bas, Pierik et coll., 2005 ) où il apparaît cependant que la recherche de cette malformation est classiquement faite chez le petit enfant et non en période néonatale. Ainsi, la comparaison directe des taux de prévalence rapportés devrait être effectuée avec prudence, car il existe des variations importantes d’une étude à l’autre pour ce qui est de la sélection de la population, de la détermination des cas, du suivi de ces cas et des critères de classement de la cryptorchidie. Concernant ce dernier point, certaines études incluent, dans l’estimation du nombre de cas, les testicules en position haute dans le scrotum comme une forme mineure de cryptorchidie (John Radcliffe Hospital Cryporchidism Study Group, 1992 ; Berkowitz et coll., 1993
) où il apparaît cependant que la recherche de cette malformation est classiquement faite chez le petit enfant et non en période néonatale. Ainsi, la comparaison directe des taux de prévalence rapportés devrait être effectuée avec prudence, car il existe des variations importantes d’une étude à l’autre pour ce qui est de la sélection de la population, de la détermination des cas, du suivi de ces cas et des critères de classement de la cryptorchidie. Concernant ce dernier point, certaines études incluent, dans l’estimation du nombre de cas, les testicules en position haute dans le scrotum comme une forme mineure de cryptorchidie (John Radcliffe Hospital Cryporchidism Study Group, 1992 ; Berkowitz et coll., 1993 ; Boisen et coll., 2004
; Boisen et coll., 2004 ), tandis que d’autres n’incluent pas de tels cas (Pierik et coll., 2005
), tandis que d’autres n’incluent pas de tels cas (Pierik et coll., 2005 ). Une étude conjointe sur la prévalence de la cryptorchidie et de l’hypospadias au Danemark et en Finlande pour laquelle il a été apporté un soin particulier dans la normalisation des définitions et la standardisation des observations cliniques entre observateurs a permis de montrer sans équivoque que la prévalence de la cryptorchidie et de l’hypospadias était significativement plus élevée au Danemark qu’en Finlande (Virtanen et coll., 2001
). Une étude conjointe sur la prévalence de la cryptorchidie et de l’hypospadias au Danemark et en Finlande pour laquelle il a été apporté un soin particulier dans la normalisation des définitions et la standardisation des observations cliniques entre observateurs a permis de montrer sans équivoque que la prévalence de la cryptorchidie et de l’hypospadias était significativement plus élevée au Danemark qu’en Finlande (Virtanen et coll., 2001 ; Boisen et coll., 2004
; Boisen et coll., 2004 , 2005
, 2005 ). Avec une approche standardisée, les auteurs ont de plus montré que les jeunes danois en bonne santé avaient une courbe de croissance testiculaire, des volumes testiculaires et des concentrations sériques d’inhibine B plus faibles que les jeunes finlandais. Selon les auteurs, ces résultats observés chez le petit enfant pourraient avoir des conséquences sur la fonction testiculaire adulte et être possiblement un des éléments expliquant les différences dans le même sens de la qualité du sperme ou des taux de LH ou d’inhibine B observés chez les jeunes adultes danois et finlandais (Jorgensen et coll., 2002
). Avec une approche standardisée, les auteurs ont de plus montré que les jeunes danois en bonne santé avaient une courbe de croissance testiculaire, des volumes testiculaires et des concentrations sériques d’inhibine B plus faibles que les jeunes finlandais. Selon les auteurs, ces résultats observés chez le petit enfant pourraient avoir des conséquences sur la fonction testiculaire adulte et être possiblement un des éléments expliquant les différences dans le même sens de la qualité du sperme ou des taux de LH ou d’inhibine B observés chez les jeunes adultes danois et finlandais (Jorgensen et coll., 2002 ).
).Tableau 1.II Données sur la fréquence de la cryptorchidie et son évolution au cours des années récentes
|
Étude
Lieu
|
Période
|
Fréquence
%
|
Évolution
|
Commentaires
Biais possibles
|
|---|---|---|---|---|
|
Écosse (Royaume-Uni)
|
1961-1985
|
1,4
|
↑
|
+
|
|
État de Victoria (Australie)
|
1999-2006
|
-
|
↓
|
+
évolution des orchidopexies
|
|
Nord de l’Angleterre
|
1993-2000
|
0,8
|
↓
|
Tableau 1.III Données sur hypospadias (toutes formes) et cryptorchidie (2 testicules non en place à la naissance ou au moins un testicule non descendu à 1 an) (d’après International Clearinghouse Centre for Birth Defects, 2007 )
)
|
Lieu
|
Hypospadias
|
Cryptorchidie
|
||
|---|---|---|---|---|
|
Taux pour 10 000 en 2005
|
Tendance évolutive
|
Taux pour 10 000 en 2005
|
Tendance évolutive
|
|
|
Europe du nord
| ||||
|
Finlande
|
12,1a 2,8b
| |||
|
Norvège
|
14,7
|
↑
|
26,1
|
↑
|
|
Suède
|
19,6
|
=
| ||
|
Europe de l’est
| ||||
|
Rep Tchèque
|
33,2
|
↑
|
non spécifié
|
↑
|
|
Hongrie
|
28,7
|
=
|
18,5
|
=
|
|
Slovaquie
|
20,9
|
=
|
7,8
|
↑
|
|
Russie
|
14,5
|
13,5
| ||
|
Ukraine
|
3,8
|
48,1
| ||
|
Europe de l’ouest
| ||||
|
Angleterre+Pays de Galles
|
7,5
|
=
|
0,2
|
=
|
|
Pays de Galles
|
12,6
|
↓
|
1,5
|
↓
|
|
Irlande
|
6,8
|
∩
| ||
|
Allemagne (Saxe)
|
8,7
|
∩
|
16,3
|
∩
|
|
Pays-Bas (Nord)
|
18,9
|
∪
|
non spécifié
|
↓
|
|
France (Rhône Alpes)
|
10,0
|
↑
| ||
|
France (Paris)
|
13,0
|
↑
| ||
|
France (Strasbourg)
|
18,9
|
=
| ||
|
Espagne
|
1,3
|
=
|
2,4
|
=
|
|
Italie (Nord Est)
|
3,4
|
↑
| ||
|
Italie (Toscane)
|
7,1
|
∪
|
2,0
|
∩
|
|
Italie (Emilie Romagne)
|
14,9
|
↓
| ||
|
Italie (Campanie)
|
5,0
|
↑
| ||
|
Italie (Sicile)
|
24,6
|
↑
|
16,5
|
↑
|
|
Malte
|
23,3
|
↑
| ||
|
Amériques
| ||||
|
Canada (Alberta)
|
22,4
|
=
|
22,7
|
=
|
|
Canada (Colombie Britannique)
|
18,6
|
↓
|
30,2
|
∩
|
|
Canada (National)
|
28,0
|
=
|
36,5
|
=
|
|
États-Unis (Texas)
|
16,3
|
=
|
10,5
|
↑
|
|
États-Unis (Atlanta)
|
3,7
|
↑
|
3,3
|
↓
|
|
États-Unis (Utah)
|
6,3
| |||
|
Mexique
|
5,8
|
=
| ||
|
Costa Rica
|
4,9
|
8,4
| ||
|
Cuba
|
10,1
|
↓
|
3,5
|
=
|
|
Chili
|
6,9
|
9,1
| ||
|
Amérique du sud
|
4,1
|
=
|
7,1
|
↑
|
|
Autres régions
| ||||
|
Iran
|
6,8
|
27,0
| ||
|
Israel
|
29,2
| |||
|
Chine (Pékin)
|
0,9
|
0,2
| ||
|
Chine (Prov de Sichuan)
|
4,6
|
↑
|
1,3
|
↑
|
|
Japon
|
4,6
|
↑
| ||
|
Australie (Victoria)
|
33,5
|
↑
|
54,8
|
↑
|
|
Australie (Ouest)
|
24,6
|
↓
|
16,5
|
∪
|
|
Nouvelle-Zélande
|
23,9c
|
↑
|
58,9
|
∩
|
= stable ; ↓ évolution générale à la baisse ; ∪ tendance à une augmentation après une période de baisse ; ∩ tendance à la baisse après une période d’augmentation ; ↑ évolution générale à la hausse
a Formes majeures ; b Formes mineures ; c
Hypospadias+Epispadias* (* http://www.icbdsr.org/filebank/documents/ar2005/Report2007.pdf)
Données françaises sur l’hypospadias et la cryptorchidie
 ). Les données de l’ICBD confirment cette tendance pour les régions parisienne et Rhône-Alpes, mais pas en Alsace où il semble y avoir une stabilité. Il faut noter que c’est en Alsace que des taux les plus élevés sont observés en 2007, avec 19 pour 10 000 versus 13 pour 10 000 en Ile-de-France et 10 pour 10 000 en Rhône-Alpes (tableau 1.III
). Les données de l’ICBD confirment cette tendance pour les régions parisienne et Rhône-Alpes, mais pas en Alsace où il semble y avoir une stabilité. Il faut noter que c’est en Alsace que des taux les plus élevés sont observés en 2007, avec 19 pour 10 000 versus 13 pour 10 000 en Ile-de-France et 10 pour 10 000 en Rhône-Alpes (tableau 1.III ). À notre connaissance, il n’y a pas de données extensives de registres ou d’études ciblées en France ou dans certaines de ces régions permettant d’estimer l’incidence et les tendances évolutives de la cryptorchidie au cours des dernières décennies. Cependant, une étude de l’InVS parue en 2004 (Rambourg Schepens et coll., 2004
). À notre connaissance, il n’y a pas de données extensives de registres ou d’études ciblées en France ou dans certaines de ces régions permettant d’estimer l’incidence et les tendances évolutives de la cryptorchidie au cours des dernières décennies. Cependant, une étude de l’InVS parue en 2004 (Rambourg Schepens et coll., 2004 ) concernant les différentes régions françaises a montré pour des garçons de moins de 7 ans et selon les régions, des taux de cryptorchidies opérées variant de 17 à 32/10 000 et des taux d’hypospadias opérés variant de 4,9 à 12,8/10 000. Sur la période 1998 à 2001, les taux calculés sont relativement stables, certaines régions présentant cependant une augmentation régulière. Pour la période considérée, une variabilité géographique de ces malformations génitales est mise en évidence. Les régions présentant les taux les plus élevés sont celles qui ont une forte densité de population (régions de l’est et une région de l’ouest de la France).
) concernant les différentes régions françaises a montré pour des garçons de moins de 7 ans et selon les régions, des taux de cryptorchidies opérées variant de 17 à 32/10 000 et des taux d’hypospadias opérés variant de 4,9 à 12,8/10 000. Sur la période 1998 à 2001, les taux calculés sont relativement stables, certaines régions présentant cependant une augmentation régulière. Pour la période considérée, une variabilité géographique de ces malformations génitales est mise en évidence. Les régions présentant les taux les plus élevés sont celles qui ont une forte densité de population (régions de l’est et une région de l’ouest de la France). ).
).Syndrome de dysgénésie testiculaire, intérêt et limites du concept
 ) se fonde sur la juxtaposition de données cliniques, épidémiologiques et de données scientifiques indiquant l’origine fœtale du cancer du testicule, le lien établi entre malformations génitales chez les garçons nouveau-nés et les troubles de la reproduction à l’âge adulte, et sur des observations provenant d’études expérimentales chez l’animal. Notamment la juxtaposition des données épidémiologiques concernant les pays voisins que sont le Danemark et la Finlande indiquent un parallèle entre ces deux pays pour toutes les anomalies concernées, les fréquences les plus élevées d’hypospadias, de cryptorchidie, de cancer du testicule et la plus médiocre qualité du sperme étant observées au Danemark. Toutes ces données suggèrent que la période prénatale constituerait la phase la plus vulnérable où une anomalie de la différenciation des testicules entraînerait des effets néfastes permanents. Cette anomalie du développement testiculaire pourrait être la conséquence de défauts ou polymorphismes génétiques, d’une exposition à des facteurs nocifs de l’environnement, de facteurs liés au style de vie, de troubles de la croissance intra-utérine et possiblement, de plusieurs de ces facteurs à la fois.
) se fonde sur la juxtaposition de données cliniques, épidémiologiques et de données scientifiques indiquant l’origine fœtale du cancer du testicule, le lien établi entre malformations génitales chez les garçons nouveau-nés et les troubles de la reproduction à l’âge adulte, et sur des observations provenant d’études expérimentales chez l’animal. Notamment la juxtaposition des données épidémiologiques concernant les pays voisins que sont le Danemark et la Finlande indiquent un parallèle entre ces deux pays pour toutes les anomalies concernées, les fréquences les plus élevées d’hypospadias, de cryptorchidie, de cancer du testicule et la plus médiocre qualité du sperme étant observées au Danemark. Toutes ces données suggèrent que la période prénatale constituerait la phase la plus vulnérable où une anomalie de la différenciation des testicules entraînerait des effets néfastes permanents. Cette anomalie du développement testiculaire pourrait être la conséquence de défauts ou polymorphismes génétiques, d’une exposition à des facteurs nocifs de l’environnement, de facteurs liés au style de vie, de troubles de la croissance intra-utérine et possiblement, de plusieurs de ces facteurs à la fois. ). Les auteurs montrent : que la cryptorchidie et l’hypospadias sont associés, mais que le degré de l’association est aussi important voire plus important avec d’autres malformations congénitales non génitales ; qu’il y a une association entre cryptorchidie et infertilité mais qu’il n’existe jusqu’à présent pas de preuve d’une cause commune ; qu’il existe un lien entre cryptorchidie et cancer du testicule, une partie de l’association pouvant être due à des causes communes ; qu’il n’existe pas de données démontrant une association entre l’hypospadias et l’infertilité ou le cancer du testicule ; que l’on ne connaît pas de facteurs de risque communs pour les quatre composantes du TDS (en dehors de la situation où la cause est génétique). Les auteurs concluent que les études épidémiologiques disponibles ne sont pas en faveur d’une fréquence importante du TDS en l’absence de preuves d’associations liées à une cause commune. Dans un article récent (Jorgensen et coll., 2010
). Les auteurs montrent : que la cryptorchidie et l’hypospadias sont associés, mais que le degré de l’association est aussi important voire plus important avec d’autres malformations congénitales non génitales ; qu’il y a une association entre cryptorchidie et infertilité mais qu’il n’existe jusqu’à présent pas de preuve d’une cause commune ; qu’il existe un lien entre cryptorchidie et cancer du testicule, une partie de l’association pouvant être due à des causes communes ; qu’il n’existe pas de données démontrant une association entre l’hypospadias et l’infertilité ou le cancer du testicule ; que l’on ne connaît pas de facteurs de risque communs pour les quatre composantes du TDS (en dehors de la situation où la cause est génétique). Les auteurs concluent que les études épidémiologiques disponibles ne sont pas en faveur d’une fréquence importante du TDS en l’absence de preuves d’associations liées à une cause commune. Dans un article récent (Jorgensen et coll., 2010 ), les auteurs du concept du TDS reviennent sur la description originale du TDS en précisant : que le concept n’implique nullement que tous les hommes atteints d’une des anomalies présentent les quatre anomalies ; que les hommes les moins touchés peuvent simplement avoir une hypospermatogenèse, seuls les plus gravement touchés pouvant présenter tous les symptômes ; que selon eux, la majorité des cas de cancers du testicule à cellules germinales et les cryptorchidies sont probablement liés au TDS ; que l’hypospadias isolé ne représente qu’une fraction des cas en rapport avec le TDS tout comme la médiocre qualité spermatique. Quoi qu’il en soit, au cours des dernières années, le TDS, en tant que concept global, a eu des conséquences favorables en inspirant de nouvelles pistes de recherche, notamment des études chez l’homme recherchant de possibles associations entre chacune des anomalies du TDS et des expositions chimiques mesurées dans les fluides biologiques.
), les auteurs du concept du TDS reviennent sur la description originale du TDS en précisant : que le concept n’implique nullement que tous les hommes atteints d’une des anomalies présentent les quatre anomalies ; que les hommes les moins touchés peuvent simplement avoir une hypospermatogenèse, seuls les plus gravement touchés pouvant présenter tous les symptômes ; que selon eux, la majorité des cas de cancers du testicule à cellules germinales et les cryptorchidies sont probablement liés au TDS ; que l’hypospadias isolé ne représente qu’une fraction des cas en rapport avec le TDS tout comme la médiocre qualité spermatique. Quoi qu’il en soit, au cours des dernières années, le TDS, en tant que concept global, a eu des conséquences favorables en inspirant de nouvelles pistes de recherche, notamment des études chez l’homme recherchant de possibles associations entre chacune des anomalies du TDS et des expositions chimiques mesurées dans les fluides biologiques.Bibliographie



























→ Aller vers SYNTHESE