| |
| Med Sci (Paris). 41(3): 253–259. doi: 10.1051/medsci/2025024.Physiopathologie de la faiblesse neuromusculaire acquise en réanimation durant le sepsis Pauline Michel-Flutot,1* Stéphane Vinit,2 and Arnaud Mansart3 1Department of Neuroscience, Vickie and Jack Farber Institute for Neuroscience, Sidney Kimmel Medical College, Thomas Jefferson University
,
Philadelphia
,
États-Unis 2Université Paris-Saclay, UVSQ, Inserm U1179, END-ICAP
,
Versailles
,
France 3Université Paris-Saclay, UVSQ, Inserm U1173, Infection et Inflammation (2I)
,
Versailles
,
France |
Vignette (© L. Castellano).
Le sepsis (ou septicémie) est la forme la plus grave des infections et représente une des principales causes de décès en unités de soins intensifs [
1
]. Parmi ces patients, 50 à 75 % sont atteints de faiblesse neuromusculaire acquise en réanimation (FNAR) et ceux en choc septique voient leurs symptômes aggravés [
2
]. Si tous les muscles ne sont pas affectés, il semblerait que les muscles proximaux soient davantage touchés que les muscles distaux [
3
]. En particulier, l’atteinte des muscles respiratoires se traduit par un risque accru de déficience respiratoire et une difficulté à sevrer les patients de l’assistance ventilatoire. Pour les survivants, ces atteintes perdurent sur le long terme et impactent fortement leur qualité de vie [
4
].
En clinique, cette faiblesse neuromusculaire est diagnostiquée différemment selon l’état d’éveil des patients. Chez les patients conscients, la force de préhension peut être mesurée à l’aide d’un dynamomètre [
5
], et plusieurs scores peuvent être utilisés. À titre d’exemple, l’échelle développée par le
Medical Research Council
(MRC) évalue la force de cinq groupes de muscles et donne un score total sur 60. Un score inférieur à 48 reflète une faiblesse musculaire [
6
]. Pour les patients sédatés, des tests électrophysiologiques ne nécessitant pas d’acte volontaire ont été développés à des fins prognostiques, tels que l’électromyographie musculaire. Aussi, la stimulation magnétique non-invasive des nerfs permet d’induire une réponse musculaire qui peut être enregistrée
via
une électrode de surface ou via l’apposition d’un cathéter enregistrant les différences de pression endotrachéale dans le cas d’une contraction des muscles respiratoires [
7
]. Ces méthodes de diagnostic requièrent cependant la présence de spécialistes capables d’effectuer les évaluations et les analyses fonctionnelles. La mise en évidence des symptômes de la FNAR peut également être réalisée par des tests anatomiques,
via
une évaluation de la masse musculaire, par imagerie, par résonance magnétique, par ultrasonographie ou encore par tomographie, et ainsi aider à son diagnostic [
8
].
L’utilisation de modèles précliniques reproduisant les symptômes du sepsis a permis de comprendre en partie les processus responsables de cette faiblesse musculaire. Ces modèles possèdent chacun leurs avantages et leurs inconvénients, raison pour laquelle ils sont utilisés de façon complémentaire. À titre d’exemple, les modèles basés sur une infection polymicrobienne cherchent à mimer l’infection systémique observée chez les patients en choc septique (modèle dit de « ligature et perforation du
cæcum
»), et les modèles basés sur une injection d’endotoxine (modèle LPS pour [lipopolysaccharides]) simulent une inflammation systémique sévère. Le plus souvent, les études réalisées sur ces modèles se concentrent sur le muscle diaphragmatique [
10
–
16
] ou les muscles des membres [
9
,
17
] et peuvent être associées à une immobilisation musculaire, ce qui aggrave les symptômes de façon comparable à ce qui est observé en clinique [
9
].
La fonction neuromusculaire étant dépendante de plusieurs compartiments tissulaires, l’impact de cette inflammation systémique a été évalué sur un certain nombre de processus physiologiques, cellulaires et moléculaires. Cette revue résume les principaux mécanismes connus, responsables de la survenue de la FNAR dans différents compartiments, et qui ont été mis en évidence dans divers modèles précliniques de sepsis ou
in vitro
.
|
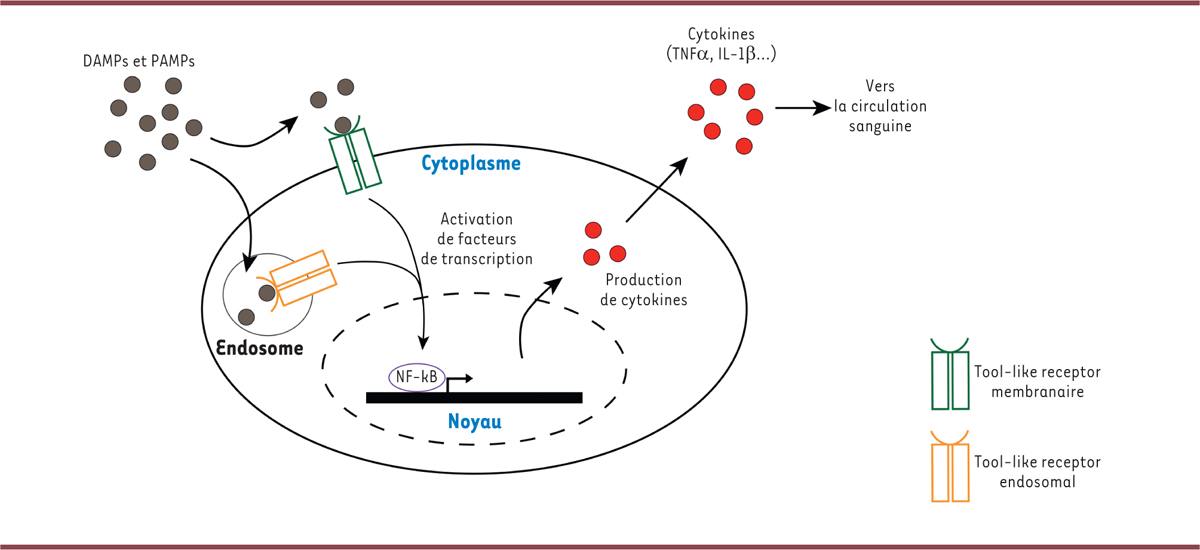
Lors d’une infection de l’organisme hôte par un organisme pathogène, il y a une activation de l’immunité innée
via
la fixation des PAMP (
pathogen-associated molecular patterns
) et DAMP (
damage-associated molecular patterns
) sur les TLR (
Toll-like receptors
) [
18
] (
→
).
(→) Voir m/s n° 1, 2007, page 67
Cette fixation conduit au déclenchement de cascades de signalisation intracellulaires qui augmentent l’expression de facteurs de transcription tels que le facteur NF-κB (
nuclear factor-
κ
B
) et aboutissent à la production de cytokines, dont le TNFα (
tumor necrosis factor
α) et l’IL-1β (
interleukin 1
β), de façon systémique (
Figure 1
). Ces cytokines sont de petites molécules impliquées dans la signalisation cellulaire. Elles sont les principales actrices de la « tempête cytokinique » observée dans le sepsis. La production de ces cytokines a divers effets, dont la production de radicaux libres (oxyde nitrique ou NO, superoxydes, peroxynitrites, peroxyde d’hydrogène, etc.) dans les organes et les muscles. Dans le muscle, le TNFα induit une augmentation des espèces réactives de l’oxygène (ROS) par la mitochondrie, menant à un accroissement de l’activité de la voie NF-κB localement [
13
], créant ainsi une boucle de rétrocontrôle positif au niveau musculaire. Il en découle une activité accrue des systèmes de protéolyse [
19
]. De plus, des études ont montré une corrélation directe entre la concentration de TNFα et la réduction de la force musculaire, en particulier
ex vivo
dans le diaphragme de souris, et ce, sans modification de l’anatomie du muscle [
10
], supportant l’implication des cytokines pro-inflammatoires dans la réduction de la force musculaire observée lors du sepsis. La circulation systémique de cytokines conduit également à une production locale, par les cellules musculaires, de cytokines appelées myokines [
19
]. Ainsi, dans un modèle murin d’infection bactérienne par
Pseudomonas aeruginosa
, l’expression de myokines (TNF-α, IL-1α, IL-1β, IL-6 et IL-18) est accrue dans le diaphragme de façon dose-dépendante. L’administration d’IL-10 (dont le récepteur est présent sur les cellules du muscle diaphragmatique) permet de réduire la production de certaines de ces myokines et d’améliorer la force de contraction du diaphragme des souris infectées [
16
]. Ces myokines pourraient donc participer de façon paracrine aux processus inflammatoires ayant lieu dans le muscle, ainsi qu’à leur amplification, et conduire aussi à un processus de chimio-attractivité qui induit la migration et l’accumulation de cellules de l’immunité dans le muscle [
20
].
 | Figure 1
Induction de la production de cytokines par les DAMP et PAMP
.
La fixation des PAMP (
pathogen-associated molecular patterns
) et des DAMP (
damage-associated molecular patterns
) sur les récepteurs TLR (
Toll-like receptors
) à la membrane des cellules, ou dans la cellule (à la membrane des endosomes) conduit à l’activation de voies de signalisation intracellulaires, et
in fine
à l’activation de facteurs de transcriptions tel que NF-κB. Il en découle une production de cytokines par la cellule, qui vont migrer dans le système circulatoire sanguin et diffuser dans tout l’organisme.
|
|
Augmentation de l’activité protéolytique dans le muscle
La phase aiguë du sepsis est caractérisée par une forte synthèse protéique dans plusieurs organes tels que le foie. Cette synthèse requiert un apport en acides aminés, fournis en partie par les muscles, ceux-ci constituant une réserve de protéines pour le corps. Il en résulte un catabolisme excessif de ces muscles, participant à l’atrophie musculaire observée au cours du sepsis. Celleci se traduit entre autres par une réduction de la densité des filaments d’actine et de myosine, des disques Z et des bandes M dans le sarcomère [
21
] (voir
Encadré
). Les principaux processus responsables reposent sur les systèmes ubiquitine-protéasome, autophagie-lysosome et calpaïnes, processus responsables de la dégradation des protéines et organelles cytoplasmiques [
22
]. FoxO3 (
Forkhead Box Protein O3
) est le régulateur clé de l’homéostasie musculaire. Il est impliqué dans l’activation du système ubiquitine-protéasome et de l’autophagie dans le muscle adulte (FoxO3 régule différentes molécules dont la voie Akt/mTOR) [
23
–
25
] (
→
).
(→) Voir m/s n° 10, 2004, page 856
De plus, certaines calpaïnes, des enzymes impliquées dans la protéolyse, sont aussi connues pour moduler l’activité de FoxO3 [
26
]. Tous ces processus agissent de concert dans le catabolisme musculaire durant le sepsis.
Dans le cadre du sepsis, une série d’études réalisées dans les années 1990 a mis en évidence le rôle du système ubiquitine-protéasome dans l’atrophie musculaire observée durant le sepsis [
27
,
28
]. Une augmentation simultanée de la dégradation des protéines des myofibrilles et de l’activité du système ubiquitine-protéasome a pu être observée dans un modèle de ligature et de perforation du cæcum chez le rat [
27
]. Cette dégradation est contrée dans le muscle de rat
ex vivo
par administration de N-acetyl-L-leucinyl-L-leucinal-L-norleucinal, un inhibiteur de l’activité du protéasome [
28
]. Ce processus serait contrôlé par un groupe de gènes appelés « atrogènes » (
atrophy-related genes
) impliqués dans l’expression de deux ubiquitines ligases nommées atrogin-1 et MuRF1 (
Muscle RING-finger protein-1
) [
22
]. L’augmentation de l’activité de ces atrogènes serait médiée par plusieurs molécules incluant l’IL-6 (voie IL-6/gp130/JAK2/STAT3), dont la concentration augmente lors du sepsis [
29
].
L’autophagie [
30
] (
→
) régule l’homéostasie des protéines et de la masse musculaire afin d’éviter l’accumulation d’agrégats et d’organelles dysfonctionnelles. Un excès d’autophagie résulte en une augmentation du ratio dégradation/synthèse de protéines, et conduit à une atrophie musculaire [
24
]. Des études ont montré que l’autophagie musculaire est accrue dans des modèles précliniques de sepsis [
31
]. Ce processus est associé à une atrophie des fibres musculaires, à une réduction de la contractilité musculaire et à une dysfonction mitochondriale. Cependant, une étude récente a démontré qu’une inactivation de l’autophagie dans les muscles squelettiques aggrave les dysfonctions musculaires et métaboliques, et impacte négativement la survie des souris dans un modèle de ligature et de perforation du
cæcum
[
32
], de façon équivalente à ce qui a été démontré chez des souris saines.
(→) Voir m/s n° 3, 2017, page 305
Les calpaïnes sont des protéases à cystéine (non lysosomales) dont l’activité est dite « dépendante du calcium » [
33
,
34
] (
→
).
(→) Voir m/s n° 3, 2003, page 71 et m/s n° 5, 2016, page 435
Le calcium est le principal activateur de l’activité catalytique des calpaïnes. Il a été démontré que leur activité était augmentée dans le muscle durant le sepsis. Cette augmentation d’activité peut être liée à différents paramètres tels que l’augmentation du calcium intracellulaire, ou encore l’inhibition de la calpastatine
1
[
15
,
35
]. Ces calpaïnes sont impliquées dans la dégradation des myofibrilles du muscle et dans l’augmentation de l’activité du système ubiquitine-protéasome, participant ainsi à l’apparition de l’atrophie musculaire [
35
]. Des études portant plus spécifiquement sur les dysfonctions musculaires diaphragmatiques durant le sepsis ont montré que l’administration d’un inhibiteur spécifique des calpaïnes dans un modèle préclinique endotoxinique (injection systémique de lipopolysaccharides) chez la souris améliore la fonction du muscle diaphragmatique [
15
]. Le même groupe a par la suite montré que la phospholipase A2, dépendante du calcium musculaire, était également impliquée dans cette activation des calpaïnes [
12
], et que celle-ci nécessitait l’activation de la sphingomyélinase neutre
2
par les cytokines pro-inflammatoires dans ce contexte [
14
].
|
Dysfonctions des organites dans les cellules du muscle
Les mitochondries sont une famille d’organites possédant une grande variété de phénotypes, et elles sont impliquées dans différents processus cellulaires, incluant le métabolisme, la production d’espèce réactives à l’oxygène (
Reactive Oxygen Species
ou ROS), la respiration cellulaire, l’homéostasie calcique, l’oxydation et la synthèse de lipides, ou encore la synthèse ou la dégradation de neurotransmetteurs [
36
]. Dans le muscle squelettique, deux principaux phénotypes coexistent : les mitochondries intra fibrillaires et les mitochondries périphériques. Ces deux sous-types diffèrent par leur localisation dans le muscle, leur anatomie, mais aussi par leurs fonctions. À titre d’exemple, dans la cellule musculaire localisées près des vaisseaux en périphérie, les mitochondries périphériques présentent une taille/surface et une activité oxydative plus importantes que les mitochondries intra fibrillaires, localisées entre les myofibrilles
3
[
37
]. Dans le cadre du sepsis, des dysfonctions mitochondriales ont pu être observées dans le muscle, en corrélation avec l’apparition d’une faiblesse musculaire [
11
,
38
]. Ces dysfonctions mitochondriales observées peuvent être diverses, incluant une production excessive de radicaux libres [
39
], une réduction de la quantité de protéines impliquées dans la chaîne de transport des électrons [
40
] ou encore une réduction de l’expression de la protéine MICU1 (
Mitochondrial calcium uptake 1
) impliquée dans la surveillance de la concentration en calcium dans le cytosol, le calcium étant entre autres impliqué dans le couplage excitation-contraction du muscle [
38
]. Une étude plus approfondie des dysfonctions mitochondriales, spécifiques aux différents sous-types de mitochondries présentes dans le muscle, pourrait permettre de préciser les observations faites jusqu’à présent. Ces déficits mitochondriaux touchent également les cellules satellite
4
des muscles impliqués dans la myogenèse musculaire. L’impact sur ce type de cellules souches musculaires résulterait en une régénération musculaire inefficace post-sepsis, pouvant contribuer à la faiblesse musculaire observée, à long terme, dans le cadre du « syndrome post-soins intensifs » [
41
].
|
La structure et la composition du muscle Les muscles sont les unités motrices de notre corps : ils génèrent la force nécessaire à nos mouvements, ils nous permettent de maintenir notre posture et jouent également un rôle essentiel dans la respiration. Pour comprendre leur fonctionnement, il faut d’abord se pencher sur leur structure et leur composition.
Un muscle se compose majoritairement de
fibres musculaires
(ou cellules musculaires), longues et fines, spécialisées dans la contraction, et regroupées en faisceaux de fibres. À l’intérieur de ces
fibres musculaires
, on trouve des
myofibrilles
, elles-mêmes constituées de
sarcomères
, l’unité fondamentale de contraction. Chaque sarcomère est délimité par deux
disques Z
, qui maintiennent les filaments
d’actine
. Au centre de chaque sarcomère, se trouve la
bande M
, où les filaments de
myosine
sont ancrés et stabilisés. L’interaction entre les filaments d’actine et de myosine, régulée par ces structures, permet aux fibres musculaires de se raccourcir (contraction du muscle) ou de s’allonger (relaxation du muscle), produisant ainsi la force nécessaire au mouvement.
Outre les fibres musculaires, le muscle comporte également des
vaisseaux sanguins
(pour assurer l’apport en nutriments et en oxygène, mais aussi d’autres molécules telles que les cytokines inflammatoires), des
nerfs
(pour transmettre l’influx nerveux depuis les motoneurones de la moelle épinière, déclenchant la contraction) et du
tissu conjonctif
(qui soutient et protège les fibres).
Cette organisation complexe permet au muscle de réagir rapidement aux sollicitations et de produire l’énergie mécanique indispensable à toutes les activités de notre quotidien, qu’il s’agisse de soulever un objet, ou encore de marcher.
|
Une étude récente a aussi démontré que le stress du réticulum endoplasmique, observé durant le sepsis, était impliqué dans l’atrophie musculaire. En effet, ce stress conduit à une augmentation de l’activité du système ubiquitine-protéasome via la voie de signalisation IL-6/gp130/JAK2/STAT3 dont les effets sur le muscle ont été discutés précédemment [
42
].
|
Excitabilité et contractibilité musculaire
Les paramètres pouvant impacter la contractilité musculaire sont divers, incluant la modification ultrastructurale et fonctionnelle des cellules musculaires par les processus évoqués plus haut. Une atteinte plus directe des acteurs de la contraction musculaire peut cependant être envisagée dans le cadre du sepsis. L’application d’IL-1α sur des myocytes induit une perméabilisation de la membrane, conduisant à l’entrée d’IL-1α dans la cellule et son interaction avec le récepteur RyR1 (
ryanodine receptor type 1
), impliqué dans la sortie du calcium du réticulum sarcoplasmique [
17
]. Cela conduit à l’inhibition de RyR1 et pourrait, au moins en partie, expliquer le relargage moindre du calcium dans le cytosol observé dans d’autres études [
43
]. Ce processus peut donc jouer un rôle dans la mise en place de la faiblesse musculaire, l’IL-1α étant une des cytokines produites lors du sepsis. Une autre étude a évalué l’excitabilité neuromusculaire dans un modèle de ligature et de perforation du
cæcum
chez la souris. Cinq jours après l’induction du sepsis, la faiblesse musculaire observée n’était due qu’à une détérioration de l’architecture des myofibrilles, car la transmission nerveuse (nerf sciatique) et la jonction neuromusculaire (muscle gastrocnémien) n’étaient pas significativement impactées dans cette étude [
44
]. Les auteurs ont conclu que les déficits de la contraction musculaire semblent être principalement dus à une modification de la structure du muscle en raison de la perte musculaire (via un catabolisme accru comme vu plus haut). Une autre étude a également montré que la réduction de l’excitabilité neuromusculaire était en partie due à une modification de la conductivité de la membrane des cellules musculaires. Au niveau du muscle court fléchisseur des orteils, dans un modèle de ligature et de perforation du
cæcum
chez le rat à 10 jours post-sepsis (considéré comme chronique), la synthèse des canaux sodiques NaV 1.5 est surexprimée, et augmente le seuil de dépolarisation de la membrane des cellules musculaires [
45
].
|
Excitabilité des motoneurones spinaux
Les muscles sont innervés par les nerfs formés par les axones des motoneurones présents dans la moelle épinière. Leur contraction est dépendante de l’activité de ces motoneurones. Un groupe a donc émis l’hypothèse que l’activité des motoneurones spinaux était aussi impactée durant le sepsis et que ce changement d’activité participait à la faiblesse musculaire observée. Dans un modèle préclinique de ligature et de perforation du cæcum de rat, les chercheurs ont démontré que l’excitabilité des motoneurones alpha lombaires était réduite durant le sepsis. Plus précisément, ces motoneurones sont incapables de décharger de façon soutenue en réponse à une dépolarisation constante induite par un courant délivré dans la cellule, contrairement aux motoneurones de rats sains [
46
]. Cette réduction de l’excitabilité est observable jusqu’à au moins un mois post-sepsis, bien que la force de contraction musculaire pouvant être générée par les animaux soit redevenue physiologique [
47
]. Bien qu’ils nécessitent une confirmation dans d’autres modèles de sepsis, ces résultats suggèrent que la faiblesse musculaire observée de façon aiguë, et potentiellement chronique, chez les patients atteints de sepsis serait due, au moins en partie, à une réduction de l’excitabilité des motoneurones. Le même groupe a par la suite démontré que cette réduction était due à une altération du seuil de déclenchement des courants (activés de manière voltage-dépendant), hypothétiquement par une réduction du ratio entre courant entrant et sortant [
48
]. L’administration de lorcaserine, un agoniste des récepteurs sérotoninergiques présents à la membrane des motoneurones, permet d’augmenter leur excitabilité. Les mécanismes moléculaires et cellulaires impliqués dans cette modification d’excitabilité des motoneurones restent cependant à élucider. Une des hypothèses serait une modulation de l’excitabilité des motoneurones
via
des cytokines produites dans le système nerveux central lors du sepsis. Il est connu que les cytokines peuvent affecter l’excitabilité neuronale [
49
]. D’autres facteurs environnementaux, notamment la présence de cellules immunitaires activées (microglies, neutrophiles…) dans un contexte inflammatoire, pourraient également influencer l’activité des motoneurones. Notre groupe a en effet démontré que les neutrophiles infiltrants, ainsi que les cellules microgliales activées, produisaient des pièges extracellulaires dans la moelle épinière dans un modèle préclinique endotoxinique chez la souris (injection systémique de lipopolysaccharides), ceux-ci pouvant avoir des effets délétères sur leur environnement. Leur inhibition permet en effet d’améliorer l’excitabilité neuromusculaire dans ce modèle [
50
]. La façon dont ces pièges extracellulaires interagissent avec les motoneurones spinaux reste cependant à être déterminée.
|
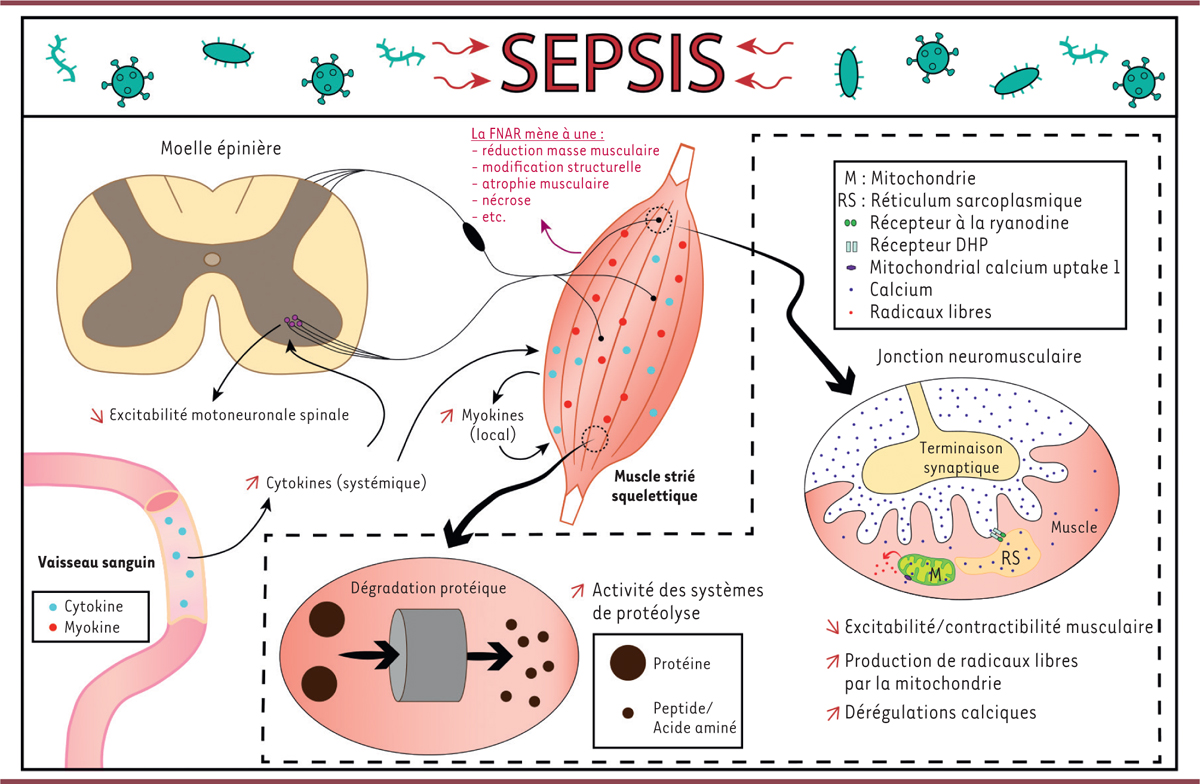
Les études précliniques cherchant à étudier les mécanismes sous-jacents à la faiblesse musculaire qui caractérise la FNAR apportent quelques pistes de réponse, même si les observations réalisées avec ces modèles ne sont pas toujours conformes à ce qui est observé chez les patients. Globalement, ces études semblent indiquer que durant le sepsis, en raison des processus inflammatoires systémiques et locaux, une dégradation protéique ainsi que des modifications moléculaires se produisent dans le muscle. La combinaison de la perte de masse musculaire, des réorganisations structurales, de la réduction de l’excitabilité membranaire et de l’excitabilité motoneuronale, semble être à l’origine de la faiblesse musculaire observée, que ce soit à court terme durant le sepsis (
Figure 2
), ou à plus long terme en post-sepsis. Bien que beaucoup d’études aient tenté d’inhiber ou de renverser certains processus impliqués dans ce phénomène, aucune n’a donné lieu à une thérapeutique transférable chez l’être humain. Les thérapeutiques actuelles ne permettent pas de soigner efficacement l’apparition de cette maladie et ses conséquences à long terme. L’étude des différents compartiments impliqués dans la FNAR, ainsi que des processus et acteurs en jeu, doit se poursuivre afin de comprendre ce phénomène dans sa globalité. Ceci permettra de développer des traitements efficaces, offrant aux patients atteints de sepsis la possibilité de retrouver une qualité de vie comparable à celle qu’ils avaient avant la maladie.
 | Figure 2
Mécanismes de la faiblesse neuromusculaire acquise en réanimation durant le sepsis
.
En condition de sepsis, les cytokines pro-inflammatoires systémiques atteignent, via les vaisseaux sanguins, les différents organes, dont les muscles et la moelle épinière. Ces cytokines induisent alors la mise en place de processus inflammatoires locaux, menant à une faiblesse neuromusculaire acquise en réanimation et dite « multifactorielle » en raison du nombre de compartiments et d’acteurs mis en jeu. Les événements représentés dans l’encadré en pointillés indiquent que ces processus ont lieu dans le muscle.
|
|
Footnotes |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article
|
1.
Evans
L
,
Rhodes
A
,
Alhazzani
W
,
et al.
.
Executive summary : surviving sepsis campaign : international guidelines for the management of sepsis and septic shock 2021.
.
Crit Care Med
.
2021;
;
49
:
:1974.
–
82
.
2.
Fan
E
,
Cheek
F
,
Chlan
L
,
et al.
.
An official american thoracic society clinical practice guideline : the diagnosis of intensive care unit-acquired weakness in adults.
.
Am J Respir Crit Care Med
.
2014;
;
190
:
:1437.
–
46
.
3.
Chen
J
,
Huang
M
.
Intensive care unit-acquired weakness : Recent insights.
.
J Intensive Med
.
2024;
;
4
:
:73.
–
80
.
4.
Odden
AJ
,
Rohde
JM
,
Bonham
C
,
et al.
.
Functional outcomes of general medical patients with severe sepsis.
.
BMC Infect Dis
.
2013;
;
13
:
:588.
.
5.
Ali
NA
,
O’Brien
JM
,
Jr.
,
Hoffmann
SP
,
et al.
.
Acquired weakness, handgrip strength, and mortality in critically ill patients.
.
Am J Respir Crit Care Med
.
2008;
;
178
:
:261.
–
8
.
6.
De Jonghe
B
,
Bastuji-Garin
S
,
Sharshar
T
,
et al.
.
Does ICU-acquired paresis lengthen weaning from mechanical ventilation?
Intensive Care Med
.
2004;
;
30
:
:1117.
–
21
.
7.
Lecronier
M
,
Jung
B
,
Molinari
N
,
et al.
.
Severe but reversible impaired diaphragm function in septic mechanically ventilated patients.
.
Ann Intensive Care
.
2022;
;
12
:
:34.
.
8.
Yoshihara
I
,
Kondo
Y
,
Okamoto
K
,
Tanaka
H
.
Sepsis-associated muscle wasting : a comprehensive review from bench to bedside.
.
Int J Mol Sci
.
2023;
;
24
:
:5040.
.
9.
Laitano
O
,
Pindado
J
,
Valera
I
,
et al.
.
The impact of hindlimb disuse on sepsis-induced myopathy in mice.
.
Physiol Rep
.
2021;
;
9
:
:e14979.
.
10.
Reid
MB
,
Lännergren
J
,
Westerblad
H
.
Respiratory and limb muscle weakness induced by tumor necrosis factor-alpha : involvement of muscle myofilaments.
.
Am J Respir Crit Care Med
.
2002;
;
166
:
:479.
–
84
.
11.
Supinski
GS
,
Wang
L
,
Schroder
EA
,
Callahan
LAP
.
MitoTEMPOL, a mitochondrial targeted antioxidant, prevents sepsis-induced diaphragm dysfunction.
.
Am J Physiol Lung Cell Mol Physiol
.
2020;
;
319
:
:L228.
–
38
.
12.
Supinski
GS
,
Alimov
AP
,
Wang
L
,
et al.
.
Calcium-dependent phospholipase A2 modulates infection-induced diaphragm dysfunction.
.
Am J Physiol Lung Cell Mol Physiol
.
2016;
;
310
:
:L975.
–
84
.
13.
Okazaki
T
,
Liang
F
,
Li
T
,
et al.
.
Muscle-specific inhibition of the classical nuclear factor-κB pathway is protective against diaphragmatic weakness in murine endotoxemia.
.
Crit Care Med
.
2014;
;
42
:
:e501.
–
9
.
14.
Supinski
GS
,
Alimov
AP
,
Wang
L
,
et al.
.
Neutral sphingomyelinase 2 is required for cytokine-induced skeletal muscle calpain activation.
.
Am J Physiol Lung Cell Mol Physiol
.
2015;
;
309
:
:L614.
–
24
.
15.
Supinski
GS
,
Callahan
LA
.
Calpain activation contributes to endotoxin-induced diaphragmatic dysfunction.
.
Am J Respir Cell Mol Biol
.
2010;
;
42
:
:80.
–
7
.
16.
Divangahi
M
,
Demoule
A
,
Danialou
G
,
et al.
.
Impact of IL-10 on diaphragmatic cytokine expression and contractility during Pseudomonas Infection.
.
Am J Respir Cell Mol Biol
.
2007;
;
36
:
:504.
–
12
.
17.
Friedrich
O
,
Yi
B
,
Edwards
JN
,
et al.
.
IL-1a reversibly inhibits skeletal muscle ryanodine receptor. a novel mechanism for critical illness myopathy?
Am J Respir Cell Mol Biol
.
2014;
;
50
:
:1096.
–
106
.
18.
Delneste
Y
,
Beauvillain
C
,
Jeannin
P
.
Immunité naturelle : structure et fonction des
Toll-like receptors
.
.
Med Sci (Paris)
.
2007;
;
23
:
:67.
–
73
.
19.
Thoma
A
,
Lightfoot
AP
.
NF-kB and inflammatory cytokine signalling : role in skeletal muscle atrophy.
.
Advances in experimental medicine and biology
.
2018;
;
1088
:
:267.
–
79
.
20.
Cho
DS
,
Schmitt
RE
,
Dasgupta
A
,
et al.
.
Single-cell deconstruction of post-sepsis skeletal muscle and adipose tissue microenvironments.
.
J Cachexia Sarcopenia Muscle
.
2020;
;
11
:
:1351.
–
63
.
21.
Crowell
KT
,
Lang
CH
.
Contractility and myofibrillar content in skeletal muscle are decreased during post-sepsis recovery, but not during the acute phase of sepsis.
.
Shock
.
2021;
;
55
:
:649.
–
59
.
22.
Bonaldo
P
,
Sandri
M
.
Cellular and molecular mechanisms of muscle atrophy.
.
Dis Models Mech
.
2013;
;
6
:
:25.
–
39
.
23.
Gellhaus
B
,
Böker
KO
,
Gsaenger
M
,
et al.
.
Foxo3 knockdown mediates decline of myod1 and myog reducing myoblast conversion to myotubes.
.
Cells
.
2023;
;
12
:
:2167.
.
24.
Sandri
M
.
Autophagy in skeletal muscle.
.
FEBS Lett
.
2010;
;
584
:
:1411.
–
6
.
25.
Brunet
A
.
Les multiples actions des facteurs de transcription FOXO.
.
Med Sci (Paris)
.
2004;
;
20
:
:856.
–
9
.
26.
Bertoli
C
,
Copetti
T
,
Lam
EWF
,
et al.
.
Calpain small-1 modulates Akt/ FoxO3A signaling and apoptosis through PP2A.
.
Oncogene
.
2009;
;
28
:
:721.
–
33
.
27.
Tiao
G
,
Fagan
JM
,
Samuels
N
,
et al.
.
Sepsis stimulates nonlysosomal, energy-dependent proteolysis and increases ubiquitin mRNA levels in rat skeletal muscle.
.
J clin invest
.
1994;
;
94
:
:2255.
–
64
.
28.
Hobler
SC
,
Tiao
G
,
Fischer
JE
,
et al.
.
Sepsis-induced increase in muscle proteolysis is blocked by specific proteasome inhibitors.
.
Am J Physiol Regul Integr Comp Physiol
.
1998;
;
274
:
:R30.
–
R7
.
29.
Zanders
L
,
Kny
M
,
Hahn
A
,
et al.
.
Sepsis induces interleukin 6, gp130/JAK2/STAT3, and muscle wasting.
.
J Cachexia Sarcopenia Muscle
.
2022;
;
13
:
:713.
–
27
.
30.
Lapaquette
P
,
Nguyen
HTT
,
Faure
M
.
L’autophagie garante de l’immunité et de l’inflammation.
.
Med Sci (Paris)
.
2017;
;
33
:
:305.
–
11
.
31.
Leduc-Gaudet
JP
,
Franco-Romero
A
,
Cefis
M
,
et al.
.
MYTHO is a novel regulator of skeletal muscle autophagy and integrity.
.
Nat Commun
.
2023;
;
14
:
:1199.
.
32.
Leduc-Gaudet
JP
,
Miguez
K
,
Cefis
M
,
et al.
.
Autophagy ablation in skeletal muscles worsens sepsis-induced muscle wasting, impairs whole-body metabolism, and decreases survival.
.
iScience
.
2023;
;
26
:
:107475.
.
33.
Baud
L
,
Fouqueray
B
,
Bellocq
A
,
Peltier
J
.
Les calpaïnes participent au développement de la réaction inflammatoire.
.
Med Sci (Paris)
.
2003;
;
19
:
:71.
–
6
.
34.
Letavernier
E
,
Baud
L
.
Les calpaïnes : une arme à double tranchant.
.
Med Sci (Paris)
.
2016;
;
32
:
:435.
–
8
.
35.
Smith
IJ
,
Lecker
SH
,
Hasselgren
PO
.
Calpain activity and muscle wasting in sepsis.
.
Am J Physiol Endocrinol Metab
.
2008;
;
295
:
:E762.
–
71
.
36.
Monzel
AS
,
Enríquez
JA
,
Picard
M
.
Multifaceted mitochondria : moving mitochondrial science beyond function and dysfunction.
.
Nat Metab
.
2023;
;
5
:
:546.
–
62
.
37.
Willingham
TB
,
Ajayi
PT
,
Glancy
B
.
Subcellular specialization of mitochondrial form and function in skeletal muscle cells.
.
Front Cell Dev Biol
.
2021;
;
9
:
:757305.
.
38.
Li
X
,
Sun
B
,
Li
J
,
et al.
.
Sepsis leads to impaired mitochondrial calcium uptake and skeletal muscle weakness by reducing the micu1 : mcu protein ratio.
.
Shock
.
2023;
;
60
:
:698.
–
706
.
39.
Callahan
LA
,
Stofan
DA
,
Szweda
LI
,
et al.
.
Free radicals alter maximal diaphragmatic mitochondrial oxygen consumption in endotoxin-induced sepsis.
.
Free Radic Biol Med
.
2001;
;
30
:
:129.
–
38
.
40.
Callahan
LA
,
Supinski
GS
.
Sepsis induces diaphragm electron transport chain dysfunction and protein depletion.
.
Am J Respir Crit Care Med
.
2005;
;
172
:
:861.
–
8
.
41.
Sheng
Z
,
Yu
Z
,
Wang
M
,
et al.
.
Targeting STAT6 to mitigate sepsis-induced muscle atrophy and weakness : Modulation of mitochondrial dysfunction, ferroptosis, and CHI3L1-Mediated satellite cell loss.
.
Biochem Biophys Rep
.
2024;
;
37
:
:101608.
.
42.
Zheng
Y
,
Dai
H
,
Chen
R
,
et al.
.
Endoplasmic reticulum stress promotes sepsis-induced muscle atrophy via activation of STAT3 and Smad3.
.
J Cell Physiol
.
2023;
;
238
:
:582.
–
96
.
43.
Zink
W
,
Kaess
M
,
Hofer
S
,
et al.
.
Alterations in intracellular Ca
2+
-homeostasis of skeletal muscle fibers during sepsis
.
.
Crit Care Med
.
2008;
;
36
:
:1559.
–
63
.
44.
Goossens
C
,
Weckx
R
,
Derde
S
,
et al.
.
Impact of prolonged sepsis on neural and muscular components of muscle contractions in a mouse model.
.
J Cachexia Sarcopenia Muscle
.
2021;
;
12
:
:443.
–
55
.
45.
Rossignol
B
,
Gueret
G
,
Pennec
JP
,
et al.
.
Effects of chronic sepsis on the voltage-gated sodium channel in isolated rat muscle fibers.
.
Crit Care Med
.
2007;
;
35
:
:351.
–
7
.
46.
Nardelli
P
,
Khan
J
,
Powers
R
,
et al.
.
Reduced motoneuron excitability in a rat model of sepsis.
.
J Neurophysiol
.
2013;
;
109
:
:1775.
–
81
.
47.
Nardelli
P
,
Vincent
JA
,
Powers
R
,
et al.
.
Reduced motor neuron excitability is an important contributor to weakness in a rat model of sepsis.
.
Exp Neurol
.
2016;
;
282
:
:1.
–
8
.
48.
Nardelli
P
,
Powers
R
,
Cope
TC
,
et al.
.
Increasing motor neuron excitability to treat weakness in sepsis.
.
Ann Neurol
.
2017;
;
82
:
:961.
–
71
.
49.
Schäfers
M
,
Sorkin
L
.
Effect of cytokines on neuronal excitability.
.
Neurosci Lett
.
2008;
;
437
:
:188.
–
93
.
50.
Bourcier
CH
,
Michel-Flutot
P
,
Emam
L
,
et al.
.
ß1-adrenergic blockers preserve neuromuscular function by inhibiting the production of extracellular traps during systemic inflammation in mice.
.
Front Immunol
.
2023;
;
14
:
:1228374.
.
|