Les lymphocytes T auxiliaires sont des médiateurs de la réponse immunitaire adaptative qui orchestrent les réponses immunitaires en réponse à des antigènes étrangers, des néo-antigènes ou des auto-antigènes dans des contextes d’infection, de cancer, ou d’auto-immunité, respectivement. La réponse immunitaire adaptative doit être finement régulée car des réponses non-contrôlées contribuent au développement de maladies. Parmi elles, les maladies allergiques, avec notamment une prévalence croissante des allergies alimentaires, des rhinites allergiques, de la dermatite atopique et de l’asthme allergique, engendrent un coût socio-économique croissant. Plus de la moitié des personnes asthmatiques ont une maladie inflammatoire chronique des voies respiratoires inférieures, caractérisée par une réponse inflammatoire de type 2 1 hyper-réactive. Les cytokines de type 2, interleukine 4 (IL-4), interleukine 5 (IL-5) et interleukine 13 (IL-13), produites notamment par les lymphocytes T auxiliaires de type 2 (aussi appelés lymphocytes Th2, pour T helper 2), jouent un rôle prépondérant dans le développement de la maladie car elles sont responsables de l’hypersensibilité des voies respiratoires, de la production abondante de mucus, du remodelage pulmonaire, de l’augmentation du nombre de granulocytes éosinophiles dans le sang (hyperéosinophilie), de la commutation isotypique des immunoglobulines E (IgE), de la prolifération des lymphocytes B, et de la bronchoconstriction. Il n’est donc pas surprenant que différentes approches thérapeutiques visent à interférer avec les cytokines de type 2 ou leurs récepteurs. Cependant, malgré des résultats très encourageants obtenus avec plusieurs biomédicaments chez les patients ayant une forte réponse inflammatoire de type 2 [ 1 ], la moitié des patients traités n’en tirent aucun bénéfice ou en profitent insuffisamment. Il importe donc de progresser dans la connaissance des mécanismes de contrôle du déclenchement et du maintien de la réponse immunitaire afin d’identifier de nouvelles cibles thérapeutiques.
Contrôler et moduler l’abondance de protéines critiques pour les lymphocytes T auxiliaires par des mécanismes transcriptionnels, post-transcriptionnels ou traductionnels est essentiel pour une réponse immunitaire adéquate. De plus, différentes modifications post-traductionnelles sont mises en œuvre pour modifier l’abondance ou l’activité de ces protéines. L’ubiquitinylation est l’une de ces modifications. Elle est rapide, réversible, et fait intervenir successivement trois enzymes : une enzyme d’activation de l’ubiquitine (E1), une enzyme de conjugaison de l’ubiquitine (E2), et une ubiquitine ligase (E3). Le devenir des protéines ubiquitinylées dépend du type de modification : mono-ubiquitinylation, multi-ubiquitinylation (liaison de plusieurs molécules d’ubiquitine au substrat), poly-ubiquitinylation (liaison de chaînes d’ubiquitine). En particulier, les chaînes d’ubiquitines liées par leur lysine en position 48 ou 63 sont prédominantes, et constituent des signaux d’adressage des protéines à la dégradation protéasomique et lysosomique, respectivement. Mais l’ubiquitinylation a également d’autres fonctions, non dégradatives [ 2 ] ( → ).
(→) Voir m/s n° 12, 2001, page 1327
La reconnaissance spécifique des substrats à ubiquitinyler est assurée par les centaines d’enzymes E3, monomériques ou multimériques, codées par le génome humain. Au cours de l’évolution et avec la complexification des organismes animaux, la famille des enzymes E3 a augmenté en nombre et en diversité [ 3 ]. La synthèse de ces enzymes et leur activité sont souvent strictement contrôlées pour éviter des effets délétères. Du fait de leur sélectivité, ces enzymes sont considérées comme des cibles thérapeutiques attractives [ 4 , 5 ].
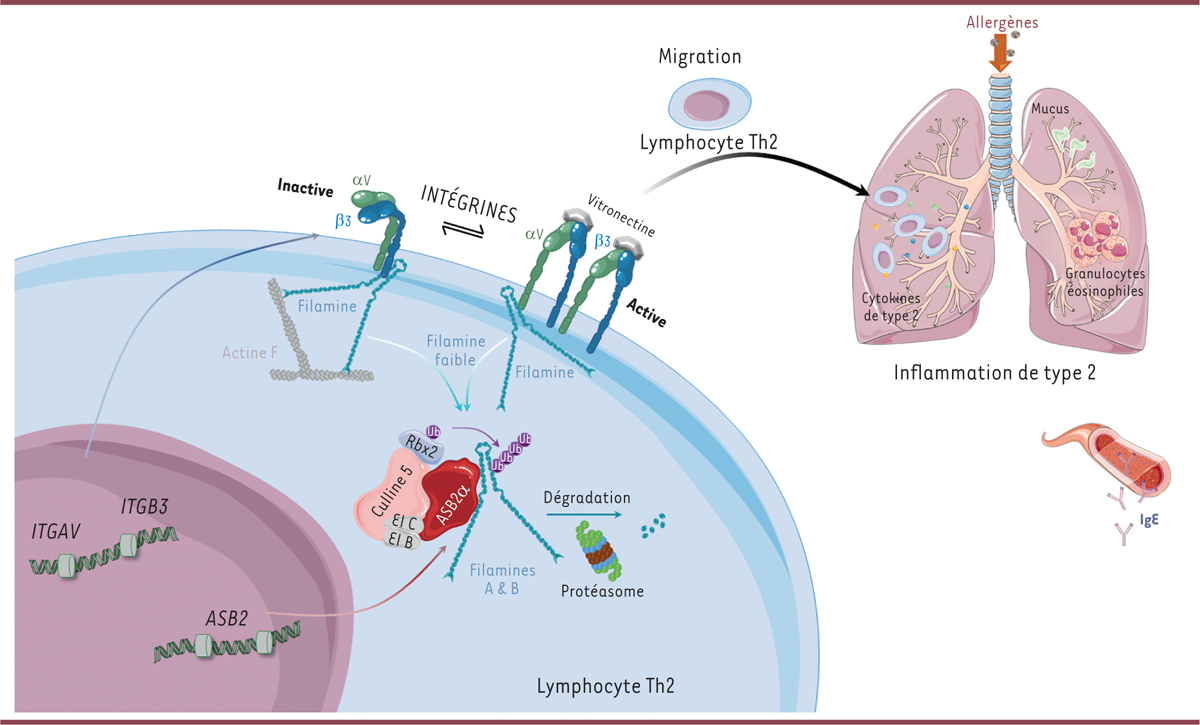
Le rôle des enzymes E3 dans les lymphocytes T auxiliaires est mal connu. Nous avons précédemment montré qu’ASB2α ( ankyrin repeat and SOCS box protein 2 α), la sous-unité de reconnaissance du substrat d’une enzyme E3 multimérique de la famille CRL5 ( cullin-RING ligase 5 ), est un facteur pro-tumoral des lymphocytes Th2 [ 6 ]. En outre, la perte d’ASB2α dans les lymphocytes Th2 consécutive à l’invalidation du gène ASB2 par recombinaison homologue chez la souris affecte les fonctions effectrices de ces lymphocytes et l’équilibre Th1/Th2 en favorisant une réponse antitumorale de type 1 chez les souris porteuses d’un cancer colorectal [ 6 ]. Toutefois, les mécanismes moléculaires et cellulaires par lesquels ASB2α agit positivement sur le fonctionnement des lymphocytes Th2 n’étaient pas établis. Par des approches transcriptomiques et protéomiques appliquées à des lymphocytes Th2, nous avons montré que la seule fonction d’ASB2α est d’induire la polyubiquitinylation et la dégradation par le protéasome des filamines A et B, des protéines organisatrices du cytosquelette d’actine et régulatrices de la motilité cellulaire [ 7 ]. En conséquence, les concentrations des filamines A et B dans les lymphocytes Th2 sont moindres que dans les lymphocytes T CD4 + naïfs ou dans les autres sous-types de lymphocytes T auxiliaires [ 7 ]. La filamine A est une protéine de liaison de l’actine dont la fonction première est d’organiser le cytosquelette d’actine en réseau orthogonal [ 8 ]. La concentration de filamine A régit par ailleurs les propriétés mécaniques du réseau d’actine filamenteuse [ 8 ]. Tout comme les domaines des filamines impliqués dans la liaison à l’actine, ceux impliqués dans la liaison aux intégrines ont été conservés au cours de l’évolution des espèces, ce qui témoigne de l’importance fonctionnelle des intégrines comme partenaires de liaison des filamines. Outre l’intégrine leucocytaire α L β 2 , aussi appelée LFA-1 ( lymphocyte function-associated antigen-1 ), les lymphocytes Th2 produisent très majoritairement l’intégrine α V β 3 [ 7 ]. Contrairement aux lymphocytes Th1, les lymphocytes Th2 adoptent, dans un environnement enflammé, un comportement migratoire rapide leur permettant d’explorer une région étendue, qui dépend des intégrines α v β 3 [ 9 , 10 ]. Nous avons montré qu’ASB2α, via la dégradation des filamines A et B, favorise l’allongement cellulaire propice à la migration des lymphocytes Th2. Inversement, l’accumulation des filamines A et B dans les lymphocytes Th2 déficients pour ASB2α ralentit leur migration, probablement en raison d’une signalisation excessive des intégrines α V β 3 [ 7 ], comme précédemment observé pour l’intégrine plaquettaire α IIb β 3 [ 11 ]. Il est à noter que les gènes codant ASB2α et les sous-unités α V et β 3 des intégrines présentent des régions cis -régulatrices actives seulement dans les lymphocytes Th2, et qu’ils appartiennent au groupe de gènes dont l’expression est restreinte à ce lignage, suggérant l’existence d’une régulation coordonnée de ces gènes pour développer une réponse immunitaire de type 2 [ 7 ]. Chez des souris soumises expérimentalement à une inflammation des voies respiratoires, la perte d’ASB2α dans les lymphocytes Th2 entraîne une diminution de leur recrutement dans les poumons enflammés ainsi qu’une atténuation de la réponse inflammatoire de type 2, avec une diminution de la production des cytokines de type 2, de l’infiltration leucocytaire et du remodelage tissulaire, ainsi que de la production de mucus et d’IgE [ 7 ].
| Figure 1
Physiopathologie de l’asthme de type 2
.
Les gènes codant les sous-unités des intégrines α
V
(
ITGAV
) et β
3
(
ITGB3
) et
ASB2
font partie des gènes plus fortement exprimés dans les lymphocytes T auxiliaires de type 2 (
T helper 2
, Th2) que dans les autres populations de lymphocytes T auxiliaires ou que dans les lymphocytes T CD4
+
naïfs, et qui ont des mécanismes communs de régulation épigénétique. L’expression d’ASB2α dans les lymphocytes Th2 conduit à la polyubiquitinylation des filamines A et B et à leur dégradation par le protéasome, ce qui diminue leur concentration dans ces lymphocytes. Ces concentrations faibles de filamines favorisent la migration des lymphocytes Th2 de façon dépendante des intégrines α
V
β
3
activées par leur ligand, la vitronectine. Dans le contexte d’une exposition à un allergène, les lymphocytes Th2 sont recrutés dans les poumons et sécrètent des cytokines de type 2 (IL-4, IL-5 et IL-13) favorisant l’inflammation, avec production de mucus, remodelage tissulaire, recrutement des granulocytes éosinophiles et production d’IgE. El B : élongine B ; El C : élongine C ; Ub : ubiquitine.
|
Nos résultats mettent ainsi en lumière une nouvelle voie contrôlant le fonctionnement des lymphocytes Th2 et révèlent un niveau supplémentaire de régulation de la migration de ces lymphocytes, dépendante des intégrines α v β 3 , par la modulation de leur activation via le contrôle de l’abondance des filamines A et B [ 7 ]. Les résultats d’études précliniques chez la souris nous permettent aussi de proposer l’axe ASB2α-filamines A/B comme une cible pharmacologique potentielle dans l’asthme de type 2 2, . Bien que cette proposition soit principalement fondée sur des résultats obtenus chez la souris, nous avons aussi apporté différentes preuves de la conservation de ces mécanismes chez l’Homme [ 7 ]. Une forte expression du gène ASB2 par les lymphocytes Th2 fait d’ailleurs partie de la signature transcriptomique de l’hyperéosinophilie, une signature prédictive de l’efficacité thérapeutique du lébrikizumab, un anticorps ciblant IL-13, chez les patients asthmatiques [ 12 ]. Ainsi, inhiber la dégradation des filamines A et B induite par ASB2α apparaît comme une opportunité thérapeutique pour diminuer la réponse immunitaire de type 2. Dans ce contexte, il importe de rappeler que les enzymes E3 sont des éléments essentiels de la cascade d’ubiquitinylation en apportant la spécificité vis-à-vis du substrat et, par là-même, sont considérées comme des cibles pharmacologiques potentielles. La connaissance issue de nos travaux de recherche pourrait donc être exploitée en santé humaine puisque ces enzymes peuvent être ciblées avec des petites molécules thérapeutiques [ 4 , 5 ]. Par rapport aux biomédicaments, ces petites molécules ont l’avantage de pouvoir être améliorées chimiquement pour augmenter leur efficacité et diminuer leur toxicité, d’être plus faciles à administrer, et d’être moins coûteuses. L’inhibition d’ASB2α par de telles molécules pourrait donc constituer une nouvelle approche thérapeutique contre l’asthme de type 2.