La résistance bactérienne aux antibiotiques constitue un enjeu majeur de santé publique. Parmi les principales menaces associées figure la dissémination des bactéries multirésistantes aux antibiotiques, dont les entérobactéries productrices de β-lactamase à spectre étendu. Ces dernières ne laissent que peu d’options thérapeutiques en cas d’infection, et comptent parmi les bactéries multirésistantes qui se répandent le plus à l’échelle mondiale. L’Organisation mondiale de la santé (OMS) les a d’ailleurs classées parmi les bactéries pathogènes critiques nécessitant le développement de nouveaux antibiotiques. La résistance aux antibiotiques, longtemps perçue comme un problème limité à la santé humaine, est désormais reconnue comme responsable d’une crise globale, touchant à la fois la santé humaine, animale et environnementale [ 1 ]. L’approche holistique « One Health » s’impose aujourd’hui comme un pilier essentiel de la surveillance épidémiologique pour lutter contre la résistance aux antibiotiques. Dans ce contexte, l’OMS a développé un protocole de surveillance simplifié et intégré, appelé Tricycle, ciblant la résistance dans trois secteurs clés : la santé humaine (portage intestinal communautaire et infections invasives), la chaîne alimentaire (poulets d’élevage), et l’environnement (eaux de surface, effluents d’abattoirs et eaux usées) [ 2 ]. Le protocole Tricycle se concentre sur un indicateur unique : la prévalence des souches de E. coli productrices de β-lactamase à spectre étendu ( E. coli -BLSE). E. coli est en effet la première bactérie responsable d’infections chez l’Homme, mais c’est également une bactérie commensale du microbiote intestinal de l’homme et des animaux, et largement répandue dans l’environnement. Par ailleurs, les souches de E. coli résistantes constituent la première cause de mortalité par résistance aux antibiotiques dans le monde [ 3 ].
Plusieurs études « One Health » sur la circulation des souches de E. coli -BLSE ont été menées dans les pays à haut revenu par habitant, mais peu ont été réalisées dans les pays à faible revenu. De plus, aucune n’a exploré de manière approfondie le rôle des éléments génétiques mobiles, tels que les plasmides, dans cette dynamique. Le protocole Tricycle a été mis en place à Antananarivo (Madagascar), afin d’évaluer la prévalence des souches de E. coli- BLSE dans les trois secteurs d’intérêt susmentionnés et d’étudier la circulation intrasectorielle et intersectorielle de ces souches bactériennes et des plasmides porteurs des gènes codant la β-lactamase à spectre étendu.
L’étude, menée entre avril 2018 et avril 2019, a recherché la présence de E. coli -BLSE dans 289 échantillons obtenus par écouvillonnage rectal chez des femmes enceintes dans trois maternités, dans 246 cæcums 1 de poulets vivants achetés sur différents marchés, et dans 28 échantillons d’eau prélevés dans la rivière Ikopa (en amont et en aval de la ville), dans un canal d’eaux usées, et dans les effluents d’eaux usées d’un abattoir urbain. Les données des hémocultures « positives » ( i.e ., témoignant d’une bactériémie) à E. coli- BLSE chez les patients hospitalisés ont également été collectées. Les génomes de 277 isolats de E. coli- BLSE (82 d’origine humaine, 118 d’origine animale, et 77 d’origine environnementale), représentatifs de l’ensemble des souches isolées, ont été séquencés et comparés par l’analyse du polymorphisme nucléotidique ( single nucleotide polymorphism , SNP).
La proportion des souches productrices de BLSE parmi les E. coli isolées des hémocultures positives ( i.e ., les infections invasives) était de 34 %. La prévalence du portage de souches de E. coli -BLSE était de 30 % chez les femmes enceintes et de 57 % chez les poulets [ 4 ]. La prévalence du portage chez l’Homme, dans la communauté, était comparable à celles rapportées dans d’autres études ; en revanche, celle constatée chez les poulets d’élevage était plus élevée [ 5 ]. Tous les prélèvements environnementaux contenaient E. coli -BLSE, avec des concentrations plus élevées dans les eaux usées et les effluents d’abattoir que dans les eaux de rivière en aval et en amont d’Antananarivo, ce qui souligne l’impact des populations urbaines denses sur la dissémination de la résistance aux antibiotiques dans l’environnement. Le seul facteur de risque significativement associé au portage de E. coli -BLSE chez les femmes enceintes, mais également chez les poulets, était la saison humide, caractérisée par des températures élevées et de fortes précipitations [ 4 ]. Ce facteur climatique, également rapporté dans d’autres études, met en évidence le risque accru de dissémination de cette bactérie résistante aux antibiotiques dans un contexte de réchauffement climatique et d’évènements climatiques extrêmes à l’échelle mondiale [ 6 ].
L’analyse génomique des E. coli -BLSE a mis en évidence une importante diversité génétique des isolats avec une plus grande diversité pour les isolats d’origine environnementale, suivis par ceux d’origine humaine, puis par ceux des poulets. Les isolats environnementaux présentaient également, en moyenne, plus de gènes de résistance aux antibiotiques, de gènes de virulence et de réplicons plasmidiques, et leur génome était de plus grande taille [ 4 ]. Ces résultats confirment des structures de population spécifiques à E. coli dans chaque secteur [ 7 ].
Les isolats de E. coli , quel que soit leur secteur de provenance, appartenaient majoritairement aux groupes phylogénétiques A et B1 (84 % des isolats), correspondant à des souches commensales à moindre pouvoir pathogène. Un total de 90 « séquence type » (ST) différentes a été identifié, confirmant la grande diversité génétique, avec une prédominance du complexe clonal STc10 représentant 46 % des isolats des poulets, 35 % des isolats humains et 31 % des isolats environnementaux [ 4 ].
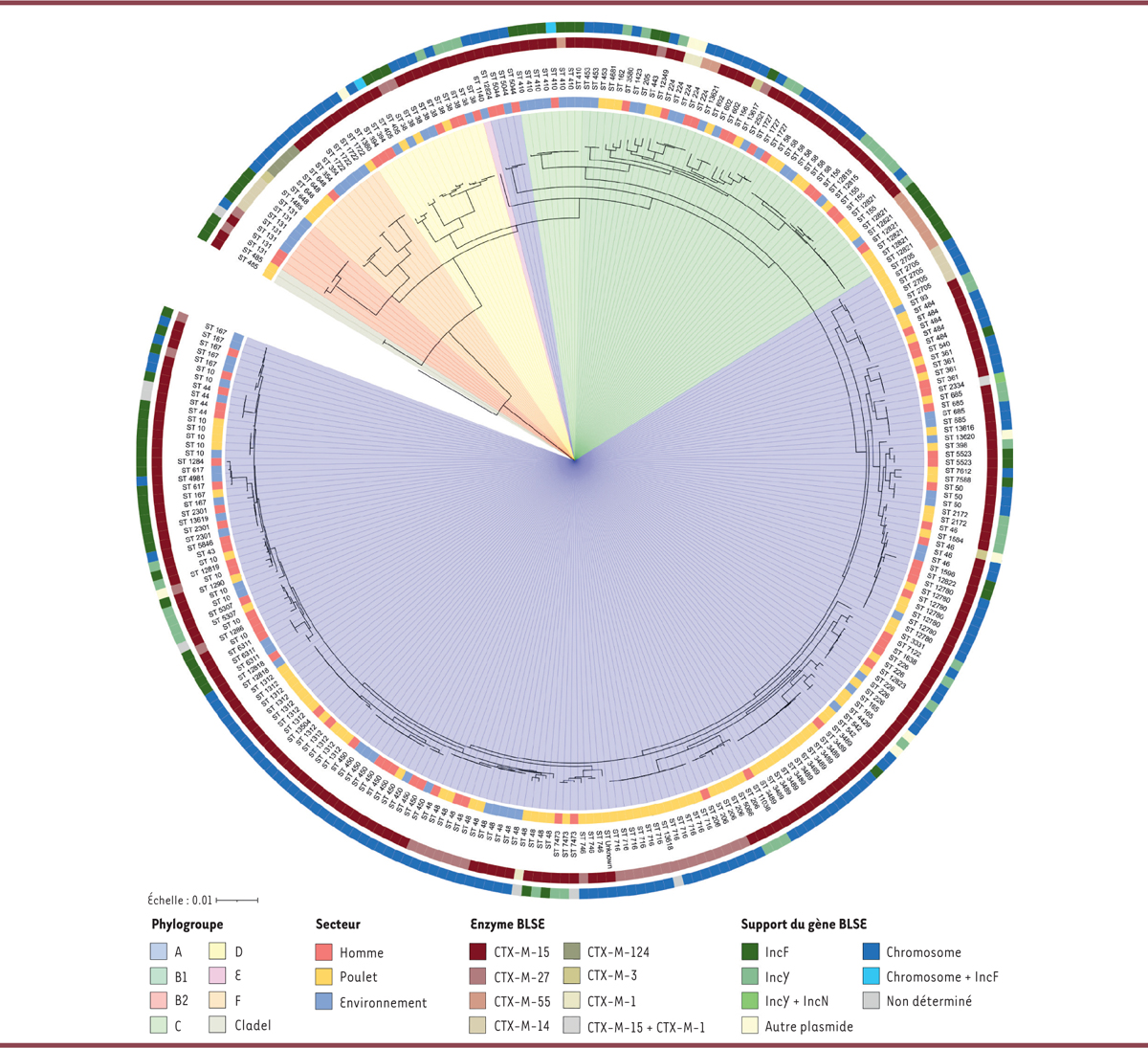
Les isolats étaient résistants à toutes les β-lactamines, sauf à la pipéracilline/ tazobactam (14 % d’isolats résistants) et à l’imipénème (1 %). La résistance aux fluoroquinolones et au co-trimoxazole était fréquente (respectivement 77 % et 63 % des isolats). Tous les gènes responsables du phénotype BLSE appartenaient à la famille bla CTX-M , codant les enzymes CTX-M (cefotaximase Munich), le gène blaCTX-M-15 étant de loin le plus fréquent (78 % des isolats), en accord avec les précédents constats attestant la dissémination mondiale de ce variant [ 8 ]. Au total, 41 % des gènes blaCTX-M étaient portés par des plasmides, majoritairement ceux du groupe d’incompatibilité IncF (55 %), suivis par ceux du groupe IncY (37 %). Les plasmides de type IncF étaient divers, avec 15 sous-types différents, tandis que les plasmides IncY étaient fortement conservés. Alors que la dissémination des gènes bla CTX-M via les plasmides IncF, bien connus pour leur adaptation à l’espèce E. coli , est largement documentée, la forte proportion de plasmides IncY était inattendue. Étonnamment, nous avons également constaté que dans 57 % des isolats, le gène bla CTX-M était intégré au chromosome bactérien ( Figure 1 ) [ 4 ]. Cette tendance, déjà relevée précédemment, est particulièrement préoccupante en raison de la capacité des gènes BLSE à se maintenir en l’absence de pression de sélection, et en raison de leur transmission verticale systématique à la descendance [ 9 ].
| Figure 1
Arbre phylogénétique des isolats de
Escherichia coli
producteurs de β-lactamase à spectre étendu (E. coli-BLSE) des trois « secteurs » (Homme, animal, environnement) à Antananarivo (Madagascar)
.
L’arbre a été enraciné sur
Escherichia fergusonii
. Les isolats et leurs branches terminales sont colorés en fonction de leur groupe phylogénétique. L’anneau intérieur représente l’origine de l’isolat (femme enceinte, poulet, environnement). Le deuxième anneau indique le « séquence type » (ST) de chaque isolat. Le troisième anneau représente le variant CTX-M. L’anneau extérieur représente l’emplacement (plasmide ou chromosome) des gènes
bla
CTX-M
. L’échelle se réfère à la longueur des branches, qui correspond au nombre de substitutions nucléotidiques par site.
|
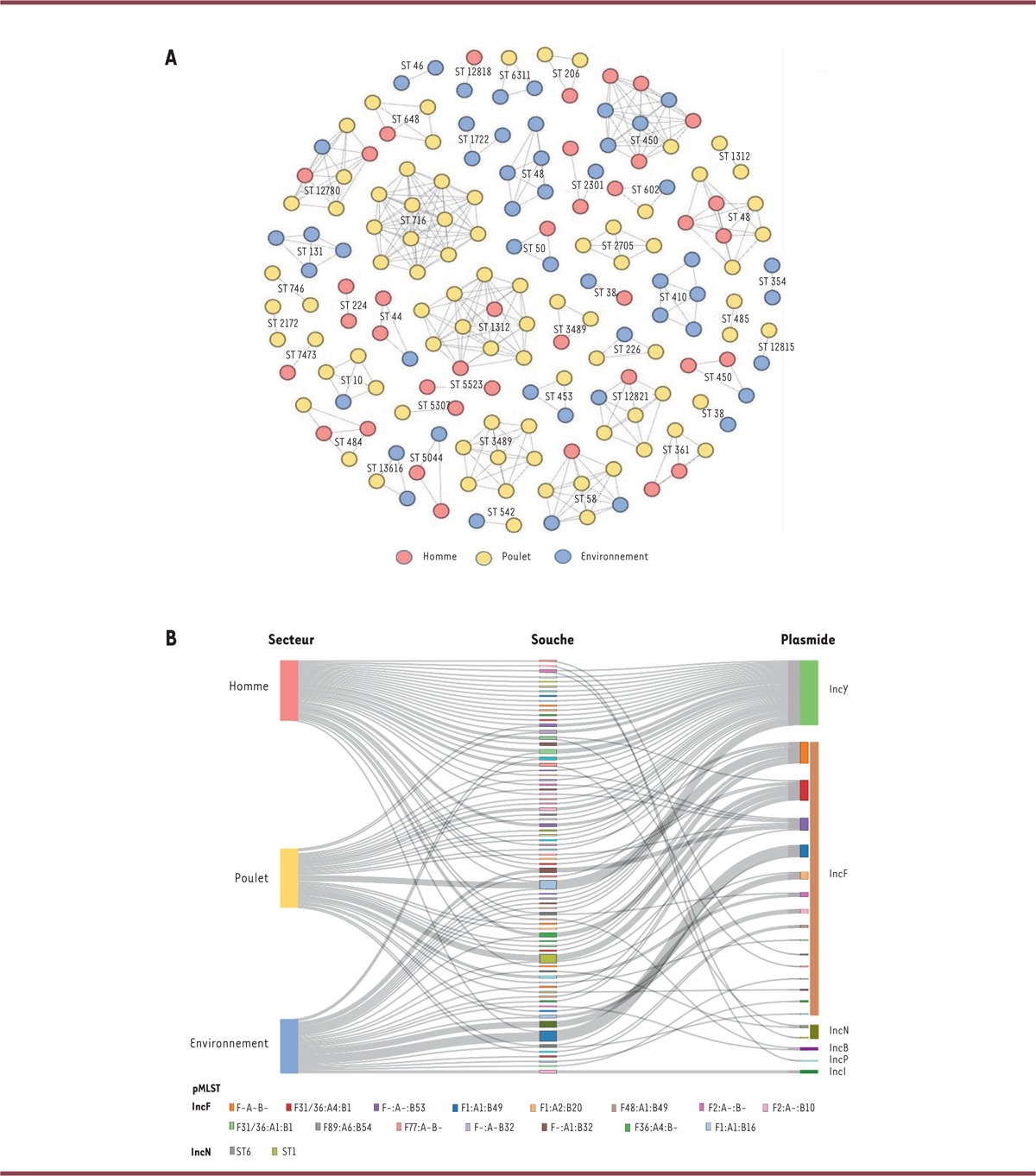
La comparaison des génomes des isolats par l’analyse du polymorphisme nucléotidique a révélé que 61 % des isolats étaient regroupés en 44 clusters d’isolats étroitement apparentés (moins de 40 SNP de différence), dont 24 incluaient des isolats provenant de deux secteurs et 5 incluaient des isolats issus des trois secteurs étudiés ( Figure 2A ) [ 4 ]. Ce résultat met en évidence une circulation significative des souches de E. coli -BLSE, non seulement au sein de chaque secteur (intrasectorielle), mais également entre les différents secteurs (intersectorielle).
| Figure 2
Analyse du polymorphisme nucléotidique des isolats de E. coli-BLSE des trois « secteurs » (Homme, animal, environnement) à Antananarivo (Madagascar). A
.
Diagramme de Fruchterman-Reingold représentant la dissémination et intrasectorielle et intersectorielle d’isolats différant par moins de 40
single nucleotide polymorphisms
(SNP). La longueur des branches n’est pas représentative du nombre de SNP.
B
.
Diagramme de Sankey représentant les liens entre secteurs (à gauche), isolats de
E. coli
-BLSE (au milieu), et plasmides porteurs de gènes BLSE définis par leur sous-type (à droite). Les rectangles colorés de la colonne centrale représentent les différents clones de
E. coli
-BLSE, définis comme des isolats de même « séquence type » (ST), sérotype, et allèle fimH.
|
Parmi les plasmides IncF, les sous types F31/36 : A4 : B1 et F- : A- : B53 ont été identifiés respectivement chez 7 et 6 isolats de E. coli -BLSE avec des fonds génétiques différents et provenant des trois secteurs étudiés. Les plasmides IncY, tous identiques et fortement conservés, ont été trouvés dans 34 isolats de fonds génétiques différents provenant également de ces trois secteurs ( Figure 2B ) [ 4 ]. Il existe donc, en plus de la circulation de souches de E. coli -BLSE, une circulation intrasectorielle et intersectorielle de plasmides portant les gènes BLSE, qui témoigne de leur rôle complémentaire dans la propagation de la résistance aux β-lactamines entre les différents réservoirs.
Alors que les résultats d’études « One-Health » réalisées dans les pays à haut revenu par habitant tendent à montrer une sectorisation de la circulation des E. coli BLSE [ 10 – 12 ], la présente étude met en évidence une dynamique de circulation intersectorielle des souches de E. coli multirésistantes aux antibiotiques, déjà constatée dans d’autres pays à faible ou moyen revenu par habitant [ 13 ]. Cette situation, probablement liée à un ensemble complexe de facteurs économiques, sanitaires, démographiques et socio-culturels, souligne l’urgence de mettre en œuvre des mesures coordonnées impliquant les acteurs de la santé humaine, animale et environnementale, dans une perspective « One Health » . Une réduction de la consommation d’antibiotiques, une amélioration de l’hygiène et des pratiques d’élevage, ainsi qu’un assainissement de l’environnement, sont indispensables pour pouvoir contrôler efficacement l’émergence et la dissémination de la résistance aux antibiotiques.