| |
| Med Sci (Paris). 41(3): 216–219. doi: 10.1051/medsci/2025027.Autophagie, cellules dendritiques, et maladie de Crohn
«
Rien ne sert de courir ; il faut partir à point
»
1Leslie Andromaque,1 Stéphane Nancey,1 Mathias Faure,1 and Aurore Rozières1* 1Centre international de recherche en infectiologie (CIRI), Univ Claude Bernard Lyon 1, Inserm, U1111, CNRS, UMR5308, École normale supérieure de Lyon
,
LyonFrance MeSH keywords: |
La maladie de Crohn, décrite pour la première fois en 1932 par le gastro-entérologue américain Burill B. Crohn, est une maladie inflammatoire chronique qui touche l’ensemble du tractus digestif. Elle se manifeste par des phases de poussée et de rémission, conséquence d’une réponse immunitaire inappropriée contre le microbiote intestinal. Cette maladie peut entraîner des complications graves, nécessitant parfois une intervention chirurgicale [
1
]. La pathogenèse de la maladie de Crohn demeure mal comprise, bien que plusieurs facteurs prédisposants aient été identifiés ces dernières années, parmi lesquels des facteurs génétiques. Ainsi, des variants nucléotidiques dans les gènes associés à la fonction autophagique, tels que
ATG16L1
, sont fréquemment retrouvés chez des personnes atteintes de la maladie de Crohn [
2
]. L’autophagie désigne un processus de catabolisme lysosomique qui assure la dégradation continue des composants cellulaires obsolescents, évitant ainsi les conséquences néfastes de leur accumulation. Ce processus se déroule en trois étapes successives, finement contrôlées : 1) la formation initiale d’une membrane à proximité de composants devant être dégradés ; 2) l’élongation de cette membrane formant une nouvelle vésicule, l’autophagosome, séquestrant le « déchet » cytosolique ; et 3) la maturation permettant la dégradation des déchets par la fusion de l’autophagosome avec un lysosome. En plus de son rôle fondamental dans l’homéostasie cellulaire, l’autophagie, également appelée xénophagie lorsqu’elle cible des agents pathogènes intracellulaires, constitue un mécanisme de défense autonome pour chacune de nos cellules [
3
].
|
Autophagie et maladie de Crohn
Au-delà de l’homéostasie cellulaire, l’autophagie est un acteur essentiel dans la modulation de l’immunité. L’autophagie contribue par exemple à réguler la concentration de facteurs impliqués dans des voies de signalisation de la réponse inflammatoire, ou encore à constituer le répertoire des peptides antigéniques présentés aux lymphocytes T par les molécules du complexe majeur d’histocompatibilité (CMH) [
4
]. Ces deux fonctions jouent un rôle majeur dans l’activité des cellules dendritiques impliquées dans l’homéostasie immunitaire intestinale. En tant qu’acteurs de l’immunité innée, selon l’environnement dans lequel elles se trouvent, ces cellules ont la capacité de favoriser la tolérance immunitaire, ou au contraire, de déclencher une réponse immunitaire. En effet, dans les tissus, les cellules dendritiques se trouvent généralement dans un état dit immature, caractérisé par la présence, à leur surface, d’un nombre réduit de molécules du CMH de classe II et de molécules co-stimulatrices, ce qui limite leur capacité à activer les lymphocytes T naïfs. En revanche, lorsqu’elles détectent des agents pathogènes ou lorsqu’elles sont dans un environnement inflammatoire, les cellules dendritiques augmentent l’expression de ces molécules, produisent des cytokines, et acquièrent une capacité accrue à activer les lymphocytes T naïfs dans les organes lymphoïdes secondaires [
5
]. Bien que des études génomiques aient établi l’existence d’un lien entre la maladie de Crohn et certains variants nucléotidiques dans des gènes impliqués dans l’autophagie, la compréhension de leur impact sur le processus autophagique chez les personnes atteintes de cette maladie reste limitée. L’étude de modèles animaux de colite a montré que des altérations de l’autophagie dans les cellules intestinales, les macrophages et les cellules dendritiques entraînent une élimination inefficace des agents pathogènes, ou une activation persistante de la réponse inflammatoire [
6
], mais les conséquences de ces polymorphismes nucléotidiques sur les propriétés dynamiques du processus autophagique sont encore mal comprises.
|
Maturation des cellules dendritiques et reprogrammation autophagique
Afin de caractériser la dynamique du « flux autophagique » dans des cellules primaires humaines, nous avons choisi une approche quantitative inspirée des travaux de Loos
et al
. sur des lignées cellulaires [
7
,
8
]. Au cours du processus d’autophagie, la protéine soluble LC3-I se conjugue à la phosphatidyléthanolamine et s’ancre à la membrane initiale, le phagophore, sous une forme appelée LC3-II. Avec le complexe ATG5-ATG12-ATG16L1, LC3-II joue un rôle crucial dans l’élongation des extrémités du phagophore pour la formation d’un autophagosome. En suivant la conversion de LC3-I en LC3-II après un traitement avec de la bafilomycine A1, un inhibiteur puissant de la fusion des autophagosomes avec les lysosomes, nous avons pu quantifier trois variables associées au « flux autophagique » : la taille du réservoir cellulaire d’autophagosomes, le flux d’autophagosomes, et le temps de renouvellement de ce réservoir (temps de transition) (
Figure 1
) [
9
]. L’application de cette stratégie à des cellules dendritiques primaires issues de donneurs sains a révélé qu’au cours de leur maturation, les cellules dendritiques subissent une reprogrammation progressive du flux autophagique, marquée par une diminution simultanée de la taille du réservoir d’autophagosomes et de l’intensité du flux d’autophagosomes [
9
]. Étant donné que les cellules dendritiques immatures présentent une activité d’endocytose élevée, le flux autophagique important qui les caractérise pourrait ainsi participer à la dégradation des immunogènes environnementaux internalisés, y compris les microorganismes intestinaux. Cette dynamique autophagique pourrait également favoriser la production d’un répertoire peptidique, pour leur présentation par le biais des molécules du CMH de classe II. En revanche, les cellules dendritiques matures, spécialisées dans la présentation d’antigènes aux lymphocytes T naïfs, affichent une capacité réduite à internaliser ces microorganismes, ce qui pourrait être en relation avec l’adaptation du flux autophagique. Ainsi, il semble exister une coordination entre le flux autophagique et la maturation des cellules dendritiques, bien que le mécanisme précis de cette coordination reste à élucider.
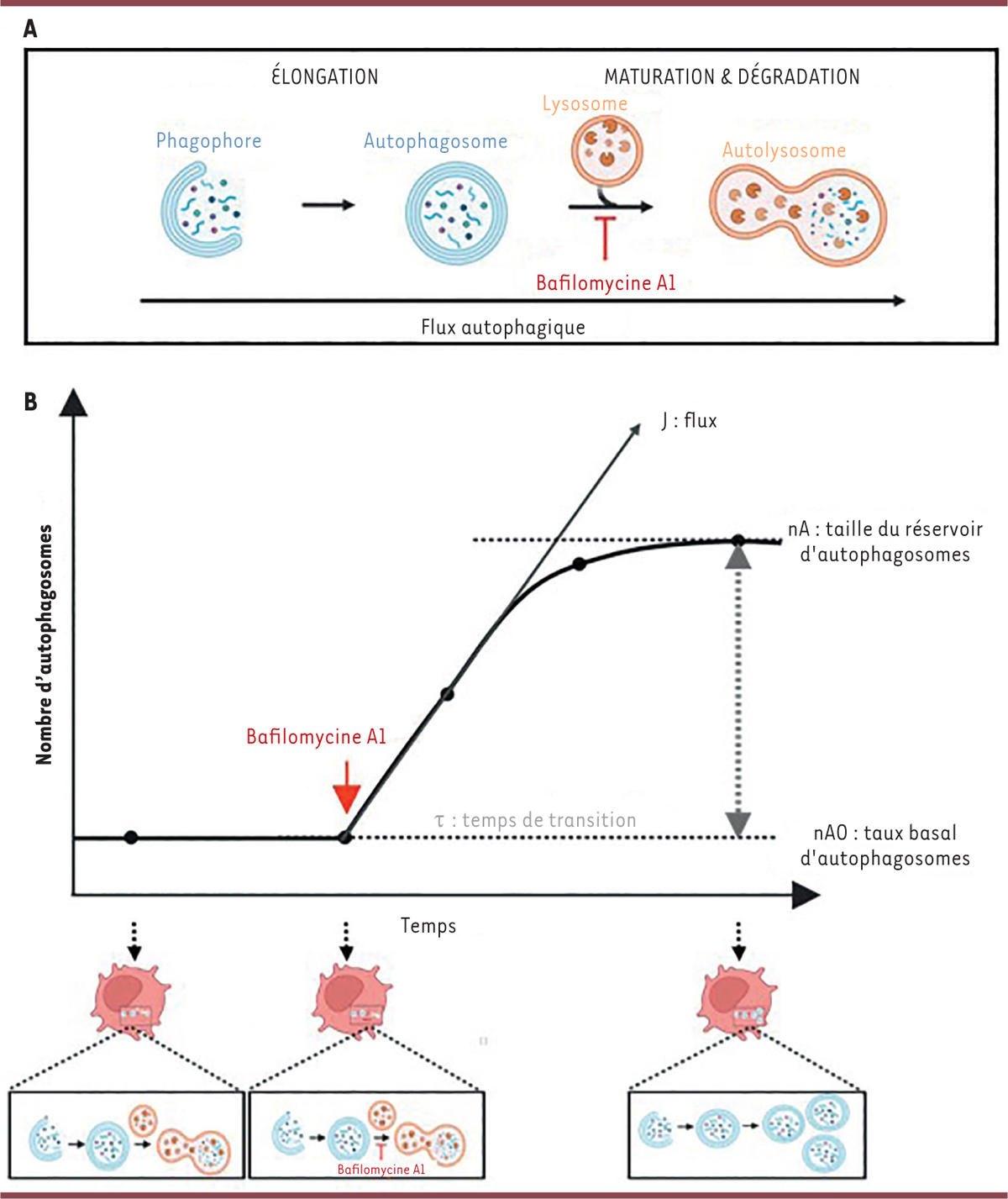
 | Figure 1
Flux autophagique et méthode d’analyse quantitative. A
.
L’autophagie est un processus dynamique, désigné sous le terme de « flux autophagique ». L’étude de ses propriétés dynamiques dans des cellules primaires, telles que les cellules dendritiques, nécessite l’ajout d’un inhibiteur de la fusion des autophagosomes avec les lysosomes, la bafilomycine A1, ce qui induit l’accumulation des autophagosomes dans la cellule.
B
.
Le suivi de cette accumulation permet de quantifier trois variables associées au flux autophagique : 1) le flux d’autophagosomes (J), déterminé à partir de la pente de la courbe représentant le nombre d’autophagosomes en fonction du temps, et qui reflète la vitesse à laquelle les autophagosomes s’accumulent au cours du temps ; 2) la taille du réservoir cellulaire d’autophagosomes (nA), qui correspond au nombre maximal d’autophagosomes présents dans la cellule ; 3) le temps de transition (τ), qui représente le délai nécessaire pour reconstituer un réservoir d’autophagosomes.
|
|
Polymorphisme de gènes impliqués dans l’autophagie, maladie de Crohn, et dynamique du flux autophagique
La caractérisation du flux autophagique dans les cellules dendritiques de personnes atteintes de la maladie de Crohn a montré que sa reprogrammation au cours de la maturation de ces cellules est très compromise chez les patients homozygotes pour des mutations « faux-sens » dans des gènes codant deux facteurs majeurs de l’autophagie :
ATG16L1
et
ULK1
(
Unc-51-like kinase 1
) (
Figure 2
) [
9
]. Ainsi, la présence, à l’état homozygote, du variant ATG16L1
Thr300Ala
, tout comme celle du variant rs12303764 (G/T) de
ULK1
, limite l’adaptation du flux autophagique lors de la maturation des cellules dendritiques. Chez ces patients, l’absence de reprogrammation du flux autophagique durant la maturation de ces cellules pourrait ainsi altérer leurs fonctions immunitaires et contribuer à la pathogenèse de la maladie de Crohn, notamment par un contrôle autophagique dysfonctionnel des réponses inflammatoires et une réponse autophagique dérégulée face aux bactéries invasives.
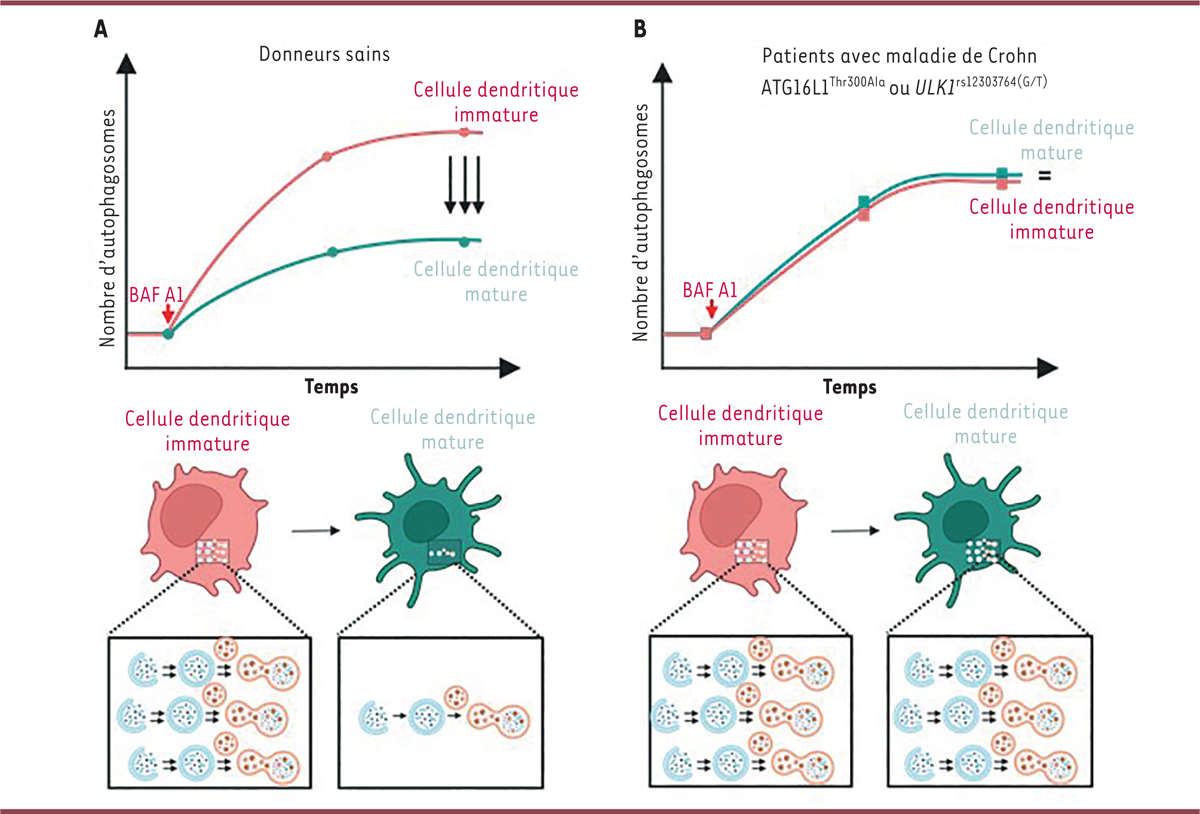
 | Figure 2
Polymorphisme génique et défaut d’adaptation autophagique. A
.
Au cours de la maturation des cellules dendritiques, le flux autophagique ralentit, ce qui se traduit par une diminution de la vitesse de formation et du nombre total des autophagosomes.
B
.
Chez les individus atteints de la maladie de Crohn et porteurs de variants nucléotidiques dans les gènes impliqués dans l’autophagie, tels que ATG16L1
Thr300Ala
ou
ULK1
rs12303764 (G/T)
, cette adaptation du flux autophagique ne se produit pas : la vitesse de formation des autophagosomes et leur nombre total ne diminuent pas. BAF A1 : bafilomycine A1.
|
|
Nous avons mis en évidence l’existence d’un défaut intrinsèque de la reprogrammation du « flux autophagique » lors de la maturation des cellules dendritiques chez certaines personnes atteintes de la maladie de Crohn et porteuses de variants bialléliques dans des gènes impliqués dans l’autophagie. Alors que chez les individus sains, les cellules dendritiques réduisent leur flux autophagique à mesure qu’elles progressent vers un état mature, cette adaptation physiologique est compromise chez les patients. Il reste maintenant à préciser les conséquences de cette anomalie, qui pourrait affecter la polarisation de la réponse immunitaire adaptative. Par ailleurs, l’analyse quantitative du flux autophagique dans des cellules en culture primaire devrait désormais permettre de déterminer, avec davantage de précision, les caractéristiques dynamiques du flux autophagique dans d’autres maladies pour lesquelles on suspecte un défaut de l’autophagie. |
Nos travaux de recherche sur l’autophagie et les maladies inflammatoires intestinales sont subventionnés par l’Agence nationale de la recherche (ANR-22-CE17-0054-02), la Société nationale française de gastro-entérologie, et l’Association François Aupetit (AFA)
.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article
.
|
1.
Dolinger
M
,
Torres
J
,
Vermeire
S
.
Crohn’s disease.
.
Lancet
.
2024;
;
403
:
:1177.
–
91
.
2.
Franke
A
,
McGovern
DPB
,
Barrett
JC
,
et al.
.
Genome-wide meta-analysis increases to 71 the number of confirmed Crohn’s disease susceptibility loci.
.
Nat Genet
.
2010;
;
42
:
:1118.
–
25
.
3.
Richetta
C
,
Faure
M
.
Autophagy in antiviral innate immunity.
.
Cell Microbiol
.
2013;
;
15
:
:368.
–
76
.
4.
Deretic
V
,
Levine
B
.
Autophagy balances inflammation in innate immunity.
.
Autophagy
.
2018;
;
14
:
:243.
–
51
.
5.
Merad
M
,
Sathe
P
,
Helft
J
,
et al.
.
The dendritic cell lineage : ontogeny and function of dendritic cells and their subsets in the steady state and the inflamed setting.
.
Annu Rev Immunol
.
2013;
;
31
:
:563.
–
604
.
6.
Zhang
H
,
Wang
D
,
Shihb
DQ
,
et al.
.
Atg16l1 in dendritic cells is required for antibacterial defense and autophagy in murine colitis.
.
IUBMB Life
.
2020;
;
72
:
:2686.
–
95
.
7.
Loos
B
,
Toit
A du
,
Hofmeyr
JHS
.
Defining and measuring autophagosome flux : concept and reality.
.
Autophagy
.
2014;
;
10
:
:2087.
–
96
.
8.
Loos
B
,
Klionsky
DJ
,
Du Toit
A
,
et al.
.
On the relevance of precision autophagy flux control in vivo - Points of departure for clinical translation.
.
Autophagy
.
2020;
;
16
:
:750.
–
62
.
9.
Quiniou
G
,
Andromaque
L
,
Duclaux-Loras
R
,
et al.
.
Impaired reprogramming of the autophagy flux in maturing dendritic cells from Crohn disease patients with core autophagy gene-related polymorphisms.
.
Autophagy
.
2024;
;
20
:
:1837.
–
53
.
|