| |
| Med Sci (Paris). 41(2): 201–202. doi: 10.1051/medsci/2025021.
Développement d’une nanosonde portée par
E. coli
, déclenchable
in situ
pour diagnostiquer et traiter les tumeurs
Nolwenn Roger1* and Léa Moutardier1** 1Master 2 Infectiologie, Immunité, Vaccinologie et Biomédicaments, Université de Tours
,
Tours
,
France MeSH keywords: |
L’importance du dépistage annuel de certains cancers, l’identification de prédispositions génétiques ou encore les progrès dans le diagnostic et les traitements ont progressivement permis de diminuer la mortalité associée à chaque cancer [
1
]. De plus, la moitié des 355 000 nouveaux cas de cancer annuellement recensés en France sont en mesure d’être soignés grâce aux progrès de la recherche biomédicale [
1
]. En effet, de nouvelles thérapies anti-tumorales innovantes sont apparues, comme la thérapie photodynamique [
2
]. Cette récente technologie biomédicale repose sur l’administration systémique d’un photosensibilisateur. Ce dernier est absorbé sélectivement par la tumeur, puis excité par chimioluminescence, conduisant à la génération d’espèces réactives de l’oxygène (ERO) [
3
,
4
]. Ces espèces chimiques oxygénées pénètrent dans les tumeurs et induisent des dommages à l’ADN conduisant à la mort cellulaire localisée [
5
].
Les nombreux avantages de la thérapie photodynamique, illustrés par une absence de résistance aux médicaments, une faible cytotoxicité ou encore une précision spatio-temporelle élevée, ont conduit les auteurs, Zhang
et al
. [
6
], à développer un nouveau traitement antitumoral sur ce principe. Ce dernier prend la forme d’une sonde auto-déclenchable
in situ
, capable de combiner un diagnostic efficace grâce à la détection de la chimioluminescence avec un traitement basé sur cette approche thérapeutique.
Afin de concevoir un nanosystème performant, la bactérie
Escherichia coli
(
E. coli
) a été utilisée comme support de sonde pour ses propriétés de ciblage des tumeurs en se faisant piéger dans la vascularisation des tumeurs ou encore par son afflux dans les tumeurs en situation inflammatoire, mais également pour ses capacités à réduire des composés acides à sa surface [
7
] (
Figure 1
). La catalase produite par
E. coli
joue un rôle clé en décomposant l’excès de peroxyde d’hydrogène (H
2
O
2
) en dioxygène (O
2
), ce qui contribue à réduire l’hypoxie tumorale. Ce mécanisme favorise également le processus de photosensibilisation de la Riboflavine, utilisée ici comme photosensibilisateur [
8
,
9
].
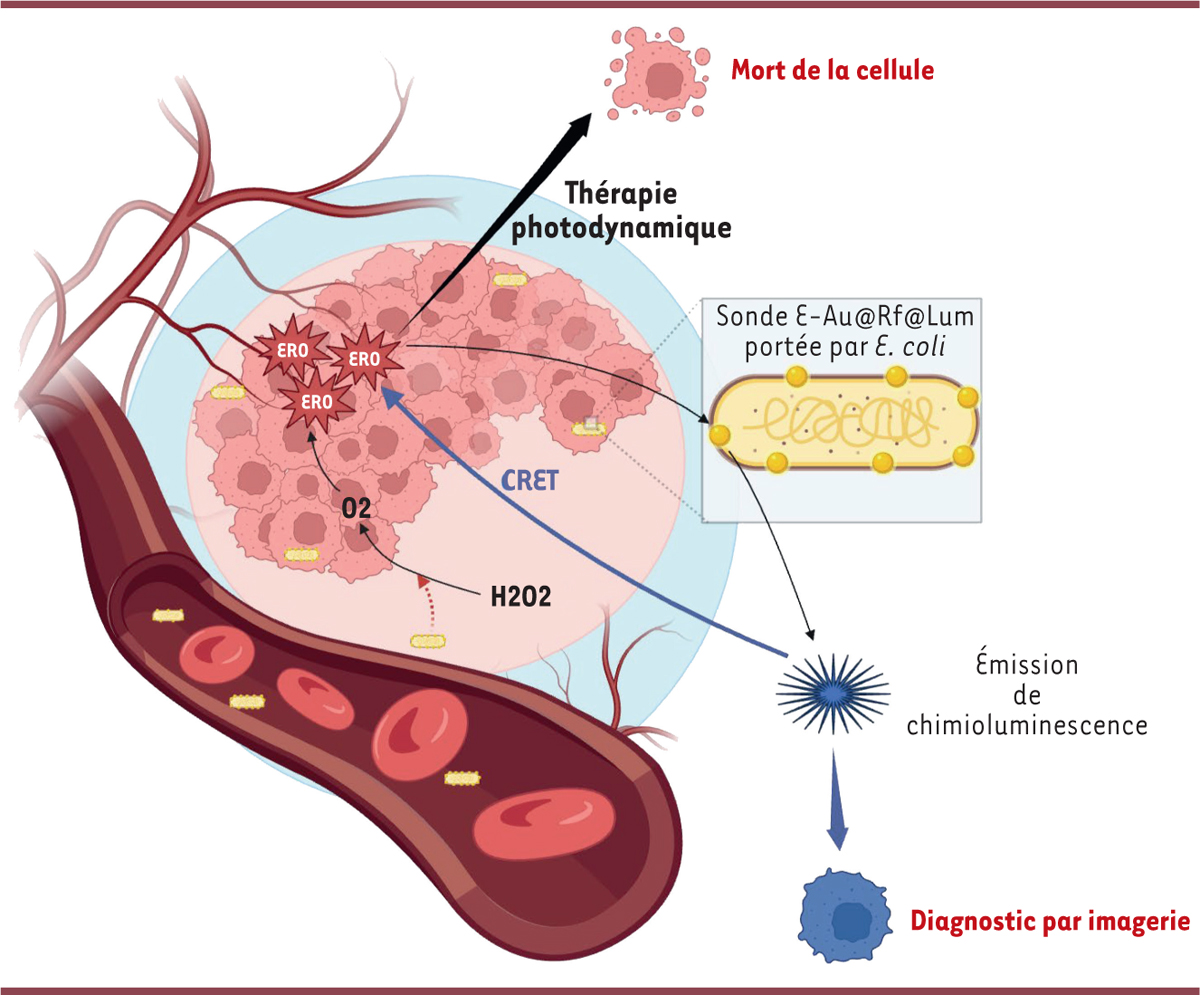
 | Figure 1
La sonde E-Au@Rf@Lum, un outil de diagnostic et de thérapie anti-tumorale
. E. coli
, utilisée comme support de sonde, permet la décomposition du peroxyde d’hydrogène (H
2
O
2
) en dioxygène (O
2
) et par conséquent la production d’espèces réactives de l’oxygène (ERO). Ces ERO permettent, par thérapie photodynamique, la mort cellulaire mais également l’émission de chimioluminescence facilitant ainsi le diagnostic par imagerie. L’émission de lumière va également, via transfert d’énergie de résonnance par chimioluminescence (CRET), permettre la production excessive des ERO.
|
|
Synthèse et caractérisation de la sonde E-Au@Rf@Lum
Pour synthétiser la sonde auto-déclenchable
in situ
,
E. coli a
été cultivée avec de l’acide chloraurique (HAuCl
4
), lui permettant de biosynthétiser des nanoparticules d’or (Au NP) à sa surface en conditions anaérobies grâce au phénomène de transfert d’électrons extra-cellulaires connu chez les micro-organismes. Les auteurs ont ainsi montré par microscopie électronique à transmission que les nanoparticules étaient synthétisées et possédaient une forte affinité pour la surface des bactéries. Par la suite, les bactéries (E)
E. coli
@Au NPs ont été mises en présence de Riboflavine (Rf), une vitamine essentielle à la réduction d’ERO, et de Luminol (Lum), un composé chimique utilisé pour son activité de chimioluminescence, afin de permettre à ces derniers de s’ancrer à l’or (Au) présent à leur surface, l’ensemble formant la sonde nommée E-Au@Rf@Lum. De ce fait, la chimioluminescence du Luminol est absorbée par la Riboflavine en temps réel. Ainsi, la Riboflavine est capable de photosensibiliser l’oxygène en ERO, dont la production excessive va exercer un rôle anti-tumoral mais aussi dans un second temps suractiver le Luminol, émettant une lumière détectable à 425 nm. Cette chimioluminescence à l’intensité augmentée peut ainsi être utilisée en imagerie des cellules tumorales pour diagnostiquer le cancer.
|
Sonde E-Au@Rf@Lum : Absorption intracellulaire spécifique, cytotoxicité et production d’ERO
La spécificité d’absorption de la sonde E-Au@Rf@Lum par les cellules tumorales a d’abord été démontrée par microscopie confocale à balayage laser, la sonde ayant été spécifiquement absorbée par une lignée de cellules cancéreuses mammaires (MCF-7) mais pas par des cellules hépatocytaires saines (LO2). L’efficacité cytotoxique de la thérapie photodynamique a ensuite été démontrée
in vitro
par un test de viabilité cellulaire par cytométrie en flux. Les résultats ont montré un taux d’apoptose de 74 % pour les cellules cancéreuses contre moins de 5 % pour les cellules saines, confirmant l’efficacité et la spécificité de la nanosonde vis-à-vis des cellules tumorales.
La génération d’ERO a également été observée afin de vérifier l’efficacité combinée du Luminol et de la Riboflavine. En présence de la sonde, la production intracellulaire d’ERO observée dans les cellules cancéreuses était similaire en conditions hypoxique et normoxique, traduisant la capacité de la sonde à réduire l’hypoxie tumorale.
Fort de ces premiers résultats menés
in vitro
, l’utilisation d’une telle thérapie anti-tumorale se devait d’être testée dans des modèles pré-cliniques !
|
Efficacité de la sonde E-Au@Rf@Lum
in vivo
En raison de l’intéressante biocompatibilité de la nanosonde ainsi que de son efficacité anti-tumorale
in vitro
, les expérimentations se sont poursuivies
in vivo
dans un modèle de souris BALB/C porteuses de tumeurs mammaires. L’objectif ici était d’évaluer l’impact de la sonde sur la croissance tumorale après son injection par voie intraveineuse. La biodistribution de la sonde a été évaluée
in vivo
par détection de la fluorescence et a mis en évidence une forte concentration de la sonde spécifiquement au niveau de la tumeur. Ensuite, les auteurs ont évalué l’effet thérapeutique des sondes administrées quotidiennement sur une période de 14 jours. Aucune perte de poids n’a été détectée chez les souris traitées, et l’analyse histologique des organes n’a pas décelé la présence de lésions inflammatoires, suggérant l’absence d’effets secondaires délétères. Le volume initial de la tumeur a été multiplié par 10 dans le groupe de souris non traitées contre seulement 2 fois dans le groupe de souris ayant reçu la nanosonde et aucun développement de tumeurs secondaires n’a été rapporté dans ce groupe. Enfin, l’analyse histologique des tumeurs a permis d’observer que seules les cellules ayant absorbées la nanosonde présentaient des signes significatifs d’apoptose, de fibrose et de nécrose.
Pour conclure, le développement d’une nanosonde auto-déclenchable fondée sur l’utilisation de la bactérie
E. coli
apparait comme un « outil » prometteur pour le diagnostic et le traitement de tumeurs solides grâce, entre autres, à la limitation du phénomène d’hypoxie. Si l’émission spécifique de chimioluminescence facilite la détection des cellules cancéreuses, elle conduit également à la production d’ERO et ainsi à la mise en place d’une thérapie photodynamique en profondeur. L’ensemble de ces travaux suggère une potentielle application médicale de la nanosonde E-Au@Rf@Lum.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article
.
|
1.
Lapôtre-Ledoux
B
,
Remontet
L
,
Uhry
Z
,
et al.
.
Incidence des principaux cancers en France métropolitaine en 2023 et tendances depuis 1990.
.
Bull Épidémiol Hebd
.
2023;
;
12-13
:
:188.
–
204
.
2.
Thiruppathi
J
,
Vijayan
V
,
Park
IK
,
et al.
.
Enhancing cancer immunotherapy with photodynamic therapy and nanoparticles : making tumor microenvironment hotter to makenanoparticle :etic work better.
.
Front Immunol
.
2024;
15
:
:1375767.
.
3.
Yang
BW
,
Chen
Y
,
Shi
JL.
Reactive Oxygen Species (ROS)-Based Nanomedicine.
.
Chem Rev
.
2019;
;
119
:
:4881.
–
985
.
4.
Tao
N
,
Li
HH
,
Deng
L
,
et al.
.
A Cascade Nanozyme with Amplified Sonodynamic Therapeutic Effects through Comodulation of Hypoxia and Immunosuppression against Cancer.
.
ACS Nano
.
2022;
;
16
:
:485.
–
501
.
5.
Zhang
L
,
Jiang
FL
,
Guo
QL
,
et al.
.
pH-Sensitive Bioprobe for Multichannel Mitochondrial Imaging and Photodynamic Therapy.
.
Anal Chem ;
.
2022;
;
94
:
:4126.
–
33
.
6.
Zhang
H
,
Yao
M
,
Feng
L
,
et al.
.
Escherichia coli-Based In Situ Triggerable Probe as an Amplifier for Sensitive Diagnosis and Penetrated Therapy of Cancer.
.
Anal Chem
.
2023;
;
95
:
:13073.
–
81
.
7.
Zai
WJ
,
Kang
L
,
Dong
TJ
,
et al.
.
E. coli Membrane Vesicles as a Catalase Carrier for Long-Term Tumor Hypoxia Relief to Enhance Radiotherapy.
.
ACS Nano
.
2021;
;
15
:
:15381.
–
94
.
8.
Li
XS
,
Kwon
NY
,
Guo
T
,
et al.
.
Innovative Strategies for Hypoxic-Tumor Photodynamic Therapy.
.
Angew Chem Int Ed
.
2018;
;
57
:
:11522.
–
31
.
9.
Zhu
Y
,
Jin
D
,
Liu
MM
,
et al.
.
Oxygen Self-Supply Engineering-Ferritin for the Relief of Hypoxia in Tumors and the Enhancement of Photodynamic Therapy Efficacy.
.
Small
.
2022;
;
18
:
:2200116.
.
|