| |
| Med Sci (Paris). 41(2): 145–153. doi: 10.1051/medsci/2025010.Il n’y a pas que l’alphabet viral qui menace le foie Florentin Pastor,1$ Marion Delphin,2$ Julie Lucifora,1* and Eloi R. Verrier3** 1CIRI, Centre international de recherche en infectiologie, Université de Lyon, Inserm U1111, Université Claude Bernard Lyon 1, CNRS, UMR5308, ENS de Lyon
,
Lyon
,
France 2The Francis Crick Institute
,
Londres
,
Royaume-Uni 3Université de Strasbourg, Inserm, ITM UMR_S1110
,
Strasbourg
,
France |
Vignette (© Eloi R. Verrier).
Le foie est le plus grand organe interne du corps humain. Il remplit des fonctions majeures dans la digestion, la détoxification des substances exogènes, la synthèse des protéines sanguines, ainsi que dans le métabolisme des glucides et des lipides [
1
]. Il est majoritairement composé d’hépatocytes, qui correspondent à 70 % de la masse hépatique et effectuent la plupart des fonctions métaboliques de l’organe [
2
]. La seconde population de cellules hépatiques est représentée par les cholangiocytes, cellules de l’épithélium biliaire. Le foie contient également des macrophages résidents, les cellules de Kupffer
1,
, qui jouent un rôle central dans la réponse inflammatoire et immunitaire hépatique. Les cellules de Ito
2
, ou cellules étoilées [
67
] (
→
) permettent le stockage de la vitamine A et jouent un rôle important dans la production de la matrice extracellulaire, notamment lors du développement de la fibrose en cas de lésion hépatique. Enfin, les cellules endothéliales assurent le passage des nutriments et les échanges entre le sang et les cellules hépatiques. Le sang qui perfuse le foie provient majoritairement des intestins, du pancréas et de la rate. La circulation sanguine vers le foie est assurée
in fine
par la veine porte, et elle expose l’organe aux antigènes alimentaires et aux agents pathogènes circulants. Une des caractéristiques remarquables du foie suite à cette exposition constante est une balance finement équilibrée entre immunotolérance et réponse efficace contre les agents infectieux [
3
] (
→
).
(→) Voir
m/s
n° 12, 2023, page 921
(→) Voir
m/s
n° 11, 2007, page 985
Cet équilibre complexe n’empêche pas le foie d’être la cible d’infections par de très nombreux virus, parfois responsables d’inflammations ou d’hépatites, qui peuvent être fulminantes, aiguës, ou chroniques. Parmi les virus les plus fréquemment associés aux hépatites, se retrouvent les virus « alphabétiques », dont les mieux documentés sont les virus des hépatites A, B, C, D et E (de HAV à HEV), qui sont caractérisés par un hépatotropisme presque exclusif et dont les conséquences cliniques sont parfois dramatiques. A titre d’exemple, avec 254 millions de patients chroniquement infectés et 1,1 million de morts par an, le virus HBV est la première cause de cancer du foie dans le monde [
4
]. Cependant, les virus susceptibles de causer des dommages hépatiques sont beaucoup plus nombreux, notamment parmi les virus endémiques des populations humaines, comme certains
Herpesviridae
tels que le virus Epstein-Barr (EBV), le cytomégalovirus humain (HCMV), ou encore les virus de l’herpès simplex (HSV) -1 et -2 [
5
]. Si les complications associées à ces hépatites virales apparaissent très majoritairement chez les patients immunodéprimés, elles incluent néanmoins des hépatites fulminantes parfois mortelles. Par ailleurs, de nombreux virus émergents ou ré-émergents, classés prioritaires par l’Organisation mondiale de la santé [
10
] et susceptibles de provoquer des pandémies, y compris en Europe, présentent des foyers de réplication dans le foie entraînant parfois des effets délétères pour cet organe ou l’organisme entier [
6
]. La compréhension des interactions entre ces virus et le foie est par conséquent un domaine d’intérêt public dans la lutte contre ces infections à haut risque et dans la préparation aux futures pandémies. Dans cette revue, nous détaillons l’état actuel des connaissances sur les infections hépatiques les mieux documentées.
|
Épidémiologie et transmission des virus hépatotropes
Au-delà des hépatites « alphabétiques », les virus les mieux documentés pour leurs capacités à affecter le foie et les fonctions hépatiques se trouvent parmi des arbovirus et d’autres virus zoonotiques responsables principalement de fièvres hémorragiques virales, parmi lesquels on trouve : 1) des membres de la famille de
Flaviviridae
, comme le virus de la fièvre jaune (YFV :
Yellow fever virus
), le virus de la dengue (DENV :
Dengue virus
) et le virus Zika (ZIKV). Ils sont caractérisés par un génome à ARN linéaire non segmenté simple brin à polarité positive ; 2) des virus appartenant à l’ordre récent des
Hareavirales
(classe des
Bunyaviricetes
), caractérisés par un génome sous forme d’ARN monocaténaire de polarité négative comme ceux des familles des
Nairoviridae
, dont le virus de la fièvre hémorragique de Crimée-Congo (CCHFV :
Crimean-Congo hemorrhagic fever virus
) ; des
Phenuiviridae
, dont le virus de la fièvre de la vallée du Rift (RVFV : Rift valley fever virus) ; et des
Arenaviridae
dont le virus de Lassa (LASV) ; 3) des
Filoviridae
, comme le virus Ebola (EBOV) à ARN monocaténaire de polarité négative.
Arbovirus
Les arbovirus partagent la particularité d’être transmis par des vecteurs arthropodes (moustique, moucheron piqueur, tique) lors de leur repas sanguin. En tant que filtre sanguin, le foie est une cible rapidement rencontrée par les virus circulants, ce qui explique en partie l’importance des symptômes hépatiques associés à ces infections virales. Initialement confinées aux régions tropicales, les arboviroses sont en expansion mondiale, notamment à cause du dérèglement climatique qui affecte la répartition des arthropodes vecteurs et des échanges anthropiques de plus en plus nombreux (
Tableau I
). Une récente étude de modélisation prévoit que les maladies liées aux moustiques
Aedes
3
deviendront de plus en plus fréquentes en Europe d’ici 2030, avec une augmentation des populations de moustiques dans des pays tels que l’Espagne, le Portugal et la Grèce [
7
]. En France, des foyers autochtones de dengue ont déjà été observés [
8
]. Le dérèglement climatique a également accéléré l’expansion des populations de tiques et des maladies virales associées, dont la fièvre hémorragique de Crimée-Congo [
9
].
Tableau I
|
Virus
(Famille)
|
Génome viral |
Estimations du nombre de cas |
Zones de prévalence élevée |
Modes de transmission principaux |
Traitements ou vaccins disponibles |
Réf. |
|
HAV
(Picornaviridae)
|
ARN+ |
Plusieurs dizaines de millions par an |
Afrique, Asie, Moyen Orient, Amérique du Sud et Amérique Centrale |
voie oro-fécale
|
vaccin efficace
|
[
13
,
14
]
|
|
|
HBV
(Hepadnaviridae)
|
ADN partiellement double brin |
254 millions de patients chroniques en 2022 |
Afrique et Asie du Sud-East |
transmission mère-enfant
échanges de fluides biologiques contaminés
|
vaccin efficace mais couverture vaccinale insuffisante
traitement non curatif (analogues de nucleo(s)tides)
|
[
4
,
13
]
|
|
|
HCV
(Flaviviridae)
|
ARN+ |
56 millions en 2020 (en regression) |
Méditerranée orientale, Asie du Sud-Est et Europe |
échanges de fluides biologiques contaminés
|
pas de vaccin
traitement curatif (sofosbuvir et daclatasvir)
|
[
13
]
|
|
|
HDV
(Kolmioviridae)
|
ARN- |
12-72 millions de porteurs chroniques estimés |
Afrique de l’Ouest et Asie centrale (Mongolie) |
transmission mère-enfant
échanges de fluides biologiques contaminés
|
vaccin HBV protège aussi contre HDV
traitement non-curatif (bulevirtide en Europe et en Australie)
|
[
13
]
|
|
|
HEV
(Hepeviridae)
|
ARN+ |
20 millions par an |
Asie, Afrique et Europe |
voie oro-fécale
zoonotique
|
1 vaccin approuvé en Chine et au Pakistan uniquement
|
[
13
]
|
|
|
DENV
(Flavirididae)
|
ARN+ |
100 – 400 millions par an |
Régions tropicales et subtropicales (80 pays touchés) |
piqûre de moustique infecté
transmission mère-enfant possible
|
pas de vaccin
pas de traitement
|
[
15
]
|
|
|
YFV
(Flavirididae)
|
ARN+ |
Entre 80 000 et 200 000 cas par an |
Afrique et Amérique du Sud |
piqûre de moustique infecté
|
vaccin efficace mais couverture vaccinale en déclin
pas de traitement
|
[
16
]
|
|
|
ZIKV
(Filoviridae)
|
ARN+ |
Incidence cumulative estimée en 2020 en Amérique : 2.34 pour 100 000 |
Amérique, Brézil, Polynésie Française, etc… 89 pays et territoires ont signalé cas. |
piqûre de moustique infecté
transmission sexuelle
|
pas de vaccin
pas de traitement
|
[
17
–
19
]
|
|
|
RVFV
(Phenuiviridae)
|
ARN- |
9 épisodes majeurs : 4 500 cas |
Afrique subsaharienne et péninsule arabique |
exposition au sang et tissus d’animaux infectés
piqûre de moustique infecté
ingestion de lait cru non pasteurisé d’animaux infectés
|
pas de vaccin, mais nombreux candidats vaccins
pas de traitement
|
[
20
–
22
]
|
|
|
CCHFV
(Nairoviridae)
|
ARN- |
Au moins 20 000 cas signalés dans le monde |
Afrique, Balkans, Moyen-Orient et Asie |
piqûres de tiques
contact avec du sang ou des tissus d’animaux infectés
transmission interhumaine par contact avec fluides biologiques
|
pas de vaccin
ribavirine mais efficacité discutée
|
[
23
] (
→
) Voir
m/s
n° 2, 2021, page 135
|
|
|
SARS-Cov2
(Coronaviridae)
|
ARN+ |
770 millions depuis le début de la pandémie |
Le monde entier |
aérosol / gouttelettes
|
vaccins (Pfizer-BioNTech…)
traitements pour les formes sévères (Nirmatrelvir/ritonavir, Molnupiravir …)
|
[
24
–
26
]
|
|
|
EBOV
(Flavirididae)
|
ARN- |
28 646 cas recensés pour l’épidémie qui toucha l’Afrique de l’Ouest en 2014 et 2015 |
Afrique centrale et Afrique de l’Est |
contact avec des fluides biologiques d’animaux infectés (chauves-souris, chimpanzés, etc..)
transmission interhumaine par contact avec des fluides biologiques
|
vaccin pour une seule souche
Inmazeb et Ebanga (anticorps monoclonaux)
remdesivir
|
WHO 2016 WHO 2024 [
27
]
|
|
|
LASV
(Arenaviridae)
|
ARN ambisens |
Entre 100 000 et 500 000 par an |
Afrique de l’Ouest |
Ingestion d’aliments souillés par des excréments de
Mastomys natalensis
, consommation de rats infectés.
Transmission interhumaine par contact avec les fluides biologiques
|
Pas de vaccin
ribavirin
|
[
28
]
|
Principaux virus hépatotropes.
|
EBOV et LASV
Les virus zoonotiques EBOV et LASV sont responsables de fièvres hémorragiques particulièrement graves associées à une mortalité élevée (
Tableau I
). Ces virus ont un tropisme cellulaire et tissulaire très large. Ils se retrouvent rapidement dans la circulation sanguine, ce qui leur permet d’infecter également le foie. Ils partagent la particularité d’être transmis par des mammifères réservoirs, primates non humains ou chauvessouris, notamment pour le virus EBOV, et rongeurs du genre
Mastomys
pour LASV (
Tableau I
). L’accroissement de la déforestation permet une proximité accrue entre les êtres humains et la faune sauvage, favorisant ainsi les interactions directes et donc la transmission potentielle de virus zoonotiques. La transmission à l’être humain se fait par contact avec des fluides corporels ou par la consommation de viande d’animaux infectés. La transmission interhumaine est également possible par contact avec des fluides corporels d’un patient infecté.
SARS-CoV-2
Cas particulier dans ce tableau des zoonoses, le virus SARS-CoV-2 (
severe acute respiratory syndrome coronavirus 2)
est également responsable d’infections hépatiques. Ce virus respiratoire, cause de la pandémie mondiale de la Covid-19 en 2020 (
Tableau I
), présente un tropisme cellulaire dépendant de l’expression de ses principaux récepteurs, notamment l’enzyme ACE2, majoritairement exprimés à la surface des cellules respiratoires. Cependant, sa capacité à se lier aux macrophages [
11
] voire à se répliquer dans les cellules endothéliales des vaisseaux sanguins pulmonaires [
12
] conduisent à sa dissémination dans l’organisme, y compris le foie via la circulation sanguine.
Tous ces virus partagent la même capacité à cibler le foie, avec la particularité de provoquer des dommages hépatiques parfois sévères et d’affecter ses différentes fonctions. |
Manifestations hépatiques cliniques
Les manifestations hépatiques cliniques des infections virales dépendent du site de réplication des virus, de leur mode de réplication (virus lytique ou non), de la capacité de l’organisme à répondre à la présence du virus et de la persistance ou non de l’infection. L’inflammation du foie ou hépatite qui résulte de la réplication active des virus se manifeste sous plusieurs formes : 1) L’hépatite fulminante, très rare mais extrêmement grave, caractérisée par la destruction massive du foie entraînant une insuffisance hépatique en quelques jours ; 2) L’hépatite aiguë, caractérisée par une inflammation durant quelques semaines, qui peut être asymptomatique ou accompagnée de fatigue, ictère (jaunisse) et douleurs abdominales ; 3) L’hépatite chronique, caractérisée par une infection et une inflammation qui persistent plus de 6 mois, qui est responsable du développement des maladies avancées du foie, au gré de la progression de la fibrose hépatique, pouvant conduire à la cirrhose et au carcinome hépatocellulaire. Dans le cadre des infections virales, ces formes chroniques sont surtout associées aux infections par les virus HBV, HCV et HDV, qui sont les premières causes de carcinome hépatocellulaire au monde, mais également aux infections par le virus HEV, chez les personnes immunodéprimées [
29
].
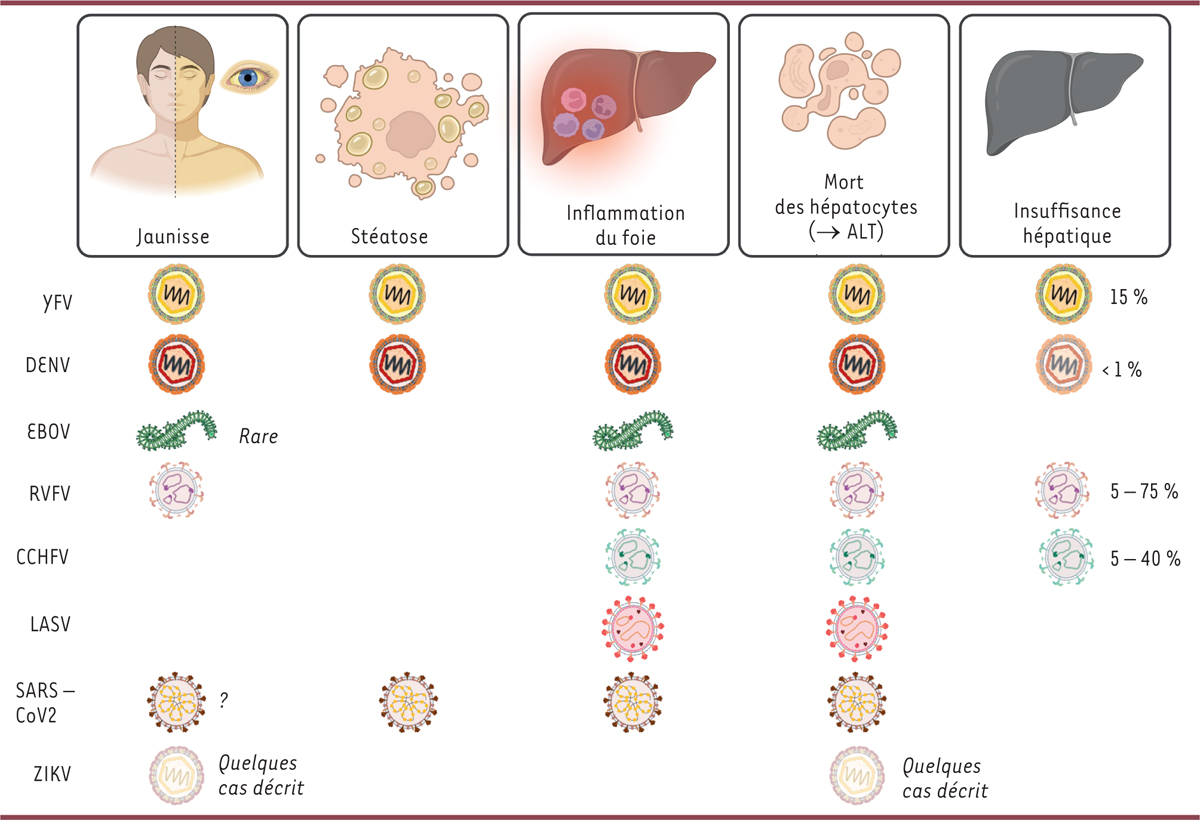
Dans le cadre des hépatites non « alphabétiques », associées aux virus zoonotiques, les inflammations sont fulminantes ou aiguës, souvent symptomatiques, avec un risque d’insuffisance hépatique marquée, notamment pour les infections par des virus de fièvres hémorragiques (
Figure 1
).
 | Figure 1
Atteintes hépatites cliniques causées par les virus hépatotropes
.
Les pourcentages indiquent la fréquence des atteintes hépatiques associées aux infections virales décrite dans la littérature.
|
Infections par les flavivirus
Les manifestations hépatiques qui accompagnent les infections par des flavivirus sont typiques d’hépatites aiguës, avec un tableau clinique général marqué par une augmentation des transaminases sanguines, des marqueurs de mort hépatocytaire, accompagnées parfois d’un ictère et d’une perturbation des fonctions hépatiques [
30
]. Parmi ces virus, les cas d’infection par le virus de la dengue sont les plus documentés dans la littérature scientifique, avec un spectre symptomatique très large qui va de l’hépatite asymptomatique à l’insuffisance hépatique critique [
31
]. En fonction des études, de 50 % à près de 100 % des patients infectés par le virus DENV présentent une élévation des transaminases sanguines et une hépatomégalie est souvent rapportée, associée à des douleurs abdominales et des nausées [
31
]. Les anomalies histologiques du foie associées à la Dengue comprennent la stéatose microvésiculaire (présence de vésicules lipidiques dans le cytoplasme des cellules), ainsi que la mort des hépatocytes et des cellules de Kupffer [
31
]. La dégradation des fonctions hépatiques chez les patients infectés par le virus DENV peut aller jusqu’à l’insuffisance hépatique, estimée entre 0,3 % et 1,1 % des cas, avec une mortalité de 20 % à 68 % [
15
]. Cependant, dans quelques études réalisées en Asie et portant sur des enfants infectés par le virus DENV, ces estimations montent entre 15 % et 35 % des cas [
31
]. Le rôle de l’infection
per se
dans l’apparition de l’insuffisance hépatique est difficile à déterminer et à dissocier de l’utilisation concomitante du paracétamol, dont l’hépatotoxicité est aujourd’hui reconnue. Il est à noter également que le virus DENV est suspecté d’être responsable d’une aggravation de la maladie hépatique chez les patients chroniquement infectés par le virus HBV, pouvant conduire à une hépatite fulminante [
32
].
Le foie est l’organe le plus communément touché lors d’infections par le virus YFV, dont le tropisme hépatique est bien documenté, comme indiqué par le nom de la maladie associée, la « fièvre jaune » [
30
]. Si les données cliniques sont moins nombreuses que pour le virus DENV, les symptômes sont comparables, combinant ictère, élévation des transaminases et stéatose des hépatocytes. Les cas graves de fièvre jaune, concernant entre 10 % et 15 % des patients, pour un taux de mortalité élevé de l’ordre de 40 % à 50 %. Les symptômes se présentent comme un dysfonctionnement général de nombreux organes, associant encéphalopathies, troubles du rythme cardiaque et insuffisance hépatique, nécessitant une transplantation hépatique [
6
,
33
].
En revanche et en dépit d’une réplication avérée dans le foie [
34
], les symptômes hépatiques induits par une infection par le virus ZIKV sont moins prononcés, même si des cas d’ictère ont été documentés [
35
] et qu’un cas présentant une atteinte hépatique sévère a été rapporté [
36
].
Il est à noter que la plupart des symptômes hépatiques observés en clinique ont été confirmés lors de challenges infectieux
in vivo
(modèles murins notamment) par les trois flavivirus, attestant d’une atteinte hépatique directe et entraînant des dysfonctionnements du foie pour YFV et DENV, combinant augmentation des transaminases, résistance à l’insuline, stéatose et apoptose des hépatocytes [
30
].
Autres fièvres hémorragiques et atteintes hépatiques
Les virus responsables de fièvres hémorragiques sont susceptibles de causer des dommages considérables à de nombreux organes, y compris le foie. Lors d’une infection par le virus CCHFV, les atteintes hépatiques se manifestent lors de la 3
e
phase de la maladie, dite hémorragique, et sont caractérisées par une dégradation très rapide des fonctions hépatiques avec une augmentation progressive des transaminases dans le sang et une insuffisance hépatique aiguë. Le taux de mortalité 2 semaines après l’apparition des symptômes peut monter jusqu’à 40 %, voire plus, selon les études [
37
]. La fulgurance de la progression de la maladie rend complexe l’étude des atteintes hépatiques causées par le virus, mais quelques études histologiques
post-mortem
rapportent une nécrose hépatocytaire et une hyperplasie des cellules de Kupffer [
38
].
L’hépatite aiguë fait également partie du tableau clinique lors d’infections par le virus LASV, avec une élévation marquée des transaminases estimée chez plus de 50 % des patients, même si, de l’avis même des auteurs, les données mériteraient d’être consolidées [
39
]. Là encore, des dommages hépatiques, dont la mort des hépatocytes, ont été constatés lors des études
post-mortem
[
6
].
Enfin, le virus EBOV est responsable de dommages systémiques importants, l’infection étant symptomatique chez 90 % des patients avec un taux de mortalité extrêmement élevé de plus de 50 % par défaillance de nombreux organes. Il est à noter que chez les personnes infectées par le virus EBOV, l’élévation des transaminases, témoignant de l’importance de l’atteinte hépatique, est un facteur de mauvais pronostic, [
6
]. Des foyers de nécroses hépatocytaires sont retrouvés chez les patients [
40
] (
→
) et dans un modèle murin, où ils sont attribués à la réplication lytique du virus et à la réponse des cellules NK (
natural killers
) [
41
]. Plus généralement, la présence du virus dans le foie et les affections hépatiques sont retrouvés dans l’ensemble des modèles mammifères d’étude du virus EBOV, que ce soit chez la souris, le cochon d’Inde, le hamster, ou les macaques, ces derniers récapitulant particulièrement bien les symptômes associés à l’infection chez l’être humain [
42
].
(→) Voir
m/s
n° 2, 2015, page 143
SARS-CoV-2
Les atteintes hépatiques font également partie du tableau clinique lors d’une infection par le virus SARS-CoV-2, avec apparition d’un ictère dans 5 % à 18 % des cas, ainsi qu’une élévation des transaminases chez 10 % à 50 % des patients [
43
,
44
]. Par ailleurs, la présence d’une maladie hépatique préexistante est un facteur de mauvais pronostic, avec notamment un risque accru de forme grave de la COVID-19 (40 % de mortalité) chez les patients présentant une cirrhose décompensée
4
[
45
]. Des cas de décompensation aiguë de la cirrhose en présence du virus SARS-CoV-2 ont également été rapportés, même s’il convient d’être prudent, car il est difficile à ce stade de conclure si cette décompensation est due à la réplication virale seule ou à la prise de médicaments utilisés pour traiter l’infection (dont ritonavir, paracétamol…) [
46
].
Les tableaux cliniques hépatiques associés aux infections virales non « alphabétiques » sont donc variés mais présentent des points communs, notamment une inflammation et une nécrose hépatocytaires. Ces affections sont en partie le reflet du tropisme cellulaire des virus dans le foie. |
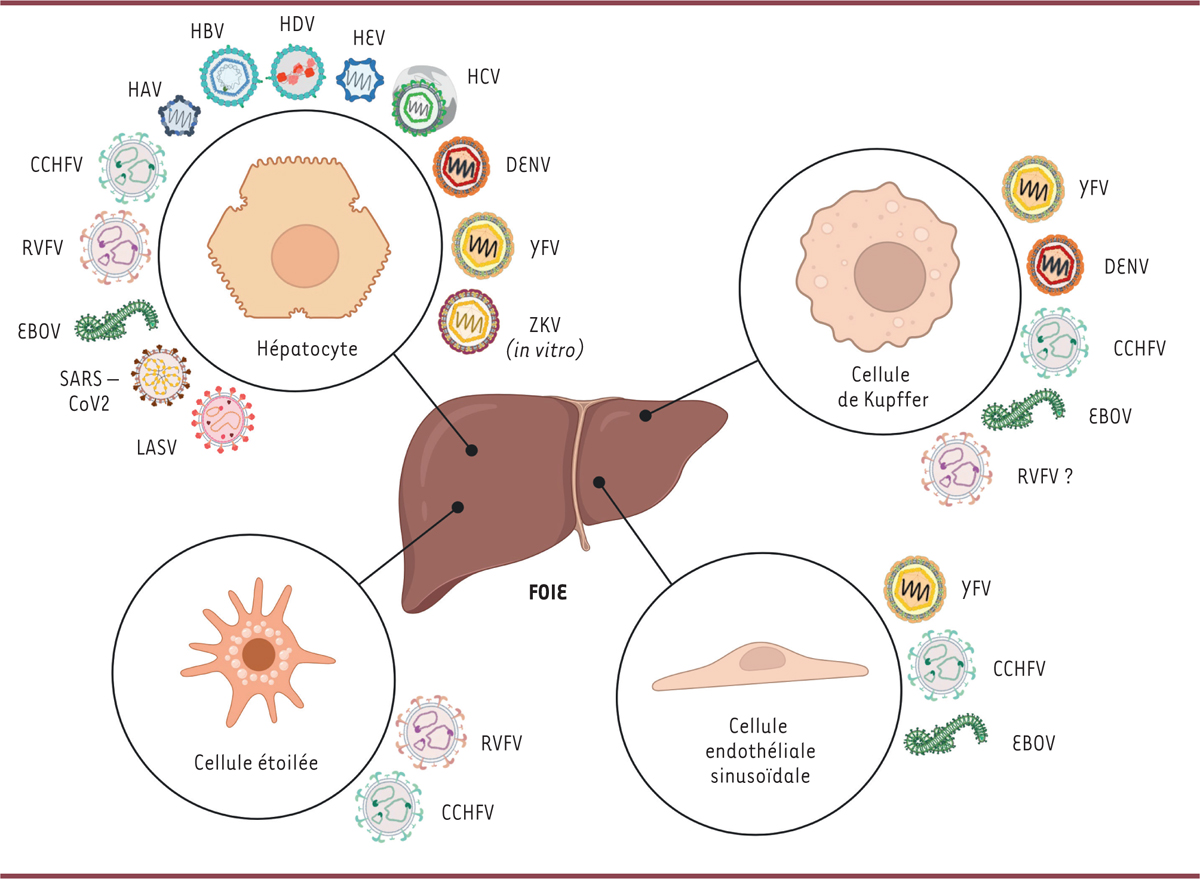
Tropisme hépatique des virus non « alphabétiques » Hépatocytes
Le foie est principalement composé d’hépatocytes, cellules très différenciées, qui sont la cible des virus « alphabétiques » dans lesquels ils se répliquent parfois presque exclusivement (en particulier HBV). Les virus non « alphabétiques » peuvent également infecter les hépatocytes, comme montré par les études histologiques réalisées sur des biopsies de foies de patients, montrant la présence des virus DENV [
47
–
50
], YFV [
51
], CCHFV [
38
], RVFV [
52
] et SARS-CoV-2 [
44
] dans les hépatocytes (
Figure 2
). Comme indiqué précédemment, l’observation de nécroses hépatocytaires chez les patients infectés par le virus EBOV [
40
], ou le virus LASV [
6
], suggère également qu’il y a une réplication active du virus dans les hépatocytes de ces patients. Ces observations histologiques sont soutenues par des études expérimentales attestant d’une réplication de ces virus dans les hépatocytes
in vivo
. Parmi les études réalisées dans des modèles animaux, citons 1) la présence du virus CCHFV qui est attestée après infection de modèles murins [
53
] et simiens [
54
]. 2) De très nombreux modèles mammifères existent pour le virus RVFV. Ils ont permis de mettre en évidence la présence du virus dans les hépatocytes et une apoptose associée, en particulier chez la souris [
55
]. 3) Les dommages hépatiques causés par le virus DENV et sa présence dans les hépatocytes sont également démontrés dans des modèles murins [
56
].
 | Figure 2
Tropisme cellulaire des virus hépatotropes
.
|
Enfin, quelques études rapportent la modélisation de l’infection dans des hépatocytes ou cellules dérivées
in vitro
. Si l’utilisation d’hépatocytes primaires humains est contraignante, des lignées cellulaires dérivées de cancer du foie constituent, dans une relative mesure, une première approche pour étudier la capacité de ces virus à se répliquer dans les hépatocytes. Les lignées cellulaires Huh7 et HepG2, ainsi que d’autres lignées dérivées de celles-ci, ou encore des modèles plus complexes, à base de cellules de type hépatocytaire dérivées de cellules souches pluripotentes induites (iPSC), ont permis l’étude des interactions moléculaires entre les virus hépatotropes et ces cellules, et de quantifier les effets cytopathiques, voire de caractériser de nouvelles molécules antivirales [
57
–
61
].
Cellules de Kupffer et autres types cellulaires
Les cellules de Kupffer sont les macrophages résidents du foie, impliqués dans la réponse aux agents pathogènes. Ces cellules ont la capacité de phagocyter les pathogènes venant de la circulation, et/ou des hépatocytes infectés. Par conséquent, il est difficile de déterminer si la présence du virus au sein des cellules de Kupffer est le résultat de la phagocytose ou d’une réplication active des virus. La présence du virus DENV a été attestée dans les cellules de Kupffer. Bien que l’infection ne soit pas productive, cette présence est associée à l’apoptose des cellules [
62
]. De même, il n’y a pas de preuve directe de l’infection des cellules de Kupffer par le virus RVFV, malgré l’immunoréactivité constatée en présence du virus, dans un modèle murin [
55
]. À l’inverse, la réplication active du virus YFV dans les cellules de Kupffer a été démontrée
in vitro
, associée à la production d’une réponse pro-inflammatoire [
63
]. Le virus CCHFV est également susceptible de se répliquer au sein des macrophages hépatiques, qui seraient les premières cellules du foie infectées, causant par ailleurs leur destruction [
53
,
54
]. La réplication du virus EBOV a été démontrée expérimentalement dans des cellules de Kupffer primaires murines [
64
]. De manière plus anecdotique, les autres types cellulaires présents dans le foie sont également susceptibles d’être la cible d’une infection par ces virus, comme par exemple les cellules étoilées qui sont infectées par le virus RVFV [
55
], à l’origine de leur dégénérescence, et le virus CCHFV [
38
], ou les cellules endothéliales au sein desquelles les virus CCHFV [
54
] et EBOV [
65
] ont la capacité de se répliquer.
|
En plus des virus « alphabétiques », le foie est la cible de très nombreux agents pathogènes susceptibles de causer des dommages importants, parfois irréversibles et aux conséquences fatales, vu l’importance de cet organe dans le maintien de l’homéostasie. Dans cette revue, nous nous sommes concentrés sur des virus zoonotiques d’importance au vu de leur risque épidémique, mais la liste des virus hépatotropes est susceptible d’être beaucoup plus longue, tant de nombreux virus « exotiques » sont associés à des dommages hépatiques, comme les hantavirus [
6
], ou encore le virus du Nil occidental (
West Nile virus
) [
66
]. Dans le cas des fièvres hémorragiques, les affections hépatiques sont associées à un mauvais pronostic, d’où l’importance de connaître avec précision les modalités d’infection et de réplication de ces virus dans les cellules hépatiques. En comparaison des virus « alphabétiques », pour lesquels les connaissances moléculaires des interactions hôtevirus s’accumulent depuis des dizaines d’années, il existe aujourd’hui peu d’études nous permettant de comprendre le tropisme hépatique de ces virus « exotiques ». Or, dans un contexte de risques épidémiques et pandémiques liés aux zoonoses virales en constante augmentation, y compris sous les latitudes européennes et en l’absence de traitement efficace contre ces virus, leur tropisme commun pour les cellules hépatiques doit être vu comme une opportunité, nous permettant de les étudier à partir de modèles uniques et d’envisager, dans le meilleur des cas, le développement de nouvelles stratégies antivirales à large spectre contre ces menaces majeures de santé publique.
|
À l’exception des virus, les figures de cette revue ont été réalisées sur BioRender (
https://BioRender.com
). Licence 2024 accordée à Julie Lucifora.
Figure 1
:
https://BioRender.com/k77f999
.
Figure 2
:
https://BioRender.com/m15r966
. Résumé graphique :
https://BioRender.com/k71u750
. Ce travail de l’Institut Thématique Interdisciplinaire IMCBio+, dans le cadre du programme ITI 2021-2028 de l’université de Strasbourg, du CNRS et de l’Inserm, a été soutenu par l’IdEx Unistra (ANR-10-IDEX-0002), ainsi que par le projet SFRI-STRAT’US (ANR-20-SFRI-0012) et l’EUR IMCBio (ANR-17-EURE-0023) dans le cadre du Programme d’Investissements d’Avenir
.
|
Footnotes |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article
.
|
1.
Trefts
E
,
Gannon
M
,
Wasserman DH. The liver.
.
Curr Biol
.
2017;
;
27
:
:R1147.
–
R51
.
2.
Si-Tayeb
K
,
Lemaigre
FP
,
Duncan SA. Organogenesis and development of the liver.
.
Dev Cell
.
2010;
;
18
:
:175.
–
89
.
3.
Lapierre
P
,
Alvarez
F.
Le foie : un organe du système immunitaire ?
Med Sci (Paris)
.
2007;
;
23
:
:985.
–
90
.
6.
van Leeuwen
LPM
,
de Jong
W
,
Doornekamp
L
,
et al.
.
Exotic viral hepatitis: A review on epidemiology, pathogenesis, and treatment.
.
J Hepatol
.
2022;
;
77
:
:1431.
–
43
.
7.
Iwamura
T
,
Guzman-Holst
A
,
Murray
KA.
Accelerating invasion potential of disease vector Aedes aegypti under climate change.
.
Nat Commun
.
2020;
;
11
:
:2130.
.
8.
Succo
T
,
Leparc-Goffart
I
,
Ferre
JB
,
et al.
.
Autochthonous dengue outbreak in Nimes, South of France, July to September 2015.
.
Euro Surveill
.
2016
;
:21.
.
9.
Semenza
JC
,
Paz
S.
Climate change and infectious disease in Europe: Impact, projection and adaptation.
.
Lancet Reg Health Eur
.
2021;
;
9
:
:100230.
.
11.
Park
MD.
Macrophages: a Trojan horse in COVID-19?
Nat Rev Immunol
.
2020;
;
20
:
:351.
.
12.
Deinhardt-Emmer
S
,
Wittschieber
D
,
Sanft
J
,
et al.
.
Early postmortem mapping of SARS-CoV-2 RNA in patients with COVID-19 and the correlation with tissue damage.
.
Elife
.
2021
;
:10.
.
13.
Usuda
D
,
Kaneoka
Y
,
Ono
R
,
et al.
.
Current perspectives of viral hepatitis.
.
World J Hepatol
.
2024;
;
30
:
:2402.
–
17
.
14.
Wasley
A
,
Fiore
A
,
Bell
BP.
Hepatitis A in the era of vaccination.
.
Epidemiol Rev
.
2006;
;
28
:
:101.
–
11
.
15.
Leowattana
W
,
Leowattana
T.
Dengue hemorrhagic fever and the liver.
.
World J Hepatol
.
2021;
;
13
:
:1968.
–
76
.
16.
Douam
F
,
Ploss
A.
Yellow Fever Virus: Knowledge Gaps Impeding the Fight Against an Old Foe.
.
Trends Microbiol
.
2018;
;
26
:
:913.
–
28
.
17.
Schwartz
O
,
Albert
ML.
Biology and pathogenesis of chikungunya virus.
.
Nat Rev Microbiol
.
2010;
;
8
:
:491.
–
500
.
18.
Burt
FJ
,
Chen
W
,
Miner
JJ
,
et al.
.
Chikungunya virus: an update on the biology and pathogenesis of this emerging pathogen.
.
Lancet Infect Dis
.
2017;
;
17
:
:e107.
–
17
.
20.
Odendaal
L
,
Davis
AS
,
Venter EH. Insights into the Pathogenesis of Viral Haemorrhagic Fever Based on Virus Tropism and Tissue Lesions of Natural Rift Valley Fever.
.
Viruses
.
2021;
;
13
:
:709.
.
21.
Nair
N
,
Osterhaus
A
,
Rimmelzwaan
GF
,
Prajeeth
CK.
Rift Valley Fever Virus-Infection, Pathogenesis and Host Immune Responses.
.
Pathogens
.
2023;
;
12
:
:1174.
.
22.
Kitandwe
PK
,
McKay
PF
,
Kaleebu
P
,
Shattock RJ. An Overview of Rift Valley Fever Vaccine Development Strategies.
.
Vaccines (Basel)
.
2022;
;
10
:
:1794.
.
23.
Reynard
O
,
Ritter
M
,
Martin
B
,
Volchkov
V.
La fièvre hémorragique de Crimée-Congo, une future problématique de santé en France ?
Med Sci (Paris)
.
2021;
;
37
:
:135.
–
40
.
24.
Cascella
M
,
Rajnik
M
,
Aleem
A
,
et al.
.
Features, Evaluation, and Treatment of Coronavirus (COVID-19).
.
[Updated 2023 Aug 18]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024 Jan-. Disponible :
https://www.ncbi.nlm.nih.gov/books/NBK554776/
25.
Wang
L
,
Wang
Y
,
Ye
D
,
Liu
Q.
Review of the 2019 novel coronavirus (SARS-CoV-2) based on current evidence.
.
Int J Antimicrob Agents
.
2020;
;
55
:
:105948.
.
26.
Markov
PV
,
Ghafari
M
,
Beer
M
,
et al.
.
The evolution of SARS-CoV-2.
.
Nat Rev Microbiol
.
2023;
;
21
:
:361.
–
79
.
27.
Bodmer
BS
,
Hoenen
T
,
Wendt
L.
Molecular insights into the Ebola virus life cycle.
.
Nat Microbiol
.
2024;
;
9
:
:1417.
–
26
.
28.
Houlihan
C
,
Behrens
R.
Lassa fever.
.
BMJ
.
2017;
;
358
:
:j2986.
.
29.
Pawlotsky
JM.
Virological markers for clinical trials in chronic viral hepatitis.
.
JHEP Rep
.
2024;
;
6
:
:101214.
.
30.
Pinheiro
BSS
,
Rodrigues
JG
,
Dias
FCR
,
et al.
.
Hepatic damage caused by flaviviruses: A systematic review.
.
Life Sci
.
2023;
;
331
:
:122074.
.
31.
Samanta
J
,
Sharma
V.
Dengue and its effects on liver.
.
World J Clin Cases
.
2015;
;
3
:
:125.
–
31
.
32.
Agarwal
MP
,
Giri
S
,
Sharma
V
,
et al.
.
Dengue causing fulminant hepatitis in a hepatitis B virus carrier.
.
Biosci Trends
.
2011;
;
5
:
:44.
–
5
.
33.
Song
ATW
,
Carneiro D’Albuquerque
LA.
Acute Liver Failure Secondary to Yellow Fever: A Challenging Scenario.
.
Clin Liver Dis (Hoboken)
.
2019;
;
13
:
:58.
–
61
.
34.
Sherman
KE
,
Rouster
SD
,
Kong
LX
,
et al.
.
Zika virus replication and cytopathic effects in liver cells.
.
PLoS One
.
2019;
;
14
:
:e0214016.
.
35.
Macnamara
FN.
Zika virus: a report on three cases of human infection during an epidemic of jaundice in Nigeria.
.
Trans R Soc Trop Med Hyg
.
1954;
;
48
:
:139.
–
45
.
36.
Wu
Y
,
Cui
X
,
Wu
N
,
et al.
.
A unique case of human Zika virus infection in association with severe liver injury and coagulation disorders.
.
Sci Rep
.
2017;
;
7
:
:11393.
.
37.
Bente
DA
,
Forrester
NL
,
Watts
DM
,
et al.
.
Crimean-Congo hemorrhagic fever: history, epidemiology, pathogenesis, clinical syndrome and genetic diversity.
.
Antiviral Res
.
2013;
;
100
:
:159.
–
89
.
38.
Burt
FJ
,
Swanepoel
R
,
Shieh
WJ
,
et al.
.
Immunohistochemical and in situ localization of Crimean-Congo hemorrhagic fever (CCHF) virus in human tissues and implications for CCHF pathogenesis.
.
Arch Pathol Lab Med
.
1997;
;
121
:
:839.
–
46
.
39.
Merson
L
,
Bourner
J
,
Jalloh
S
,
et al.
.
Clinical characterization of Lassa fever: A systematic review of clinical reports and research to inform clinical trial design.
.
PLoS Negl Trop Dis
.
2021;
;
15
:
:e0009788.
.
40.
Reynard
O
,
Escudero-Perez
B
,
Volchkov
V.
Dérégulation de l’hémostase dans les infections à filovirus.
.
Med Sci (Paris)
.
2015;
;
31
:
:143.
–
50
.
41.
Fausther-Bovendo
H
,
Qiu
X
,
He
S
,
et al.
.
NK Cells Accumulate in Infected Tissues and Contribute to Pathogenicity of Ebola Virus in Mice.
.
J Virol
.
2019 ;
:93.
.
42.
St
Claire
MC
,
Ragland
DR
,
Bollinger
L
,
Jahrling
PB.
Animal Models of Ebolavirus Infection.
.
Comp Med
.
2017;
;
67
:
:253.
–
62
.
43.
Ghoshal
UC
,
Ghoshal
U
,
Dhiman
RK.
Gastrointestinal and Hepatic Involvement in Severe Acute Respiratory Syndrome Coronavirus 2 Infection: A Review.
.
J Clin Exp Hepatol
.
2020;
;
10
:
:622.
–
8
.
44.
Wang
Y
,
Liu
S
,
Liu
H
,
et al.
.
SARS-CoV-2 infection of the liver directly contributes to hepatic impairment in patients with COVID-19.
.
J Hepatol
.
2020;
;
73
:
:807.
–
16
.
45.
Sarin
SK
,
Choudhury
A
,
Lau
GK
,
et al.
.
Pre-existing liver disease is associated with poor outcome in patients with SARS CoV2 infection; The APCOLIS Study (APASL COVID-19 Liver Injury Spectrum Study).
.
Hepatol Int
.
2020;
;
14
:
:690.
–
700
.
46.
Liptak
P
,
Nosakova
L
,
Rosolanka
R
,
et al.
.
Acute-on-chronic liver failure in patients with severe acute respiratory syndrome coronavirus 2 infection.
.
World J Hepatol
.
2023;
;
15
:
:41.
–
51
.
47.
Rosen
L
,
Khin
MM
,
U T. Recovery of virus from the liver of children with fatal dengue: reflections on the pathogenesis of the disease and its possible analogy with that of yellow fever.
.
Res Virol
.
1989;
;
140
:
:351.
–
60
.
48.
Kangwanpong
D
,
Bhamarapravati
N
,
Lucia
HL.
Diagnosing dengue virus infection in archived autopsy tissues by means of the in situ PCR method: a case report.
.
Clin Diagn Virol
.
1995;
;
3
:
:165.
–
72
.
49.
Couvelard
A
,
Marianneau
P
,
Bedel
C
,
et al.
.
Report of a fatal case of dengue infection with hepatitis: demonstration of dengue antigens in hepatocytes and liver apoptosis.
.
Hum Pathol
.
1999;
;
30
:
:1106.
–
10
.
50.
Huerre
MR
,
Lan
NT
,
Marianneau
P
,
et al.
.
Liver histopathology and biological correlates in five cases of fatal dengue fever in Vietnamese children.
.
Virchows Arch
.
2001;
;
438
:
:107.
–
15
.
51.
da Costa Lopes
J
,
Falcao
LFM
,
Martins Filho
AJ
,
et al.
.
Factors Involved in the Apoptotic Cell Death Mechanism in Yellow Fever Hepatitis.
.
Viruses
.
2022 ;
:14.
.
52.
Shieh
WJ
,
Paddock
CD
,
Lederman
E
,
et al.
.
Pathologic studies on suspect animal and human cases of Rift Valley fever from an outbreak in Eastern Africa, 2006-2007.
.
Am J Trop Med Hyg
.
2010;
;
83
:
:38.
–
42
.
53.
Lindquist
ME
,
Zeng
X
,
Altamura
LA
,
et al.
.
Exploring Crimean-Congo Hemorrhagic Fever Virus-Induced Hepatic Injury Using Antibody-Mediated Type I Interferon Blockade in Mice.
.
J Virol
.
2018;
;
92
:
:e01083.
–
18
.
54.
Haddock
E
,
Feldmann
F
,
Hawman
DW
,
et al.
.
A cynomolgus macaque model for Crimean-Congo haemorrhagic fever.
.
Nat Microbiol
.
2018;
;
3
:
:556.
–
62
.
55.
Reed
C
,
Steele
KE
,
Honko
A
,
et al.
.
Ultrastructural study of Rift Valley fever virus in the mouse model.
.
Virology
.
2012;
;
431
:
:58.
–
70
.
56.
Paes
MV
,
Lenzi
HL
,
Nogueira
AC
,
et al.
.
Hepatic damage associated with dengue-2 virus replication in liver cells of BALB/c mice.
.
Lab Invest
.
2009;
;
89
:
:1140.
–
51
.
57.
Courageot
MP
,
Catteau
A
,
Despres
P.
Mechanisms of dengue virus-induced cell death.
.
Adv Virus Res
.
2003;
;
60
:
:157.
–
86
.
58.
Ma
J
,
Chen
R
,
Huang
W
,
et al.
.
In vitro and in vivo efficacy of a Rift Valley fever virus vaccine based on pseudovirus.
.
Hum Vaccin Immunother
.
2019;
;
15
:
:2286.
–
94
.
59.
Diallo
I
,
Ho
J
,
Laffont
B
,
et al.
.
Altered microRNA Transcriptome in Cultured Human Liver Cells upon Infection with Ebola Virus.
.
Int J Mol Sci
.
2021;
;
22
:
:3792.
.
60.
Scoon
WA
,
Mancio-Silva
L
,
Suder
EL
,
et al.
.
Ebola virus infection induces a delayed type I IFN response in bystander cells and the shutdown of key liver genes in human iPSC-derived hepatocytes.
.
Stem Cell Reports
.
2022;
;
17
:
:2286.
–
302
.
61.
Yang
L
,
Han
Y
,
Nilsson-Payant
BE
,
et al.
.
A Human Pluripotent Stem Cell-based Platform to Study SARS-CoV-2 Tropism and Model Virus Infection in Human Cells and Organoids.
.
Cell Stem Cell
.
2020;
;
27
:
:125.
–
36 e7
.
62.
Marianneau
P
,
Steffan
AM
,
Royer
C
,
et al.
.
Infection of primary cultures of human Kupffer cells by Dengue virus: no viral progeny synthesis, but cytokine production is evident.
.
J Virol
.
1999;
;
73
:
:5201.
–
6
.
63.
Woodson
SE
,
Freiberg
AN
,
Holbrook
MR.
Differential cytokine responses from primary human Kupffer cells following infection with wild-type or vaccine strain yellow fever virus.
.
Virology
.
2011;
;
412
:
:188.
–
95
.
64.
Aguilar-Briseno
JA
,
Elliff
JM
,
Patten
JJ
,
et al.
.
Effect of Interferon Gamma on Ebola Virus Infection of Primary Kupffer Cells and a Kupffer Cell Line.
.
Viruses
.
2023;
;
15
:
:2077.
.
65.
Simmons
G
,
Reeves
JD
,
Grogan
CC
,
et al.
.
DC-SIGN and DC-SIGNR bind ebola glycoproteins and enhance infection of macrophages and endothelial cells.
.
Virology
.
2003;
;
305
:
:115.
–
23
.
66.
Mori
G
,
Strano
M
,
Chiurlo
M
,
et al.
.
Probable West Nile Virus hepatitis: Case report.
.
IDCases
.
2023;
;
33
:
:e01841.
.
67.
Gilgenkrantz
H.
« A star is reborn ». Nouvelles avancées sur les fonctions de la cellule étoilée du foie.
.
Med Sci (Paris)
.
2023;
;
39
:
:921.
–
3
.
|