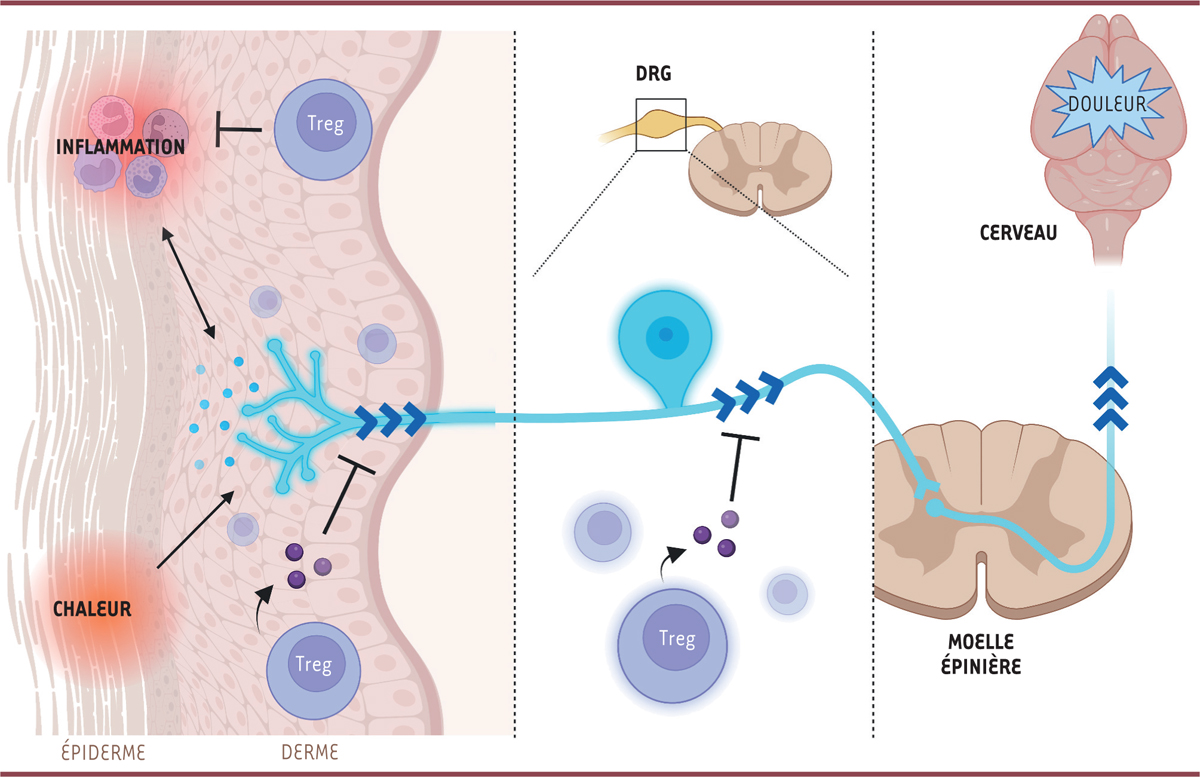
La douleur est utile pour alerter l’organisme d’un potentiel danger, mais elle est souvent la cause d’inconfort qui peut influer sur la qualité de vie des individus. C’est pourquoi elle doit être contrôlée. L’existence d’un dialogue entre le système nerveux et le système immunitaire est connue, mais ses mécanismes restent mal compris. De nombreuses cellules immunitaires interagissent avec les neurones sensoriels responsables de la transmission du message douloureux depuis la périphérie vers le système nerveux central. Certaines cellules promeuvent le signal douloureux : c’est par exemple le cas des mastocytes, qui provoquent ou amplifient la douleur en produisant des neurotransmetteurs [ 1 ]. D’autres cellules, comme les lymphocytes T CD4 + , sont au contraire capables de réduire la douleur, comme cela a été montré dans des modèles murins de colite [ 2 – 4 ]. C’est également le cas des lymphocytes T régulateurs, caractérisés par leur synthèse du facteur de transcription FOXP3 et de la chaîne α du récepteur de l’interleukine 2 (CD25). La fonction principale des lymphocytes T régulateurs est le contrôle de l’autoimmunité et la résolution de l’inflammation [ 5 ], mais ils possèdent également de nombreuses fonctions non-immunitaires, par exemple dans la cicatrisation et la régénération tissulaire [ 6 ]. Des études récentes ont mis en évidence leur rôle dans le contrôle de la douleur neuropathique chez le rat et la souris [ 7 – 9 ], mais aussi dans les sensibilités thermique et mécanique chez la souris [ 10 ]. La fonction immunosuppressive de ces lymphocytes pourrait expliquer leur rôle analgésique, au moins dans un contexte inflammatoire, lui-même à l’origine de douleur [ 11 ] ( Figure 1 ).
| Figure 1
Contrôle de la douleur par les lymphocytes T régulateurs
.
L’activation des neurones sensoriels de la peau sensibles à la chaleur ou à l’inflammation conduit au relargage de molécules favorisant l’inflammation et à la transmission du message de douleur (flèches bleues) le long des dendrites jusqu’au ganglion spinal (
dorsal root ganglion
, DRG), où se trouvent les corps cellulaires de ces neurones, puis au système nerveux central, jusqu’au cerveau, qui produit la sensation de douleur (nociception). Les lymphocytes T régulateurs (Treg) atténuent ce message nerveux indirectement par leur contrôle de l’inflammation dans la peau, mais aussi par la production d’enképhalines qui inhibent ces neurones sensoriels dans la peau et les ganglions spinaux.
|
Nous avons montré que les lymphocytes T régulateurs expriment le gène de la proenképhaline ( Penk ) à un degré bien supérieur à ceux constatés pour les autres lymphocytes T [ 12 ]. Or, ce gène code le précurseur des enképhalines, une classe de peptides opioïdes aux propriétés analgésiques. Ce résultat suggère que la production d’enképhalines par les lymphocytes T régulateurs pourrait participer au contrôle de la douleur. En effet, l’expression de Penk et la production d’enképhalines par les lymphocytes T CD4 + du côlon ont été associées à une diminution des douleurs viscérales chez la souris, mais le rôle des lymphocytes T régulateurs n’a pas été étudié [ 2 – 4 ]. En utilisant un modèle de souris transgéniques permettant de tracer l’expression du gène Penk par une molécule fluorescente, nous avons pu établir une « carte » de l’expression de ce gène dans le système immunitaire : Penk est exprimé par les lymphocytes T effecteurs/activés, mais surtout par les lymphocytes T régulateurs, dans les organes lymphoïdes et les tissus non lymphoïdes, particulièrement dans le côlon et la peau (où environ 10 % des lymphocytes T régulateurs expriment Penk ). En revanche, aucune expression de Penk n’a été détectée dans les autres classes de cellules immunitaires [ 12 ].
Nous avons ensuite voulu élucider le rôle de l’expression de Penk dans les lymphocytes T régulateurs. Des expériences in vitro et in vivo ont montré des capacités immunosuppressives identiques pour ces lymphocytes, qu’ils soient de génotype « sauvage » ou déficients pour le gène Penk . Cela suggère que l’activité immuno-modulatrice des enképhalines est faible ou nulle [ 12 ]. Pour étudier les effets de l’expression de Penk par les lymphocytes T régulateurs sur la sensation douloureuse (nociception), nous avons généré un modèle murin avec une délétion du gène Penk spécifiquement dans ces lymphocytes. Dans ce modèle, nous avons constaté une hypersensibilité thermique, chez les souris des deux sexes. Cette hypersensibilité semble spécifique de la chaleur, puisqu’aucun test de sensibilité mécanique n’a mis en évidence de différence entre les souris mutantes et les souris témoins [ 12 ]. L’hypersensibilité thermique chez les souris mutantes a également été rapportée par Mendoza et al . [ 13 ]. Toutefois, cette hypersensibilité thermique n’a pas été constatée par Midavaine et al . dans un modèle murin de chimère mixte hématopoïétique, dans lequel les lymphocytes T régulateurs capables d’exprimer Penk sont éliminés spécifiquement dans les ganglions spinaux au profit de lymphocytes T régulateurs incapables de l’exprimer. En contradiction apparente avec nos résultats, ces auteurs ont constaté une sensibilité mécanique plus forte chez ces souris que chez les souris témoins dans un modèle d’analgésie induite par la gestation [ 14 ]. Ensemble, ces résultats suggèrent que les lymphocytes T régulateurs producteurs d’enképhalines pourraient agir de façon différente selon le tissu dans lequel ils se trouvent, peau ou ganglion spinal ( Figure 1 ).
Plusieurs indices accréditent l’hypothèse selon laquelle les enképhalines produites par les lymphocytes T régulateurs contrôlent directement la nociception. Tout d’abord, nous avons constaté, dans la peau, que certains lymphocytes T régulateurs étaient situés à proximité des neurones sensoriels (produisant le calcitonin gene-related peptide , CGRP) [ 12 ]. Ensuite, Mendoza et al . ont montré que les lymphocytes T régulateurs exprimant Penk sont plus proches des neurones que les lymphocytes T régulateurs qui ne l’expriment pas [ 13 ]. Enfin, Zhu et al . ont également constaté une colocalisation des cellules FOXP3 + et des neurones CGRP + dans le côlon [ 15 ]. Les enképhalines produites par les lymphocytes T régulateurs, comme celles produites par les lymphocytes T effecteurs, pourraient agir sur les neurones sensoriels en se liant au récepteur δ des opioïdes [ 14 , 16 ]. Concernant les effets immunosuppresseurs des enképhalines, les résultats obtenus par Midavaine et al . confirment les nôtres, à savoir que la capacité immunosuppressive des lymphocytes T régulateurs n’est pas modifiée par l’invalidation de Penk [ 14 ]. De plus, Mendoza et al . ont montré que l’interleukine-10, molécule clé de l’immunorégulation, n’est pas impliquée dans la nociception lorsqu’elle est produite par les lymphocytes T régulateurs [ 13 ], ce qui est surprenant compte tenu des résultats d’autres études montrant un rôle direct de l’interleukine-10 sur les neurones sensoriels [ 17 ].
Les résultats que nous avons présentés sont compatibles avec l’hypothèse selon laquelle les lymphocytes T régulateurs contrôleraient la douleur par deux mécanismes : indirectement, en contrôlant l’inflammation qui en est à l’origine, et plus directement, par la production d’enképhalines agissant sur les neurones sensoriels de la nociception ( Figure 1 ). Ces résultats ont été obtenus chez la souris, et il reste à établir leur validité chez l’homme. Le contrôle de la douleur fait partie des nombreuses fonctions non-immunologiques des lymphocytes T régulateurs qui pourraient être exploitées utilement à des fins médicales.