La persistance virale permet à certains virus de subsister durablement dans l’organisme malgré une réponse immunitaire active. La capacité de ces virus à échapper au contrôle immunitaire repose sur des mécanismes qui facilitent l’établissement de réservoirs viraux, des populations cellulaires spécifiques qui hébergent le virus sans le détruire [ 1 ] : le virus peut ainsi persister sous une forme latente ou peu réplicative. Par exemple, le virus de l’immunodéficience humaine (VIH) intègre son génome dans celui des cellules hôtes.
En absence de transcription virale, ces cellules qui l’hébergent deviennent des réservoirs viraux invisibles par le système immunitaire, ce qui constitue un obstacle majeur à l’éradication du virus. Bien que les traitements antirétroviraux réduisent la charge virale à des niveaux indétectables, ils n’agissent pas efficacement sur ces réservoirs, à partir desquels le virus peut se réactiver si le traitement est interrompu [ 2 ]. Le virus de l’hépatite B, quant à lui, persiste dans le noyau des hépatocytes sous forme d’ADN circulaire, à l’origine d’une infection chronique avec un risque de réactivation, surtout en cas d’immunosuppression [ 3 ]. Le contrôle de ce réservoir est donc crucial pour prévenir les complications hépatiques graves, telles que la cirrhose et le carcinome hépatocellulaire. Les papillomavirus humains demeurent à l’état latent dans les cellules épithéliales, et leur réactivation peut provoquer des lésions bénignes ou cancéreuses [ 4 ]. Le cytomégalovirus demeure latent dans les cellules myéloïdes et se réactive surtout chez les personnes immunodéprimées, entraînant des complications sévères [ 5 ]. Enfin, le virus Herpes simplex de type 1 se cache dans les neurones sensoriels après l’infection initiale. Il peut se réactiver périodiquement, souvent en réponse au stress ou à l’immunosuppression [ 5 ].
Plusieurs études ont indépendamment montré que le virus SARS-CoV-2 ( severe acute respiratory syndrome-coronavirus-2 ), responsable de la COVID-19 ( coronarovirus disease 2019 ), peut persister pendant plusieurs mois et même au-delà d’un an après le début de l’infection [ 6 – 8 ]. Cette persistance de matériel viral, tel que l’ARN et la protéine spike, soulève plusieurs questions. Ainsi, on ignore s’il s’agit de véritables infections chroniques à vie ou si le virus sera éliminé plus tard. On ignore également le rôle d’une telle persistance virale dans les symptômes de ce qu’il est convenu d’appeler « COVID long ». Enfin, les mécanismes cellulaires de cette persistance virale restent à élucider.
Nous avons montré, en utilisant un modèle de primate non humain, que le virus SARS-CoV-2 peut persister dans les macrophages alvéolaires pulmonaires jusqu’à 18 mois après l’infection aigüe [ 8 ]. Le virus semble persister spécifiquement dans des macrophages de type M2 1, , et il est capable de s’y répliquer lorsque ces cellules sont mises en culture. Cependant, il ne bourgeonne pas à la surface des macrophages infectés, mais il modifie leur programme transcriptionnel pour leur faire produire des nanotubes [ 8 , 9 ] ( → ).
(→) Voir m/s n° 11, 2019, page 825
Ces derniers facilitent la dissémination du virus d’une cellule à une autre, tout en lui permettant d’échapper à la réponse immunitaire, notamment aux anticorps, car le virus n’est ni libéré dans le milieu extracellulaire, ni apparent à la surface des macrophages infectés. Cette stratégie d’échappement immunitaire souligne les difficultés du contrôle des infections chroniques et illustre la multiplicité des mécanismes permettant d’éviter la détection et l’élimination des virus par le système immunitaire.
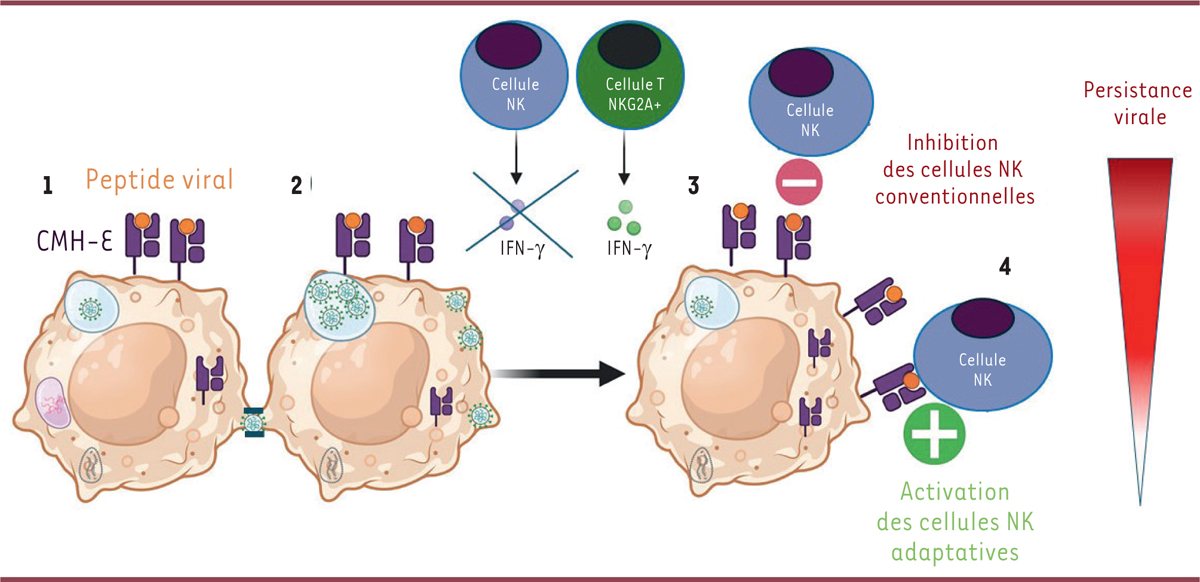
Nous avons également mis en évidence le rôle crucial de l’interféron gamma (IFN-γ) dans le contrôle de la réplication et la persistance du SARS-CoV-2 [ 8 ]. L’exposition des macrophages alvéolaires à cette cytokine entraîne une réduction significative de la réplication et de la dissémination du virus. L’IFN-γ est principalement produit par les lymphocytes T et les lymphocytes natural killer (NK) [ 10 ]. Ces derniers sont des acteurs essentiels de la réponse immunitaire innée, chargés de détecter et d’éliminer les cellules infectées ou tumorales. Parmi les différents récepteurs qu’ils utilisent pour évaluer l’état de santé de leurs cellules cibles, le récepteur NKG2A ( NK group 2 family of receptor A ) interagit spécifiquement avec le complexe majeur d’histocompatibilité de classe E (CMH-E) à la surface de ces cellules, ce qui entraîne généralement une inhibition de l’activité cytotoxique des lymphocytes NK afin d’empêcher la lyse des cellules saines. Le CMH-E joue un rôle clé en présentant des peptides dérivés de protéines intracellulaires aux cellules immunitaires, notamment à quelques lymphocytes T rares, mais surtout aux cellules NK [ 11 ]. L’expression de la molécule CMH-E est souvent induite dans des contextes d’infection ou de stress cellulaire. Lorsque la quantité de CMH-E augmente sur une cellule tumorale ou infectée, elle inhibe l’activité des cellules NK et crée ainsi un mécanisme d’évasion immunitaire. Nous avons montré que l’IFN-γ induit une augmentation de la quantité de CMH-E à la surface des macrophages alvéolaires [ 8 ]. En se liant au récepteur NKG2A sur les cellules NK, le CMH-E inhibe leur capacité à détruire les cellules infectées par le virus ( Figure 1 ). Ainsi, dans une stratégie sophistiquée d’évasion immunitaire, l’IFN-γ favorise l’établissement d’un réservoir viral persistant en limitant la réplication virale dans les cellules infectées tout en inhibant leur lyse par les cellules NK. Il est à noter qu’en absence d’IFN-γ, par exemple lors d’une culture in vitro des macrophages alvéolaires isolés du poumon d’un animal infecté par le SARS-CoV-2, le virus n’est plus inhibé et peut se répliquer à des titres élevés [ 8 ]. Ce constat indique que le SARS-Cov-2 peut persister dans l’organisme dans un état de latence, et soulève la question de savoir si le virus peut se réactiver aussi in vivo .
| Figure 1
Modèle du contrôle de la persistance du virus SARS-CoV-2 dans les macrophages alvéolaires du poumon. 1
.
Chez les macaques infectés par le SARS-CoV-2, le virus persiste dans les macrophages alvéolaires activés du poumon, extraits du liquide broncho-alvéolaire (BALF), et peut se propager de cellule à cellule par des prolongements macrophagiques ressemblant à des nanotubes.
2
.
La réplication du virus SARS-CoV-2 est inhibée par l’interféron γ (IFN-γ) qui est produit notamment par les lymphocytes T CD8
+
/NKG2R
+
et par les cellules
natural killer
(NK) NKG2Alo. La production d’IFN-γ par les cellules NK est toutefois diminuée.
3
.
L’IFN-γ augmente la présence de la molécule du complexe majeur d’histocompatibilité de classe E (CMH-E) à la surface des macrophages activés. Le CMH-E présente le peptide V3-11 de la protéine Spike de SARS-CoV-2 aux lymphocytes. L’interaction du complexe moléculaire formé par le CMH-E et le peptide V3-11 avec les cellules NK bloque leur activité.
4
.
Chez certains individus, les cellules NK « adaptatives » échappent à cette inhibition impliquant le CMH-E par des mécanismes encore mal compris, ce qui permet l’élimination des cellules infectées par le SARS-CoV-2, et diminue ainsi le réservoir viral persistant.
|
Malgré la relative fréquence de la persistance du virus, nous avons constaté que celui-ci ne persistait pas chez tous les animaux [ 8 ]. Nous avons montré en effet que certaines réponses immunitaires à l’infection, notamment celle impliquant des cellules NK adaptatives, peuvent contourner cette inhibition dépendant du MHC-E. Les cellules NK adaptatives ne sont pas affectées par l’interaction inhibitrice entre MHC-E et NKG2A, et sont capables de détruire les cellules infectées [ 8 ]. Cette réponse impliquant des cellules NK adaptatives ne se manifeste que dans la sous-population d’animaux qui n’ont pas de virus persistant. Les raisons de cette variabilité entre individus restent à élucider.
Enfin, bien que l’IFN-γ joue un rôle crucial dans le contrôle de la réplication virale, son efficacité dans certaines niches immunitaires, telles que celle des cellules NK et des macrophages du poumon, est compromise. En effet, la production d’IFN-γ par ces cellules est diminuée chez les animaux infectés préalablement par le SARS-CoV-2, même plusieurs mois après l’infection [ 8 ].
La persistance du SARS-CoV-2 représente un défi médical, notamment dans la gestion des infections chroniques ou du COVID long. Il semble en effet que la persistance virale soit plus fréquente chez les personnes souffrant d’un COVID long [ 7 ]. Cette persistance du matériel viral pourrait être responsable d’une inflammation résiduelle et de manifestations cliniques prolongées. Il n’est pas exclu toutefois qu’un COVID long puisse s’installer en absence de virus persistant.
D’autres recherches seront nécessaires pour répondre à cette question.
Mieux comprendre comment l’IFN-γ et d’autres médiateurs immunitaires contribuent à la persistance virale, ou au contraire, comment sont induites des réponses immunes capables d’éradiquer les réservoirs viraux, pourrait ouvrir de nouvelles perspectives thérapeutiques pour limiter la persistance virale. Par exemple, la modulation des réponses à l’IFN-γ, régulant également l’inflammation, ou encore la potentialisation de l’activité des cellules NK, pourrait offrir des stratégies pour éradiquer plus efficacement les réservoirs viraux.
Ces observations soulignent l’intérêt d’une surveillance clinique continue chez les patients ayant été infectés par le SARS-CoV-2, même après la disparition des symptômes aigus. Le manque actuel d’outils robustes pour quantifier la persistance virale de manière peu invasive et l’absence de biomarqueurs fiables pour diagnostiquer le COVID long représentent des obstacles majeurs à la prise en charge de ces patients. Il importe également de développer de nouvelles approches thérapeutiques, qui pourraient combiner des agents antiviraux et des immunomodulateurs, contre la persistance virale et les infections chroniques.