L’optogénétique [
1
] (
→
) consiste à modifier des cellules génétiquement afin que leur comportement puisse être contrôlé à distance par la lumière, un stimulus inoffensif, réversible, focalisable sur des zones aussi petites qu’une seule cellule. L’optogénétique permet donc de modifier les fonctions cellulaires avec une résolution spatio-temporelle sans commune mesure avec celle d’autres techniques, telles que l’application de modulateurs chimiques. C’est un outil puissant pour étudier la dynamique de différentes cascades de signalisation cellulaire. En outre, elle peut être utilisée à des fins médicales, comme l’a prouvé la restauration partielle de la vision chez des patients aveugles grâce au contrôle optogénétique de leurs cellules rétiniennes [
2
].
(→) Voir le Dossier technique de GP. Dugué, L. Tricoire,
m/s
n° 3, mars 2015, page 291
Les cellules sont rendues photosensibles par l’expression génétique de protéines photosensibles exogènes. Ainsi, pour moduler l’activité électrique des neurones, on leur fait produire des canaux ioniques activés par la lumière, le plus souvent ChR2 (
channelrhodopsin-2
) [
3
]. Ce canal cationique a été découvert chez les algues, où il est essentiel à la phototaxie
1
. Quand il est produit par des neurones, il est présent à la membrane plasmique et augmente l’activité électrique neuronale lorsqu’il est activé par la lumière.
Récemment, les génomes d’organismes et de virus marins ont été systématiquement séquencés, en partie à l’initiative de la fondation Tara Océan
2
[
4
]. L’analyse de leurs séquences nucléotidiques a révélé la présence de nombreux gènes codant des rhodopsines, bien que celles-ci diffèrent des rhodopsines connues. La caractérisation fonctionnelle de ces rhodopsines est en cours, avec l’espoir qu’elles fournissent de nouveaux outils pour accroître la portée de l’optogénétique. C’est dans ce contexte que des rhodopsines découvertes par l’analyse du génome de virus géants marins ont ensuite été exprimées dans des cellules eucaryotiques, où il est apparu qu’elles se comportaient différemment des autres rhodopsines connues [
5
].
Les channelrhodopsines virales : des canaux calciques intracellulaires activés par la lumière
Nous avons découvert une nouvelle famille de protéines activées par la lumière en analysant les génomes de virus marins infectant le phytoplancton. Ces protéines, nommées VCR1 (
viral channelrhodopsins
de type 1), forment des canaux ioniques qui ont la capacité singulière d’augmenter la concentration cytosolique de l’ion calcium (Ca
2+
) dans les cellules eucaryotes lors d’une stimulation lumineuse. Notre recherche s’est concentrée sur la caractérisation fonctionnelle de l’un de ces canaux ioniques, OLPVR1 (
organic lake phycodnavirus rhodopsin
1), et sur son potentiel en tant qu’outil optogénétique pour manipuler les voies de signalisation du calcium [
5
] (
Figure 1A
).
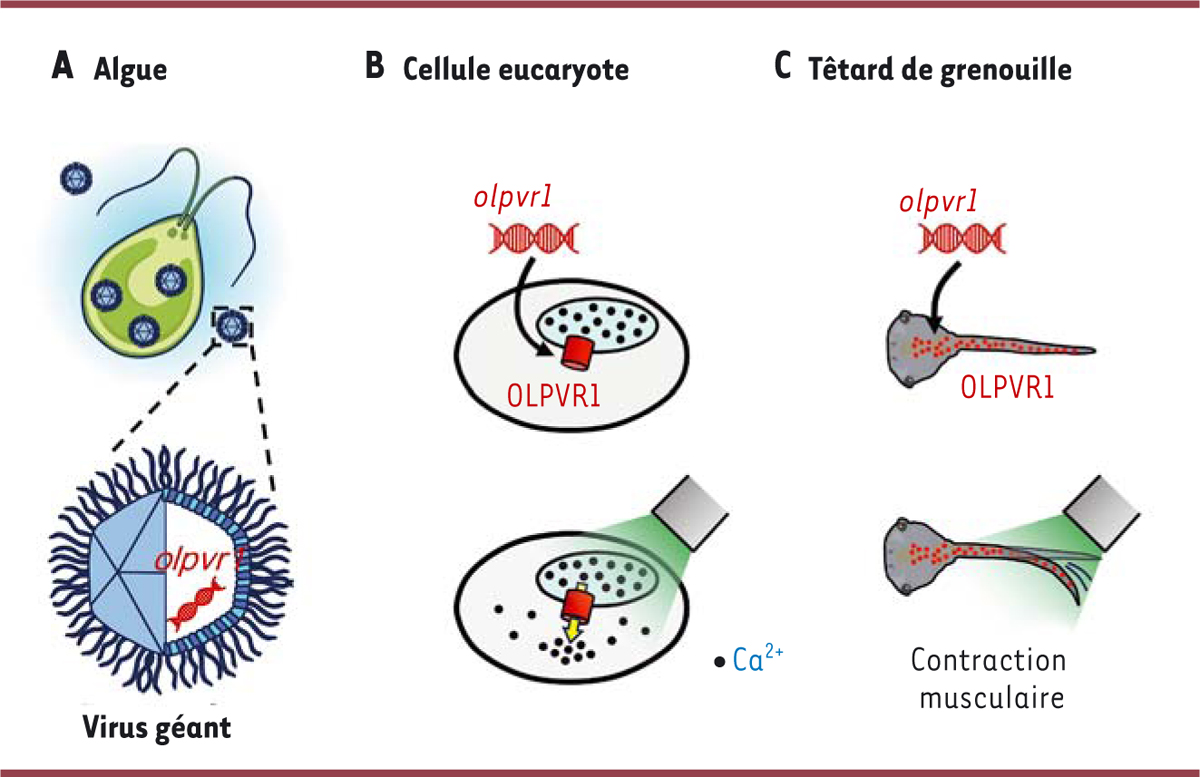
 | Figure 1.
Découverte de rhodopsines virales capables de moduler Vhoméostasie intracellulaire du calcium. A
.
De nombreux virus géants peuplent les milieux aquatiques, où ils infectent le phytoplancton. L’analyse de leurs génomes a révélé la présence de gènes codant de nouveaux membres de la famille des rhodopsines, les channelrhodopsines de type 1 (
viral channelrhodopsins of type 1
, VCR1).
B
.
L’une de ces protéines, OLPVR1 (
organic lake phycodnavirus rhodopsin
1), a été exprimée dans deux modèles cellulaires : l’ovocyte de xénope (par injection de PARN codant cette protéine) et les cellules HEK293T (par transfection avec de l’ADN codant cette protéine). Contrairement aux autres channelrhodopsines, OLPVR1 ne réside pas dans la membrane plasmique, mais dans la membrane du réticulum endoplasmique (en bleu). L’activation de OLPVR1 par la lumière verte (de longueur d’onde 500 nm) déclenche un mouvement des ions calcium (Ca
2+
, points noirs) stockés dans le réticulum endoplasmique vers le cytosol. Il en résulte une augmentation de la concentration cytosolique de Ca
2+
, qui est corrélée à la durée et à l’intensité de l’illumination.
C
. Des têtards de grenouilles xénopes exprimant OLPVR1 se mettent en mouvement lorsqu’ils sont Illuminés, même après avoir été traités par des agents paralytiques et anesthésiants. Il s’agit donc d’un effet sur les fibres musculaires, dont la contraction est directement liée à l’élévation de la concentration cytosolique de Ca
2+
.
|
La photoactivation de OLPVR1 augmente la concentration cytosolique de l’ion calcium
Nous avons utilisé deux systèmes d’expression pour étudier OLPVR1 et les rhodopsines virales apparentées : les ovocytes de xénope et les lignées de cellules de mammifères. Les ovocytes de xénope sont injectés individuellement avec l’ARN codant la protéine qui forme le canal ionique (et éventuellement les ARN codant des protéines accessoires), tandis que les cellules de mammifères sont transfectées collectivement avec des ADN complémentaires (ADNc) codant la protéine formant le canal et des protéines accessoires. L’activité du canal ionique est ensuite mesurée par des techniques électrophysiologiques,
patch clampl
[
6
] (
→
) ou microélectrodes. Dans les ovocytes de xénope exprimant OLPVR1, l’activation par la lumière induit de robustes courants véhiculés par l’ion chlorure (Cl
-
). Or, la structure à haute résolution de OLPVR1 [
7
] est incompatible avec une perméabilité de ce canal aux ions Cl
-
. L’utilisation d’inhibiteurs spécifiques des canaux chlorure connus et la manipulation de la concentration intracellulaire de Ca
2+
par injection de chélateurs de cet ion ont permis de dévoiler un mécanisme inattendu : les courants enregistrés ne résultent pas du mouvement des ions Cl
-
à travers les canaux OLPVR1, mais à travers des canaux chlorure endogènes activés par l’ion Ca
2+
(CaCl). Ainsi, l’activation du canal OLPVR1 par la lumière a un effet indirect: elle augmente la concentration cytosolique de Ca
2+
, ce qui provoque l’ouverture de ces canaux chlorure. Comme cet effet est indépendant de la présence extracellulaire de l’ion Ca
2+
, il apparaît que l’activation de OLPVR1 redistribue le calcium intracellulaire en vidant les stocks de Ca
2+
de la cellule. Contrairement aux ovocytes de xénope, les cellules de la lignée HEK293T
3,
exprimant OLPVR1 ne répondent pas à l’illumination. Cependant, lorsqu’on leur fait produire aussi des canaux CaCl, dont elles sont naturellement dépourvues, on obtient une réponse comparable à celle des ovocytes de xénope [
5
] (
Figure 1B
).
(→) Voir encadré de J. Teulon,
m/s
n° 5, mai 2004, page 550
Sonder le mécanisme de libération intracellulaire des stocks d’ions calcium par une rhodopsine virale
La cellule possède divers organites qui accumulent les ions Ca
2+
: réticulum endoplasmique, mitochondries, noyau, etc. Ce stockage repose sur un système de récepteurs-canaux (récepteurs de l’inositol trisphosphate et de la ryanodine [
8
]) et de pompes finement régulés afin de moduler la concentration cytosolique de Ca
2+
libre dans une fourchette allant de 10 nM à 1 μm.
Des expériences dans les ovocytes de xénope et dans des cellules de mammifères ont révélé que OLPVR1 réside exclusivement dans les membranes internes. Dans les ovocytes, une technique de localisation de protéines sur cellule unique a montré que OLPVR1, contrairement à ChR2, n’est pas présent à la surface de la cellule. Dans les cellules HEK293T, la colocalisation de OLPVR1 et d’un marqueur du réticulum endoplasmique a été montrée par immunofluorescence [
5
] . Pour préciser le lien entre calcium intracellulaire et OLPVR1, nous avons coexprimé, dans les ovocytes de xénope, ce canal et le récepteur muscarinique M3 de l’acétylcholine, qui est couplé à la cascade de production d’inositol trisphosphate (IP
3
). Après activation prolongée des récepteurs M3 par l’acétylcholine, qui épuise les réserves intracellulaires de calcium dépendantes de IP
3
, nous avons constaté que les courants ioniques déclenchés par la photoactivation de OLPVR1 étaient considérablement atténués [
5
]. Les ions Ca
2+
libérés par OLPVR1 proviennent donc de mêmes stocks que ceux libérés par les récepteurs-canaux activés par IP
3
.
Comment l’activation de OLPVR1 provoque-t-elle la libération des ions Ca
2+
dans le cytosol ? Directement, en laissant passer, à travers ce canal, les ions Ca
2+
de la lumière du réticulum endoplasmique vers le cytosol selon leur gradient de concentration, ou indirectement, en activant les récepteurs-canaux endogènes dépendant de IP3 ?
Nous avons recherché une implication de différents éléments de la cascade de production de IP
3
en utilisant des inhibiteurs spécifiques, mais nous n’avons constaté aucun effet de ces inhibiteurs sur les courants ioniques induits par la photoactivation de OLPVR1. Seul l’inhibiteur 2-APB (2-aminoéthoxydiphényl borate) du récepteur de IP
3
a réduit ces courants, sans toutefois les supprimer [
5
]. Une fraction du calcium libéré dans le cytosol par OLPVR1 est donc indépendante des récepteur de IP
3
. La fraction provenant de l’activation des récepteurs de IP
3
, quant à elle, pourrait résulter de leur activation par les ions Ca
2+
libérés par OLPVR1, car ces récepteurs sont sensibles au calcium cytosolique.
Si ces observations sont compatibles avec l’hypothèse que OLPVR1 est un canal Ca
2+
, des preuves expérimentales plus directes sont nécessaires pour confirmer cette hypothèse. Les techniques électrophysiologiques, telles que la technique du
patch clamp
, permettent l’étude fonctionnelle détaillée des protéines de transport d’ions résidant dans la membrane externe de la cellule, mais elles sont difficilement applicables à l’étude des canaux ioniques situés dans les organites intracellulaires. Nous avons adopté une approche alternative pour étudier la perméabilité du canal OLPVR1 aux ions Ca
2+
. Nous avons conçu une protéine hybride dans laquelle une sonde fluorescente sensible au calcium (GCaMPés) est liée à OLPVR1. Lors d’une stimulation lumineuse de cette protéine hybride, la sonde a détecté une augmentation transitoire de la concentra tion de calcium, même en présence d’un chélateur (BÂPTA) capable de capturer tous les ions Ca
2+
cytosoliques. Les ions Ca
2+
provenant du réticulum atteignent ainsi la sonde avant que le chélateur ne puisse les capturer, ce qui indique une proximité de quelques nanomètres entre le point d’entrée des ions Ca
2+
dans le cytosol et la sonde fluorescente qui les détecte. Cette observation implique une perméation directe de ces ions à travers OLPVR1, plutôt que leur libération cytosolique par d’autres voies plus éloignées de la sonde, comme celle des récepteurs-canaux activés par IP
3
.
Contrôle par la lumière de la contraction musculaire chez le têtard de xénope
Afin de créer des animaux exprimant OLPVR1 sans ciblage tissulaire particulier, l’ARN codant cette protéine a été microinjecté dans des ovocytes de xénope fécondés. La présence de OLPVR1 n’a pas entravé le développement de ces têtards transgéniques qui, immobiles dans l’obscurité, se mettent en mouvement sous l’effet de la lumière (
Figure 1C
). Ces réponses subsistent après un traitement par le curare, un agent paralytique bloquant tout contrôle neuronal des muscles [
5
]. Ainsi, la libération d’ions Ca
2+
dans le cytosol des fibres musculaires par OLPVR1 sous contrôle de la lumière suffit à déclencher la contraction musculaire.
Implications et applications
La découverte des protéines VCR1, des rhodopsines codées par le génome de certains virus marins, a des répercussions dans plusieurs domaines. Dans le domaine de l’écologie, elle suggère un mécanisme original de symbiose entre les virus géants et leurs hôtes phyto-planctoniques, chez lesquels l’introduction d’une protéine VCR1 favoriserait la phototaxie en liant directement lumière solaire et mouvement des flagelles. Dans le domaine de l’optogénétique, la caractérisation fonctionnelle de ces protéines enrichit l’attirail des outils existants en permettant la manipulation directe de la concentration cytosolique des ions Ca
2+
avec la lumière. L’ion Ca
2+
est un messager intracellulaire universel, qui est impliqué dans des fonctions physiologiques aussi diverses que la prolifération et la mort cellulaires, la contraction musculaire, la sécrétion hormonale, la mémoire. En tirant parti de la résolution spatio-temporelle de l’émission de lumière, on peut envisager de contrôler avec précision des cascades de signalisation calcique grâce aux protéines VCR1, et ainsi d’améliorer notre compréhension des processus, physiologiques et pathologiques, liés à l’homéostasie du calcium. Enfin, la démonstration d’un contrôle optique de la contraction musculaire chez le têtard de xénope grâce à l’expression d’une de ces protéines permet raisonnablement d’envisager la possibilité de leur utilisation thérapeutique [
9
].