| |
| Med Sci (Paris). 41(1): 16–18. doi: 10.1051/medsci/2024185.Contrôle du métabolisme des macrophages associés à la tumeur par la voie du récepteur du CSF-1 Une opportunité pour rétablir la chimio-sensibilité des cancers colorectaux au 5-fluorouracile ? Cristina Gonzalez Prieto,1,2 Marie Malier,1 and Arnaud Millet1* 1Institut pour l’avancée des biosciences, Équipe mécanobiologie, immunité et cancer, Univ. Grenoble Alpes, Inserm U1209, CNRS UMR5309
,
Grenoble
,
France 2Univ. Grenoble Alpes, CEA, CNRS, Grenoble INP, IRIG, SyMMES/CREAB
,
Grenoble
,
France MeSH keywords: |
CSF-1 (ou
macrophage colony-stimulating factor
, M-CSF) est un facteur de croissance qui contrôle la différenciation et la survie des macrophages. Les cellules myéloïdes de la lignée monocytaire possèdent à leur surface un récepteur de cette protéine, CSF1-R, auquel se lie également l’interleukine-34 [
1
]. L’interaction entre CSF-1 et son récepteur permet la transactivation de dimères du récepteur, puis leur phosphorylation, conduisant à l’activation de multiples voies de signalisation impliquées dans la survie, la prolifération, la différenciation et la chimiotaxie des monocytes/macrophages. La voie PI3K (phosphoinositide 3-kinase) – AKT (protéine kinase B) semble avoir un rôle prédominant dans la survie, MEK (
mitogenactivated extracellular signal-regulated kinase
) et PI3K dans la prolifération, ERK (
extracellular signal-regulated kinase
) 1/2 dans la différenciation, et PI3K et WASP (
Wiskott–Aldrich syndrome protein
) dans la chimiotaxie [
1
]. La signalisation par CSF-1/CSF-1R a fait l’objet de beaucoup d’attention dans l’étude de la communication pathologique qui s’installe entre les macrophages et les cellules cancéreuses dans le microenvironnement tumoral. De nombreuses stratégies thérapeutiques ciblant cette signalisation, que ce soit à l’aide d’anticorps bloquants ou d’inhibiteurs spécifiques de tyrosine kinases, ont été évaluées dans des modèles tumoraux chez l’animal [
2
]. Ces recherches ont notamment permis de montrer l’importance du rôle des macrophages dans le microenvironnement tumoral dans des modèles murins, en supprimant cette population de cellules immunitaires ou en la reprogrammant [
3
,
4
]. Cependant, les essais thérapeutiques fondés sur une telle stratégie chez l’homme ont été jusqu’à présent décevants [
5
,
6
]. Il convient donc de tenter de comprendre les mécanismes en jeu dans le ciblage de CSF1-R chez l’homme, et notamment de préciser les différences entre les macrophages murins et humains.
|
Rôle de la signalisation par CSF-1/CSF-1R dans la reprogrammation métabolique des macrophages humains
Jusqu’à récemment, l’implication de CSF-1 dans la biologie du macrophage était principalement centrée sur sa capacité à induire la différenciation des monocytes et leur survie. Néanmoins, nous avons observé que les macrophages, une fois différenciés, ne nécessitent plus d’apport extérieur de CSF-1, probablement du fait d’une sécrétion autocrine de ce facteur. Étonnamment, le blocage de l’activation du CSF-1R dans des macrophages humains ne s’accompagnait pas d’une induction de la mort cellulaire, soulevant la question du rôle de cette voie de signalisation dans leur fonctionnement. Par une approche transcriptomique, nous avons pu montrer que l’une des principales conséquences du blocage de CSF-1R dans des macrophages matures est l’inhibition de la synthèse du cholestérol sous le contrôle du facteur de transcription SREBP-2 (
sterol regulatory element binding transcription factor 2
), dont la synthèse et l’activité sont sous la dépendance de la signalisation par CSF-1R [
7
] (
Figure 1
). Outre son rôle dans la composition et les propriétés biophysiques des membranes cellulaires, le cholestérol a été impliqué dans la communication entre les macrophages et les cellules cancéreuses. En effet, l’efflux de cholestérol provenant du macrophage est capable d’induire la synthèse et la sécrétion, par les cellules cancéreuses, d’acide hyaluronique qui, en retour, active la voie dépendante de STAT6 dans le macrophage, lui conférant un phénotype protumoral [
8
]. Dans notre travail, nous avons pu mettre en évidence que cet efflux de cholestérol peut être contrecarré par l’utilisation d’un inhibiteur de tyrosine kinase spécifique de CSF-1R (l’edicotinib), sans moduler l’expression des protéines responsables de l’efflux, mais en diminuant la réserve cellulaire de cholestérol disponible pour cet efflux [
7
]. Nous avons recherché les conséquences d’un blocage de la signalisation par CSF-1/CSF-1R dans un environnement pauvre en oxygène (hypoxique), proche de l’environnement tumoral réel. Nous avons ainsi mis en évidence l’existence d’une synthèse d’acides gras sous la dépendance du facteur de transcription SREBP-1 (principalement), qui est lui-même sous la dépendance de la signalisation par CSF-1R. En effet, le blocage de ce récepteur diminue l’expression, dépendante de SREBP-1, de l’enzyme acide gras synthase (
fatty acid synthase
, FASN), qui contrôle la synthèse de certains acides gras induisant une polarisation des macrophages de type M2
1,
favorisant la tumeur. Ce résultat illustre le lien entre l’orientation phénotypique des macrophages et leur métabolisme, que l’on peut reprogrammer en ciblant la signalisation par CSF1-R [
7
].
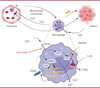 | Figure 1.
Représentation schématique des conséquences du ciblage de la voie de signalisation par CSF-1R dans les macrophages humains en utilisant un inhibiteur de tyrosine kinase spécifique de ce récepteur (edicotinib)
.
Ces conséquences comprennent : 1) l’inhibition du métabolisme du cholestérol, des acides gras impliqués dans la communication des macrophages avec les cellules cancéreuses et l’orientation phénotypique anti-inflammatoire, 2) l’inhibition du recrutement de nouveaux monocytes impliquant CCL(
C-C motif chemokine ligand)
2 et CCL7, et 3) la modulation de la réponse à l’hypoxie sous contrôle de HIF-2α (
hypoxia-inducible factor 2α
), entraînant l’inhibition de l’expression de la dihydropyrimidine déshydrogénase (DPD), enzyme responsable, par sa production en excès, de la résistance tumorale au 5-fluorouracile (5-FU) impliquant les macrophages (Figure réalisée avec l’outil logiciel BioRender).
|
|
Opportunité pour le ciblage de la chimiorésistance au 5-fluorouracile induite par les macrophages
Nous avons constaté que le blocage de la signalisation par CSF1-R interfère avec l’expression de certains gènes impliqués dans la réponse des macrophages à une hypoxie, dont le gène
EPAS1
(
endothelial PAS domain protein 1
), qui code le facteur de transcription HIF-2α (
hypoxiainducible factor 2α
). Cette déstabilisation de HIF-2α, liée à l’inhibition de la phosphorylation de ERK1/2, nous a permis d’explorer les conséquences fonctionnelles de la reprogrammation induite par le blocage de la signalisation par CSF1-R. Nous avions précédemment découvert que les macrophages humains hypoxiques synthétisent de grandes quantités de dihydropyrimidine déshydrogénase sous l’action d’un complexe de «
capping
» de l’ARNm
2
présent uniquement en situation d’hypoxie, et qui comprend HIF-2α (indépendamment de son rôle de facteur de transcription) [
9
]. Nous avions pu montrer que l’expression accrue de cette enzyme dans les macrophages hypoxiques conduit, dans les cancers colorectaux, à une résistance au 5-fluorouracile
3
[
10
,
11
] (
→
).
(→) Voir la Nouvelle de M. Malier
et al., m/s
n° 3, mars 2022, page 243
À présent, nous montrons que le ciblage de CSF-1R est une stratégie potentielle pour récupérer la sensibilité des cancers colorectaux à cet anti-cancéreux [
7
].
|
Reprogrammation métabolique et communication entre macrophages et cellules tumorales
Cette stratégie de ciblage d’une voie de signalisation impliquée dans le métabolisme des macrophages tumoraux posait toutefois la question de son efficacité s’il existe un recrutement continu de nouveaux monocytes/macrophages pouvant contribuer à la résistance au 5-fluorouracile. Or, nous avons découvert que la sécrétion, par les macrophages, des chimiokines CCL2 (
C-C motif chemokine ligand 2
) et CCL7 impliquées dans le recrutement de nouveaux monocytes, est aussi sous la dépendance de la signalisation par CSF-1R (
Figure 1
). L’excellente tolérance des inhibiteurs de CSF-1R chez l’homme ouvre donc la perspective d’utiliser ces molécules en accompagnement du 5-fluorouracile pour prévenir la résistance des cancers digestifs à cette chimiothérapie.
|
Footnotes |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Stanley
ER
,
Chitu
V
.
CSF-1 receptor signaling in myeloid cells.
.
Cold Spring Harb Perspect Bio
.
2014;
;
6
:
:a021857.
.
2.
Cannarile
MA
,
Weisser
M
,
Jacob
W
,
et al.
.
Colonystimulating factor 1 receptor (CSF1R) inhibitors in cancer therapy.
.
J Immunother Cancer
.
2017;
;
5
:
:53.
.
3.
Pyonteck
SM
,
Akkari
L
,
Schuhmacher
AJ
,
et al.
.
CSF-1R inhibition alters macrophage polarization and blocks glioma progression.
.
Nat Med
.
2013;
;
19
:
:1264.
–
72
.
4.
Olson
OC
,
Kim
H
,
Quail
DF
,
et al.
.
Tumor-associated macrophages suppress the cytotoxic activity of antimitotic agents.
.
Cell Rep
.
2017;
;
19
:
:101.
–
13
.
5.
Quail
DF
,
Joyce
JA
.
Molecular pathways: Deciphering mechanisms of resistance to macrophage-targeted therapies.
.
Clin Cancer Res
.
2017;
;
23
:
:876.
–
84
.
6.
Barry
ST
,
Gabrilovich
DI
,
Sansom
OJ
,
et al.
.
Therapeutic targeting of tumour myeloid cells.
.
Nat Rev Cancer
.
2023;
;
23
:
:216.
–
37
.
7.
Gharzeddine
K
,
Prieto
CG
,
Malier
M
,
et al.
.
Metabolic reprogramming of hypoxic tumor-associated macrophages through CSF-1R targeting favors treatment efficiency in colorectal cancers.
.
J Immunother Cancer
.
2024;
;
12
:
:e009602.
.
8.
Goossens
P
,
Rodriguez-Vita
J
,
Etzerodt
A
,
et al.
.
Membrane cholesterol efflux drives tumor-associated macrophage reprogramming and tumor progression.
.
Cell Metab
.
2019;
;
29
:
:1376.
-
89.e4
.
9.
Uniacke
J
,
Holterman
CE
,
Lachance
G
,
et al.
.
An oxygen-regulated switch in the protein synthesis machinery.
.
Nature
.
2012;
;
486
:
:126.
–
9
.
10.
Malier
M
,
Gharzeddine
K
,
Laverriere
M-H
,
et al.
.
Hypoxia drives dihydropyrimidine dehydrogenase expression in macrophages and confers chemoresistance in colorectal cancer.
.
Cancer Res
.
2021;
;
81
:
:5963.
–
76
.
11.
Malier
M
,
Gharzeddine
K
,
Laverriere
MH
,
et al.
.
Les macrophages associés à la tumeur : de nouvelles cibles pour contrecarrer la chimiorésistance au 5-fluorouracile dans les cancers colorectaux ?
Med Sci (Paris)
.
2022;
;
38
:
:243.
–
5
.
|