| |
| Med Sci (Paris). 41(1): 12–15. doi: 10.1051/medsci/2024186.Détection immunitaire des toxines bactériennes inhibitrices de la traduction dans les cellules épithéliales Miriam Pinilla,1 Léana Gorse,1 and Étienne Meunier1* 1Institut de pharmacologie et de biologie structurale, université de Toulouse, CNRS UMR5089
,
France MeSH keywords: |
Inactivation du fonctionnement des ribosomes par les bactéries pathogènes
Les organismes vivants sont continuellement exposés à des agents microbiens, dont certains sont pathogènes et déclenchent une réponse immunitaire à l’infection. Parmi les nombreuses stratégies développées par les bactéries pathogènes pour échapper à une réponse immunitaire efficace, nous nous sommes intéressés à l’inhibition de la traduction, par les ribosomes, des ARN messagers (ARNm) cellulaires en protéines, vecteurs essentiels des fonctions cellulaires et immunitaires. La traduction des ARNm comporte trois processus successifs : l’initiation, l’élongation des peptides, et la terminaison [
1
]. De nombreux facteurs cellulaires sont impliqués dans chacun de ces processus, et constituent des cibles de choix pour de nombreux agents infectieux.
Pendant la phase d’initiation, le complexe moléculaire de pré-initiation balaye l’ARNm de 5’ vers 3’ jusqu’à ce qu’il « rencontre » un codon initiateur AUG. Cette rencontre indique le début de la synthèse protéique. Le ribosome se déplace ensuite le long de l’ARNm en ajoutant successivement, codon après codon, les acides aminés à la protéine en formation [
1
]. La GTPase eEF2 (
eukaryotic elongation factor 2
) joue un rôle primordial dans le déplacement du ribosome d’un codon au codon suivant. Pour être active, eEF2 doit subir une modification post-traductionnelle unique : la transformation d’un résidu histidine (en position 715 dans la séquence de la protéine humaine) en diphtamide [
2
], un processus qui nécessite cinq protéines DPH (
diphthamide biosynthesis proteins
) différentes [
3
] (
Figure 1
). La diphtamide a été conservée durant l’évolution des eucaryotes et des archées, mais elle est absente chez les bactéries, ce qui en fait une cible de choix pour les agents pathogènes bactériens.
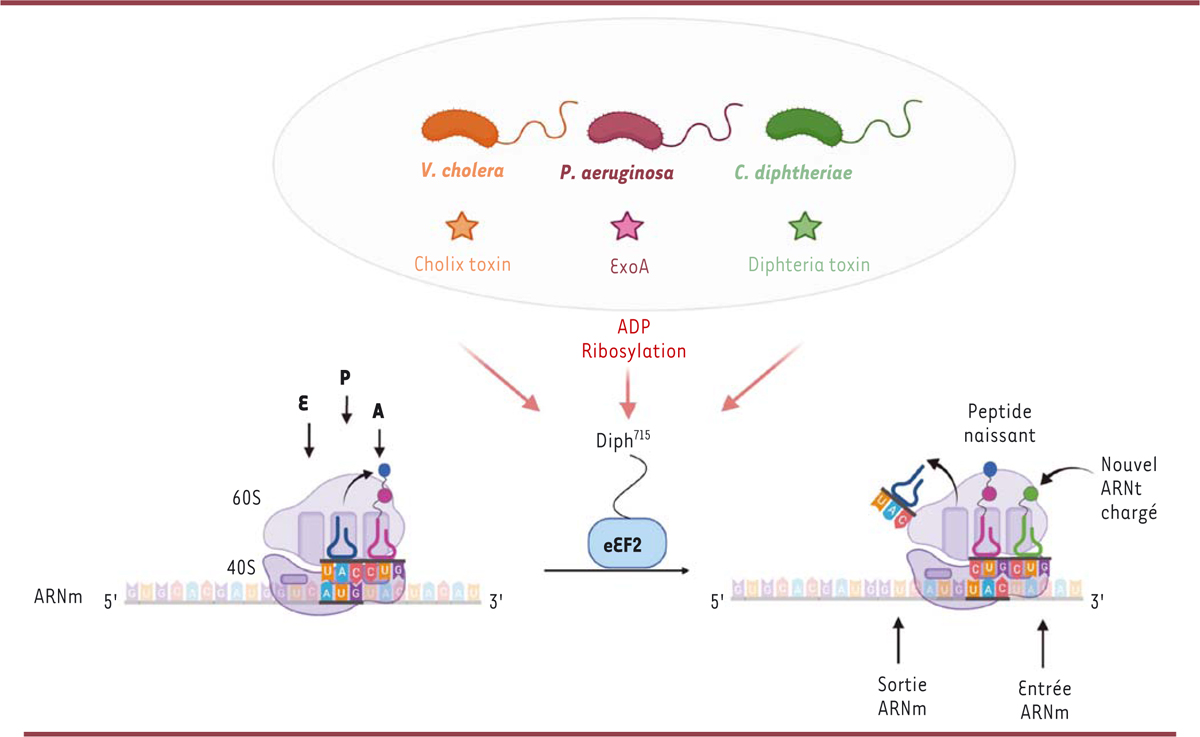
 | Figure 1.
Schéma de la translocation des ribosomes des cellules eucaryotes sur l’ARN messager et des toxines bactériennes ciblant le facteur d’élongation eEF2
.
Pendant l’élongation des protéines en cours de synthèse, le ribosome (constitué de ses sous-unités 60S et 40S) se déplace le long de l’ARN messager (ARNm), codon par codon (du site A vers le site E), en ajoutant, grâce aux différents ARN de transfert (ARNt), les acides aminés successifs à la protéine en formation. Le facteur d’élongation eEF2 est impliqué dans la translocation du ribosome au codon suivant. Certaines toxines bactériennes (toxine cholérique, exotoxine A, toxine diphtérique) sont capables de bloquer cette translocation des ribosomes par ADP-ribosylation du facteur eEF2 sur son résidu diphtamide, situé en position 715 de la séquence des acides aminés (Diph
715
). (Figure créée avec le logiciel
Biorender.com
).
|
Dans ce contexte, les bactéries pathogènes
Corynebacterium diphtheriae
(
C. diphtheriae
) [
4
],
Pseudomonas aeruginosa
(
P. aeruginosa
) [
2
] et
Vibrio cholerae
(
V. cholerae
) [
5
] sécrètent respectivement la toxine diphtérique, l’exotoxine A et la toxine cholix, qui ciblent toutes les trois le résidu diphtamide de eEF2. Cela conduit à une modification de ce résidu par ADP-ribosylation, ce qui inactive eEF2 et bloque totalement la synthèse des protéines (
Figure 1
). Une conséquence majeure de l’inactivation de la traduction des ARNm est la mise en place d’une réponse cellulaire au « stress ribotoxique », déclenchée par la collision entre les ribosomes incapables de poursuivre le processus de traduction. Cette collision est détectée par la protéine kinase de stress ZAKα, appartenant à la famille des MAP kinases (
mitogen-activated protein kinases
) [
6
]. Dans ce contexte, un changement de conformation de ZAKα et son interaction avec d’autres molécules ZAKα conduisent à son activation par autophosphorylation et à l’activation de deux voies de stress primordiales impliquant les MAP kinases p38 et JNK (
c-Jun N-terminal kinase
) [
6
]. Il en résulte, d’une part, la mise en place d’un programme transcriptionnel caractérisé par l’activation du facteur de transcription ATF4 (
activating transcription factor 4
), permettant de réparer les dommages cellulaires causés par la collision des ribosomes, et d’autre part, la mise en place d’un programme de mort cellulaire programmée non inflammatoire (apoptose) [
6
]. Récemment, il a été découvert que la collision des ribosomes à la suite d’un stress environnemental (exposition aux rayons ultra-violets B, UVB) avait pour conséquence l’activation d’un troisième programme cellulaire induit par ZAKα et la kinase p38 : l’activation de l’inflammasome NLRP1 (
nucleotide-binding domain and leucine-rich repeat containing protein 1
), conduisant à un programme de mort cellulaire inflammatoire (pyroptose), et à la libération de cytokines pro-inflammatoires, les interleukines 1β et 18 [
7
]. Ce troisième programme cellulaire est absent dans de nombreuses cellules tumorales et dans les cellules des rongeurs couramment utilisés pour la recherche (souris et rat), ce qui explique pourquoi les études précédentes n’ont pas pu le mettre en évidence. Cela suggère que l’inflammasome NLRP1 pourrait également avoir un rôle dans la mise en place d’une réponse inflammatoire et immunitaire au cours d’infections par les bactéries
V. cholerae
,
C. diphtheriae
ou
P. aeruginosa
, dont les toxines inhibent le fonctionnement des ribosomes dans les cellules infectées.
|
Rôle de l’inflammasome NLRP1 dans la réponse au stress ribotoxique
Les inflammasomes sont des complexes multiprotéiques activés par divers signaux infectieux ou stress environnementaux [
7
,
8
]. L’inflammasome est composé d’un récepteur cellulaire, d’une protéine adaptatrice ASC (
apoptosis-associated speck-like protein containing a CARD domain
) et de l’effecteur de ce complexe, la protéase caspase-1. Une fois l’inflammasome activé, la caspase-1 active à son tour l’interleukine-1β et l’interleukine-18 (cytokines pro-inflammatoires) par clivage enzymatique. En parallèle, la caspase-1 clive également la protéine gasdermine D, dont le fragment N-terminal forme des pores dans la membrane cellulaire, conduisant ainsi à la libération des interleukines et à la pyroptose. L’inflammasome NLRP1 se distingue des autres inflammasomes par son expression dans divers épithéliums de revêtement, comme ceux de la peau, de la cornée de l’œil, ou encore des voies respiratoires. De plus, de rares mutations de
NLRP1
sont associées à une sensibilité accrue aux infections, à des maladies inflammatoires de la peau, de l’intestin et de la cornée, ainsi qu’à une susceptibilité à l’asthme chez l’homme, ce qui témoigne de l’importance du rôle joué par NLRP1 dans divers épithéliums [
8
]. Nous nous sommes intéressés au rôle de l’exotoxine A produite par
P. aeruginosa
dans l’activation de l’inflammasome NLRP1, et à son implication dans le contexte pathologique de la mucoviscidose [
9
]
. P. aeruginosa
est une bactérie pathogène opportuniste, qui peut infecter les cellules de la majorité des organes et tissus chez l’homme (notamment, voies respiratoires, voies urinaires, peau, œil). Elle provoque des infections nosocomiales chroniques, notamment chez les patients atteints de mucoviscidose, de dyskinésie ciliaire, ou encore de bronchectasie
1
. De plus, en raison de la résistance croissante de cette bactérie aux antibiotiques, les infections par
P. aeruginosa
constituent un problème de santé publique.
Dans ce contexte, nous avons montré que
P. aeruginosa
est capable d’induire, dans les cellules épithéliales humaines nasales et de la cornée, une mort lytique et inflammatoire (pyroptose), caractérisée par la libération d’interleukine-1β, d’interleukine-18, et de LDH (
lactate déshydrogénase)
. En utilisant différentes souches de
P. aeruginosa
déficientes ou non pour ses différentes toxines, nous avons montré que l’exotoxine A, par son action inhibitrice sur le facteur d’élongation eEF2, induit un stress ribotoxique qui active les kinases ZAKα et p38, et que cette dernière active l’inflammasome NLRP1, ce qui induit la pyroptose et la production d’interleukine-1β (
Figure 2
). De plus, l’utilisation de cellules déficientes pour DPH1 inhibe l’activation de l’inflammasome NLRP1 en réponse à l’exotoxine A, confirmant l’action de cette toxine sur l’acide aminé diphthamide de eEF2 [
9
]. Il convient de noter que des déficiences en DPH1 liées à des mutations génétiques ont été découvertes récemment chez certaines personnes, ce qui pose la question de la réponse immunitaire de ces patients face aux infections par les bactéries dont les toxines ciblent le résidu diphtamide de eEF2 (
P. aeruginosa
,
V. cholerae
,
C. diphtheriae
) [
10
].
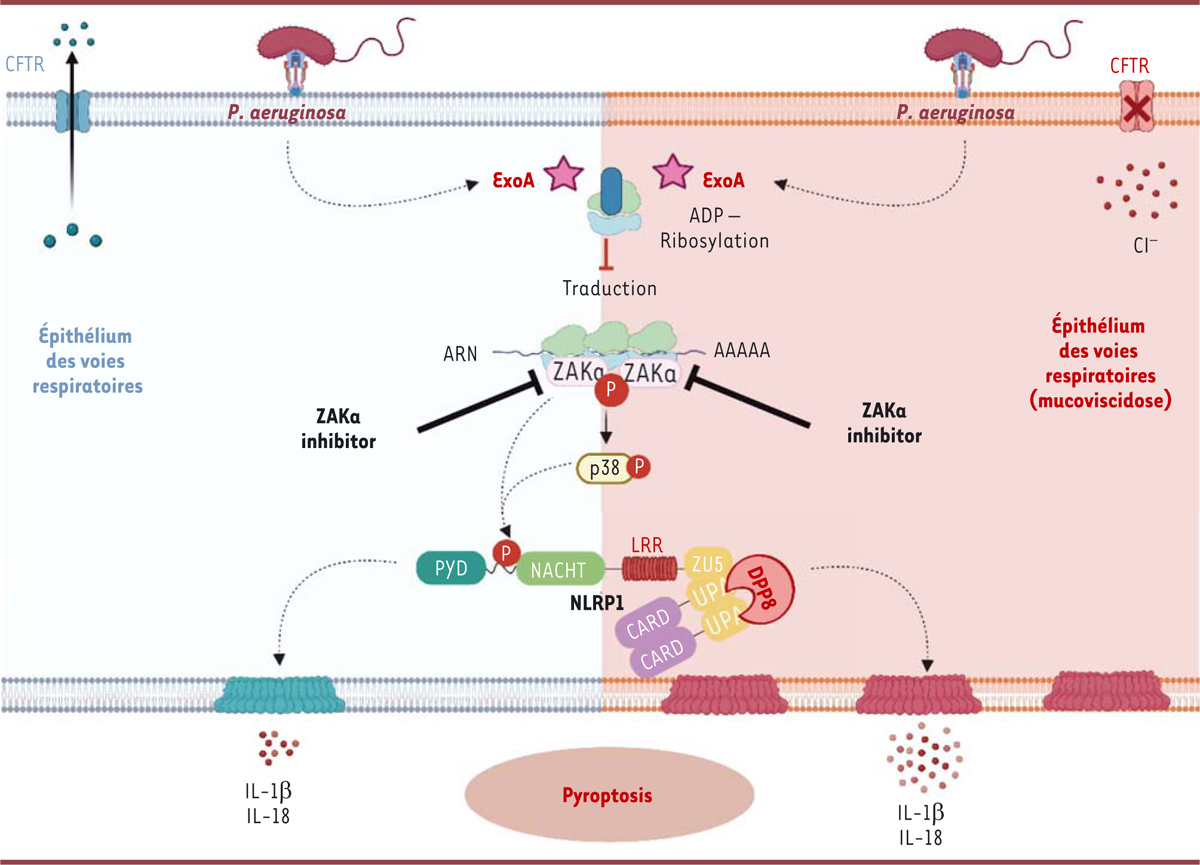
 | Figure 2.
Mécanisme d’action de l’exotoxine A de Pseudomonas aeruginosa dans l’épithélium des voies respiratoires
.
L’exotoxine A (ExoA), libérée par la bactérie
P. aeruginosa
, inhibe la traduction des ARN messagers cellulaires en protéines
via
l’ADP-ribosylation du facteur d’élongation eEF2. Cette inhibition induit la collision des ribosomes et l’activation de la réponse au stress ribotoxique, impliquant l’activation et la phosphorylation de la kinase ZAKα qui à son tour active et phosphoryle la kinase p38. Ces deux kinases sont capables d’activer l’inflammasome NLRP1 par phosphorylation et d’induire une mort cellulaire inflammatoire, avec libération de cytokines IL(interleukine)-1β et IL-18 (schéma de gauche). Cette mort cellulaire par pyroptose est exacerbée dans le contexte de la mucoviscidose (schéma de droite). CFTR :
cystic fibrosis transmembrane conductance regulator
; Cl
-
: ion chlorure ; PYD :
pyrin domain
; NACHT :
NACHT domain
; LRR :
leucine-rich repeats
; CARD :
caspase recruitment domain
; ZU5 :
found in ZO-1 and UNC5
; UPA :
conserved in UNC5, PIDD and ankyrin domain
; DPP8 : dipeptidylpeptidase 8. (Figure créée avec le logiciel
Biorender.com
).
|
Par la suite, nous nous sommes intéressés aux conséquences physiologiques et pathologiques de l’activation de l’inflammasome NLRP1 au cours d’une infection par
P. aeruginosa
dans des cellules issues de patients atteints de mucoviscidose et porteurs de la mutation Phe508del dans la protéine CFTR (
cystic fibrosis transmembrane conductance regulator
), la mutation la plus fréquente dans cette maladie. Nous avons montré que la pyroptose est exacerbée dans les cellules épithéliales des voies respiratoires provenant de patients atteints de mucoviscidose en réponse à l’exotoxine A ou à l’infection par
P. aeruginosa
. De plus, nous avons mis en évidence que cette exacerbation de la pyroptose implique une suractivation de la protéine kinase p38 à l’état basal dans les cellules de ces patients. Ce processus est réversible grâce à l’utilisation
in vitro
des « correcteurs du CFTR » issus de la trithérapie Kaftrio
®
[
11
] (
→
).
(→) Voir la Synthèse de E. Bardin
et al., m/s
n° 3, mars 2024, page 258
Dans ce contexte, l’utilisation d’inhibiteurs de la kinase ZAKα, mais également de p38, a entraîné une inhibition totale de la mort par pyroptose des cellules nasales ou de la cornée provenant d’individus sains, mais aussi des cellules provenant des patients atteints de mucoviscidose (
Figure 2
). L’équipe de recherche dirigée par Franklin Zhong a également montré, dans un modèle cutané 3D d’infection par
C. diphtheriae
, que la toxine diphtérique perturbe l’intégrité de la barrière épidermique
via
le stress ribotoxique des kératinocytes et la pyroptose induite par l’inflammasome NLRP1 [
12
].
|
Plusieurs bactéries pathogènes perturbent le fonctionnement des cellules de l’organisme qu’elles infectent en ciblant les différents acteurs de la traduction des ARNm cellulaires en protéines, notamment le facteur d’élongation eEF2. Elles stimulent ainsi leur propre réplication, ce qui favorise leur propagation dans l’organisme. L’inflammasome NLRP1 joue un rôle central dans l’activation de la réponse immunitaire innée des épithéliums de revêtement face à l’agresseur, en induisant la mort lytique et pro-inflammatoire (pyroptose) des cellules épithéliales. |
Footnotes |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article
.
|
1.
Jackson
RJ
,
Hellen
CUT
,
Pestova
TV
.
The mechanism of eukaryotic translation initiation and principles of its regulation.
.
Nat Rev Mol Cell Biol
.
2010;
;
11
:
:113.
–
27
.
2.
Jørgensen
R
,
Merrill
AR
,
Yates
SP
,
et al.
.
Exotoxin A-eEF2 complex structure indicates ADP ribosylation by ribosome mimicry.
.
Nature
.
2005;
;
436
:
:979.
–
84
.
3.
Liu
S
,
Milne
GT
,
Kuremsky
JG
,
et al.
.
Identification of the proteins required for biosynthesis of diphthamide, the target of bacterial ADP-ribosylating toxins on translation elongation factor 2.
.
Mol Cell Biol
.
2004;
;
24
:
:9487.
–
97
.
4.
Holmes
RK.
Biology and molecular epidemiology of diphtheria toxin and the tox gene.
.
J Infect Dis
.
2000;
;
181
:
:S156.
–
67
.
5.
Jørgensen
R
,
Purdy
AE
,
Fieldhouse
RJ
,
et al.
.
Cholix toxin, a novel ADP-ribosylating factor from
Vibrio cholerae
.
.
J Biol Chem
.
2008;
;
283
:
:10671.
–
8
.
6.
Vind
AC
,
Snieckute
G
,
Blasius
M
,
et al.
.
ZAKα recognizes stalled ribosomes through partially redundant sensor domains.
.
Mol Cell
.
2020;
;
78
:
:700.
–
13
.
7.
Robinson
KS
,
Toh
GA
,
Rozario
P
,
et al.
.
ZAKα-driven ribotoxic stress response activates the human NLRP1 inflammasome.
.
Science
.
2022;
;
377
:
:328.
–
35
.
8.
Bauernfried
S
,
Hornung
V
.
Human NLRP1: From the shadows to center stage.
.
J Exp Med
.
2021;
;
219
:
:e20211405.
.
9.
Pinilla
M
,
Mazars
R
,
Vergé
R
,
et al.
.
EEF2-inactivating toxins engage the NLRP1 inflammasome and promote epithelial barrier disruption.
.
J Exp Med
.
2023;
;
220
:
:e20230104.
.
10.
Urreizti
R
,
Mayer
K
,
Evrony
G
,
et al.
.
DPH1 syndrome: two novel variants and structural and functional analyses of seven missense variants identified in syndromic patients.
.
Eur J Hum Genet
.
2020;
;
28
:
:64.
–
75
.
11.
Bardin
E
,
Pranke
I
,
Hinzpeter
A
,
Sermet-Gaudelus
I.
Traitements de la mucoviscidose : révolution clinique et nouveaux défis.
.
Med Sci (Paris)
.
2024;
;
40
:
:258.
–
67
.
12.
Robinson
KS
,
Toh
GA
,
Firdaus
MJ
,
et al.
.
Diphtheria toxin activates ribotoxic stress and NLRP1 inflammasome-driven pyroptosis.
.
J Exp Med
.
2023;
;
220
:
:e20230105.
.
|