| |
| Med Sci (Paris). 40: 22–25. doi: 10.1051/medsci/2024132.Intérêt du traitement par rituximab dans la myasthénie auto-immune de l’enfant Agathe Molimard, MD,1* Cyril Gitiaux, MD, PhD,1 Christine Barnerias, MD,1 Frédérique Audic, MD,2 Arnaud Isapof, MD,3 Ulrike Walther-Louvier, MD,4 Claude Cances, MD,5 Caroline Espil-Taris, MD,6 Davion Jean-Baptiste, MD,7 Susana Quijano-Roy, MD PhD,8 Coraline Grisel, MD,9 Brigitte Chabrol, MD PhD,2 and Isabelle Desguerre, MD, PhD1 1Centre de référence des maladies neuromusculaires Nord/Île-de-France/Est, Service de Neurologie pédiatrique, Hôpital Necker-Enfants Malades, APHP
,
Paris
,
France 2Centre de Référence des Maladies Neuromusculaires de l’enfant PACARARE, Service de Neuropédiatrie, Hôpital Timone Enfants
,
Marseille
,
France 3Centre de référence des maladies neuromusculaires Nord/Île-de-France/Est, Service de Neurologie pédiatrique, hôpital Trousseau, APHP
,
Paris
,
France 4Centre de référence des maladies neuromusculaires AOC, service de neuropédiatrie CHU Montpellier
,
France 5Centre de référence des maladies neuromusculaires AOC, unité de neurologie pédiatrique, hôpital des Enfants CHU Toulouse
,
France 6Centre de référence des maladies neuromusculaires AOC, unité de neurologie pédiatrique, CHU Pellegrin
,
Bordeaux
,
France 7Centre de référence des maladies neuromusculaires Nord/Île-de-France/Est, CHU de Lille
,
France 8Centre de référence des maladies neuromusculaires Nord/Île-de-France/Est, Service de Neurologie pédiatrique, hôpital Raymond Poincaré, APHP
,
Garches
,
France 9Service de pédiatrie, Centre hospitalier intercommunal de Créteil
,
France |
© C. Gitiaux
Vignette: Examen en fibre unique stimulée anormale (muscle
orbicularis oris
) dans le cadre d’une myasthénie auto-immune.
La myasthénie auto-immune de l’enfant est définie par l’apparition de la maladie avant l’âge de 18 ans. Si la physiopathologie et les formes cliniques sont similaires à celles de l’adulte, il existe un certain nombre de particularités propres à l’enfant qui influencent l’évolution et la prise en charge thérapeutique.
La myasthénie auto-immune est une maladie médiée par des anticorps dirigés contre des composants de la jonction neuromusculaire. Ces anticorps affectent la transmission synaptique et sont ainsi responsables d’une fatigabilité musculaire. Dans la majorité des cas (50 à 70 % chez l’enfant), les anticorps sont dirigés contre les récepteurs à l’acétylcholine (RACh). Plus rarement, des anticorps dirigés contre la tyrosine kinase musculaire (MuSK pour
muscle specific tyosine kinase) sont ret
rouvés. Enfin, dans 30 à 40 % des myasthénies auto-immunes de l’enfant, aucun anticorps n’est retrouvé, ce sont les formes dites séronégatives [
1
].
Il existe deux formes cliniques principales : oculaire et généralisée. La myasthénie oculaire affecte les muscles extra-oculaires, provoquant une diplopie et un ptosis. La forme généralisée peut toucher tous les muscles squelettiques. Selon l’atteinte, les symptômes sont variés : asthénie, fatigabilité à l’effort, hypomimie, troubles de la déglutition, de la phonation, de la mastication, dyspnée, toux inefficace, encombrement, etc. L’évolution est marquée par des périodes d’exacerbation et de rémission. Les crises myasthéniques (aggravation rapide de la symptomatologie durant quelques heures à quelques jours) marquent la gravité de la maladie, notamment en cas d’atteintes respiratoires et/ou bulbaires [
2
] qui constituent une urgence absolue devant la mise en jeu du pronostic vital.
Le développement de médicaments immunomodulateurs au cours des dernières décennies a amélioré le pronostic de la myasthénie auto-immune, mais ces thérapies sont peu étudiées en pédiatrie et leur utilisation est basée sur l’expérience acquise auprès des patients adultes [
3
]. Les corticostéroïdes, malgré leurs effets indésirables fréquents (retard de croissance, prise de poids, modification physique, etc.), restent le traitement de première ligne en pédiatrie. Le rituximab est un traitement de plus en plus utilisé en France dans la myasthénie auto-immune de l’enfant. Cependant, il n’est recommandé qu’en troisième intention (après les corticostéroïdes et l’azathioprine) si des anticorps anti-MuSK sont retrouvés, et en quatrième ligne d’immunosuppression dans les formes à anticorps anti-RACh [
4
]. En outre, il n’existe pas à ce jour d’essais thérapeutiques contrôlés randomisés dans la myasthénie auto-immune de l’enfant.
L’objectif de cette étude est de proposer une nouvelle place pour le rituximab dans la stratégie thérapeutique de la myasthénie juvénile. |
Étude rétrospective française des cas de myasthénies auto-immunes de l’enfant
Nous avons réalisé une étude rétrospective dans huit centres de référence neuromusculaires pédiatriques de la filière de santé Filnemus (Bordeaux, Lille, Marseille, Montpellier, Toulouse, Paris-Necker, Paris-Trousseau, Garches). Nous avons inclus tous les enfants suivis pour une myasthénie auto-immune dont le diagnostic avait été posé entre le 1
er
janvier 2009 et le 31 avril 2020.
Au total, 74 patients avec une myasthénie auto-immune ont été inclus, dont 56 (76 %) étaient suivis pour une forme généralisée. Le sex-ratio était de 1 garçon pour 2,2 filles et l’âge moyen de début de la maladie était de 8,7 ans (IQR 4,2-12,9). La durée médiane de suivi était de 5 ans (IQR 2,4-7,2). Parmi les 56 patients suivis pour une forme généralisée, 61 % avaient des anticorps anti-RACh, 9 % avaient des anticorps anti-MuSK et 30 % étaient séronégatifs. Nous nous sommes intéressés aux 37 patients (66 % des formes généralisées) ayant nécessité un traitement immunosuppresseur, et particulièrement aux 34 pour lesquels nous avions un recul de plus de 12 mois après l’initiation du traitement immunosuppresseur. |
Évolution de l’utilisation des immunosuppresseurs dans la myasthénie auto-immune de l’enfant
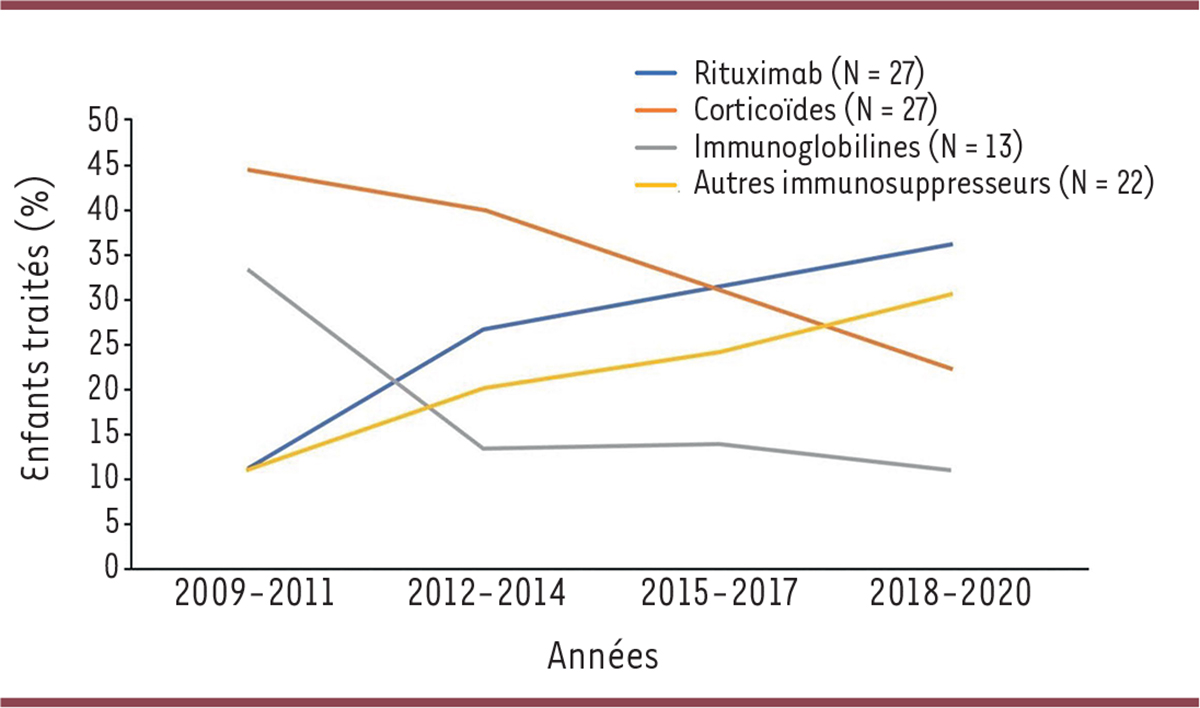
Nous avons observé une modification de nos pratiques au cours des dix dernières années avec une réduction de l’utilisation des corticoïdes (44 % des immuno-suppresseurs utilisés en 2009
vs
22 % en 2020) et une augmentation de l’utilisation du rituximab (0 % des immunosuppresseurs utilisés en 2009
vs
42 % en 2020) (
Figure 1
). Les corticoïdes restaient le traitement immunosuppresseur le plus utilisé en première intention dans notre cohorte (23 patients, soit 62 %), mais le rituximab avait été utilisé en première ligne d’immu-nosuppression chez plus d’un tiers des patients (13/37).
 | Figure 1 Évolution de l’utilisation des immunosuppresseurs dans la myasthénie auto-immune de l’enfant en France, entre 2009 et 2020. |
|
Efficacité du rituximab dans la myasthénie auto-immune de l’enfant
Parmi les 34 patients de la cohorte traités par immunosuppresseurs avec une durée de suivi supérieure à 12 mois, 24 (71 %) avaient été traités par rituximab (groupe RTX+) (
Tableau 1
).
Tableau I.
|
Groupe RTX-N = 10 |
Groupe RTX+N = 24 |
| Âge au diagnostic à, moyenne (IQR) |
6,3 (2,7-10,1) |
12,3 (10,5-14,5) |
|
| Sexe féminin/masculin, No. (%) |
7 (70)/3 (30) |
19 (79)/5 (21) |
|
| Anticorps |
|
|
|
| Anti-RACh, No. (%) |
5 (50) |
20 (83) |
|
| Anti-MuSK, No. (%) |
2 (20) |
3 (13) |
|
| Séronégatifs, No. (%) |
3 (30) |
1 (4) |
|
| Hospitalisations en soins intensifs, No. (%) |
1 (10) |
15 (63) |
|
| Corticothérapie, No. (%) |
9 (90) |
16 (67) |
|
| Corticothérapie en cours à la dernière visite, No. (%) |
4 (40) |
4 (17) |
|
| Durée du suivi après la première ligne d’immunosuppression à, moyenne (IQR) |
4,9 (2,5-6,7) |
4,6 (1,9-6,2) |
Caractéristiques des 34 patients traités par immunosuppresseurs. |
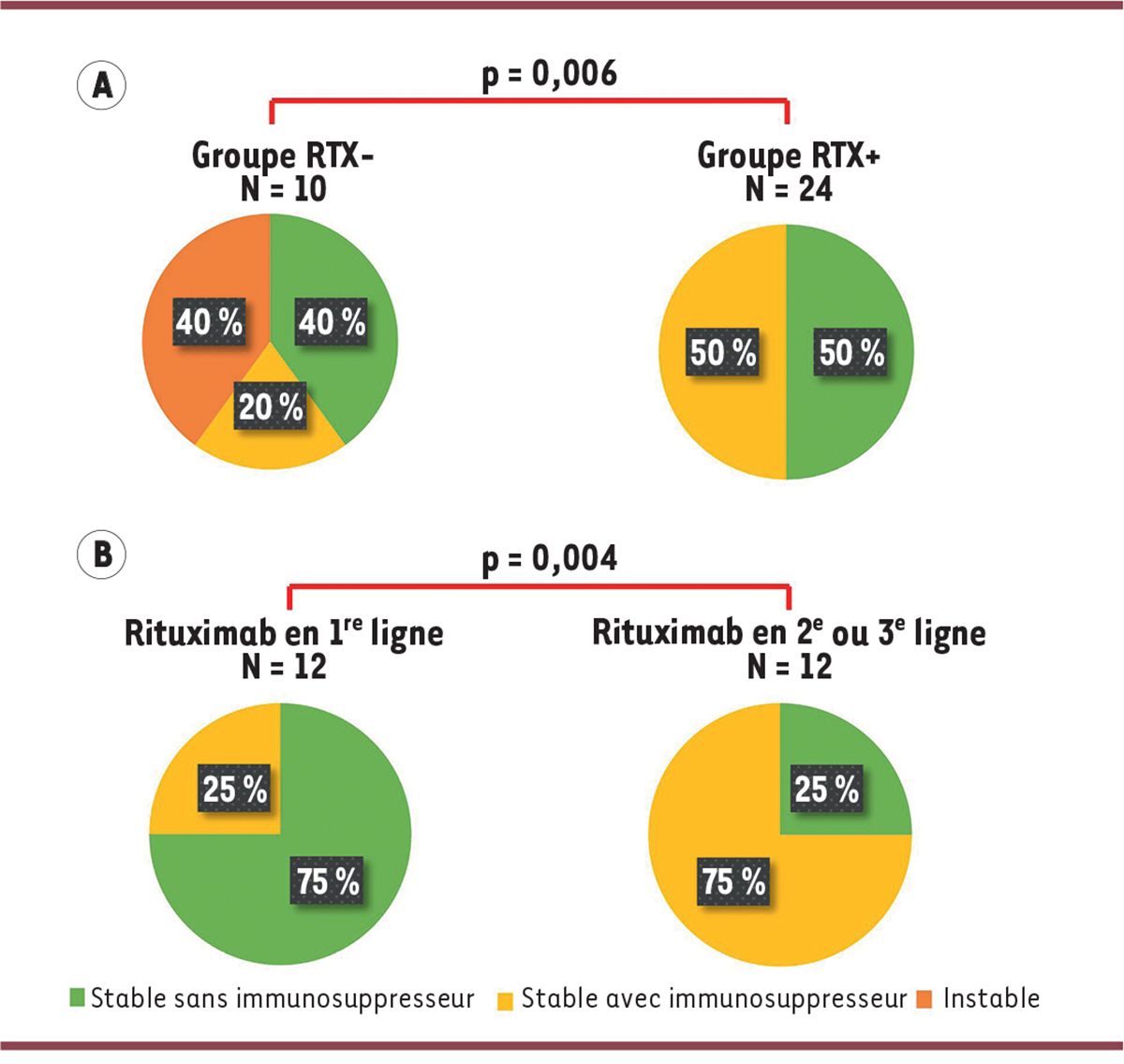
Ces patients avaient une maladie initiale significativement plus grave. 63 % des patients traités par rituximab (groupe RTX+) avaient été hospitalisés en réanimation au moins une fois avant l’introduction du traitement, contre 10 % parmi les patients non traités (groupe RTX-) (p < 0,008). Malgré cette gravité initiale importante, nous avons observé une meilleure évolution clinique des patients traités par rituximab. En effet, lors de la dernière visite, alors que 40 % des patients traités par immunosuppresseurs conventionnels (groupe RTX-) restaient cliniquement instables (persistance ou aggravation des symptômes malgré l’immunosuppresseur), tous les patients traités par rituximab étaient stables (pauci ou asymptomatiques) et la moitié d’entre eux était sevrée d’immunosuppresseurs (
Figure 2A
).
 | Figure 2
Évolution clinique des patients en fonction du traitement immunosuppresseur reçu
.
|
|
Intérêt d’une utilisation précoce du rituximab
Pour la première fois, nous avons rapporté dans la littérature 12 enfants traités par rituximab en première ligne. L’utilisation du rituximab en première ligne d’immunosuppression, par rapport à son utilisation en deuxième ou troisième ligne, montre un meilleur sevrage des traitements immunosuppresseurs à la fin du suivi (respectivement 75 %
vs
25 %) et une épargne cortisonique (respectivement 42 %
vs
92 % des patients traités par corticoïde) (
Figure 2B
).
Patients traités par immunosuppresseurs conventionnels (groupe RTX-)
versus
patients traités par rituximab (groupe RTX+)
Patients traités par rituximab en première ligne de traitements immunosuppresseurs
versus
patients traités par rituximab en deuxième ou troisième ligne de traitements immunosuppresseurs.
Le bénéfice de cette introduction précoce semble donc double. D’une part, les patients traités par rituximab en première intention ont une meilleure évolution que ceux initialement traités par immunothérapie conventionnelle. D’autre part, les corticoïdes sont significativement moins utilisés dans ce groupe.
Ces résultats sont concordants avec ceux d’une étude menée chez des adultes suivis pour une myasthénie auto-immune à anticorps anti-RACh, qui suggèrent que l’instauration précoce du rituximab après le diagnostic est associée à de meilleurs résultats et à une bonne tolérance, par rapport aux traitements par immunothérapie conventionnelle [
5
].
|
Mécanisme d’action et sécurité du rituximab
Ces résultats sont liés au mécanisme d’action du rituximab. Le rituximab est un anticorps monoclonal dirigé contre la protéine CD20 présente à la surface des cellules lymphocytaires pré-B et B matures. Cette protéine disparait au cours de la différenciation des lymphocytes B en plasmocytes (cellules à longue durée de vie produisant des anticorps). Le rituximab entraine ainsi la déplétion des cellules B immatures, matures, des cellules B mémoires et de certains plasmablastes, sans affecter les plasmocytes [
6
].
Dans le cas de la myasthénie auto-immune à anticorps anti-MuSK, le rituximab semble être particulièrement efficace, car il déplète les plasmablastes, les cellules responsables de la production des anticorps anti-MuSK [
7
]. Dans la myasthénie auto-immune à anticorps anti-RACh, l’anticorps pathologique est produit par les plasmocytes à longue durée de vie [
8
]. L’hypothèse est donc qu’une utilisation précoce du rituximab dans cette forme permettrait de limiter le développement du pool de plasmocytes produisant les anticorps anti-RACh [
9
].
Sur le plan de la sécurité d’utilisation, l’absence de déplétion des plasmocytes par le rituximab permet de limiter le risque infectieux par le maintien de la production d’immunoglobulines. Notre étude a montré une bonne sécurité du rituximab sans effet indésirable. Dans la littérature, le rituximab est bien toléré chez l’enfant et le jeune adulte. Il y est associé à peu d’effets indésirables graves, mais des réactions allergiques à l’injection et des infections sont rapportées. À l’heure actuelle, il n’existe pas de consensus sur la prévention du risque infectieux sous rituximab [
10
,
11
]. Dans notre étude, les stratégies de prévention des infections différaient selon les centres. Certaines équipes avaient mis en place, de manière systématique, des cures d’immunoglobulines substitutives mensuelles (38 %) et/ou un traitement préventif par cotrimoxazole (58 %) pendant toute la durée de la déplétion des lymphocytes B.
|
Nous avons pu observer l’utilisation croissante du rituximab dans la myasthénie auto-immune de l’enfant en France, au cours des dix dernières années. Compte tenu de son efficacité, des bénéfices d’épargne cortisonique et de sa bonne tolérance, il semble légitime de proposer l’utilisation du rituximab en première ligne d’immunosuppression dans la myasthénie auto-immune généralisée de l’enfant positif aux anticorps anti-RACh ou anti-MuSK. |
Agathe Molimard a reçu le prix Interne en médecine lors des journées de la Société française de myologie (SFM) 2022
.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article
.
|
1.
Barraud
C
,
Desguerre
I
,
Barnerias
C
,
et al.
.
Clinical features and evolution of juvenile myasthenia gravis in a French cohort.
.
Muscle Nerve
.
2018;
;
57
(
(4)
) :
:603.
–
609
.
2.
Anlar
B.
Juvenile Myasthenia.
.
Paediatr Drugs
.
2000;
;
2
(
(3)
) :
:161.
–
9
.
3.
Zingariello
CD
,
Elder
ME
,
Kang
PB.
Rituximab as Adjunct Maintenance Therapy for Refractory Juvenile Myasthenia Gravis.
.
Pediatr Neurol
.
2020;
;
111
:
:40.
–
43
.
4.
Narayanaswami
P
,
Sanders
DB
,
Wolfe
G
,
et al.
.
International consensus guidance for management of myasthenia gravis: 2020 update.
.
Neurology
.
2020;
;
96
(
(3)
) :
:114.
–
122
.
5.
Brauner
S
,
Eriksson-Dufva
A
,
Hietala
MA
,
et al.
.
Comparison Between Rituximab Treatment for New-Onset Generalized Myasthenia Gravis and Refractory Generalized Myasthenia Gravis.
.
JAMA Neurol
.
2020;
;
77
(
(8)
) :
:974.
–
981
.
6.
Pescovitz
MD.
Rituximab, an anti-cd20 monoclonal antibody: history and mechanism of action.
.
Am J Transplant
.
2006;
;
6
(
(5 Pt 1)
) :
:859.
–
866
.
7.
Hehir
MK
,
Hobson-Webb
LD
,
Benatar
M
,
et al.
.
Rituximab as treatment for anti-MuSK myasthenia gravis: Multicenter blinded prospective review.
.
Neurology
.
2017;
;
89
(
(10)
) :
:1069.
–
1077
.
8.
Fichtner
ML
,
Jiang
R
,
Bourke
A
,
et al.
.
Autoimmune Pathology in Myasthenia Gravis Disease Subtypes Is Governed by Divergent Mechanisms of Immunopathology.
.
Front Immunol
.
2020;
;
11
:
:776.
.
9.
Hachiya
Y
,
Uruha
A
,
Kasai-Yoshida
E
,
et al.
.
Rituximab ameliorates anti-N-methyl-D-aspartate receptor encephalitis by removal of short-lived plasmablasts.
.
J Neuroimmunol
.
2013;
;
265
(
(1-2)
) :
:128.
–
130
.
10.
McAtee
CL
,
Lubega
J
,
Underbrink
K
,
et al.
.
Association of Rituximab Use With Adverse Events in Children, Adolescents, and Young Adults.
.
JAMA Netw Open
.
2021;
;
4
(
(2)
) :
:e2036321.
.
11.
Piehl
F
,
Eriksson-Dufva
A
,
Budzianowska
A
,
et al.
.
Efficacy and Safety of Rituximab for New-Onset Generalized Myasthenia Gravis: The RINOMAX Randomized Clinical Trial.
.
JAMA Neurol
.
2022;
;
79
(
(11)
) :
:1105.
–
1112
.
|