| |
| Med Sci (Paris). 40(12): 979–982. doi: 10.1051/medsci/2024168.L’arginine méthyltransférase PRMT2 est impliquée dans le contrôle de l’inflammation des leucémies aiguës myéloblastiques Camille Sauter,1* Jean-Noël Bastie,1,2 Laurent Delva,1 and Romain Aucagne1 1Inserm UMR 1231, équipe Epi2THM, équipe LabEx LipSTIC, UFR des sciences de santé, Université de Bourgogne
,
Dijon
,
France 2Département d’hématologie clinique, Hôpital universitaire Dijon Bourgogne François-Mitterrand
,
Dijon
,
France MeSH keywords: |
L’arginine méthyltransférase PRMT2
Les enzymes de la famille PRMT (
protein arginine methyltransferase
) sont au nombre de neuf chez les mammifères. Elles modulent la transcription génique en catalysant la méthylation de résidus arginine situés sur les queues des histones, mais elles peuvent aussi catalyser la méthylation de résidus arginine dans d’autres protéines nucléaires ou cytoplasmiques. Les gènes codant certaines de ces méthyltransférases, dont PRMT1, PRMT4 et PRMT5, sont surexprimés dans de nombreux cancers [
1
]. En outre, de multiples études ont montré que l’inhibition de ces enzymes ralentit la progression de différents cancers et hémopathies malignes, incluant les leucémies aiguës myéloblastiques [
2
]. PRMT2 est l’un des membres de cette famille les moins bien caractérisés à ce jour. Néanmoins, il est connu que PRMT2 agit comme coactivateur de la transcription génique en association avec plusieurs récepteurs hormonaux, et qu’elle interagit avec certaines protéines contrôlant l’épissage des transcrits. En outre, le gène codant PRMT2 est exprimé de manière aberrante dans certains cancers du sein et dans les glioblastomes [
3
].
|
PRMT2 chez les patients atteints de leucémie aiguë myéloblastique
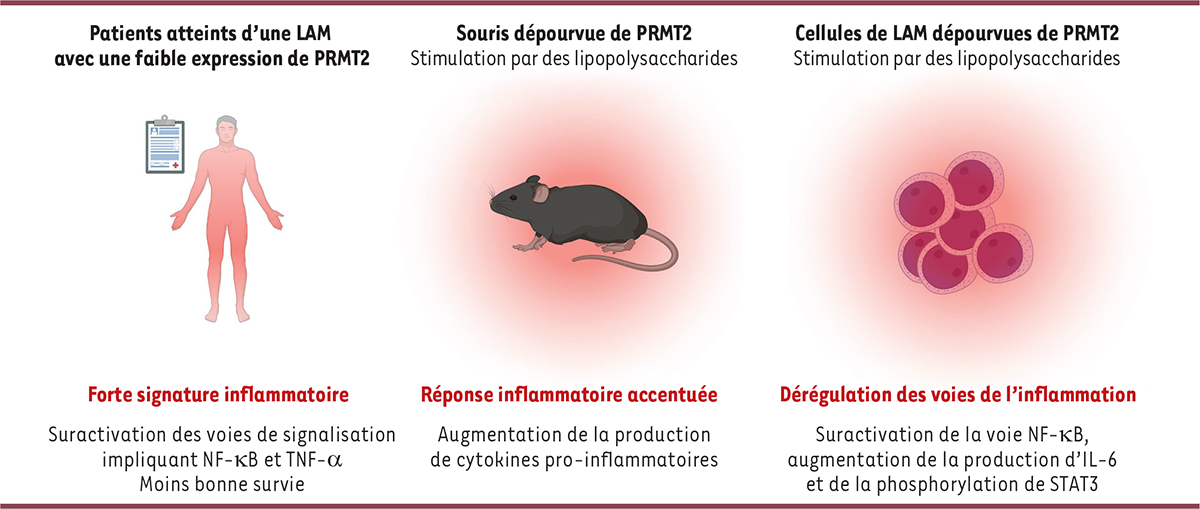
L’expression du gène
PRMT2
est variable chez les patients atteints de leucémie aiguë myéloblastique. Cependant, il apparaît que les patients présentant une faible expression de ce gène (patients dits « à faible PRMT2 »), ont une survie moindre que ceux l’exprimant davantage [
4
]. Chez les premiers a été notée une surexpression des gènes codant des protéines de signalisation liées à l’inflammation, notamment celles de la voie impliquant le facteur de transcription NF-κB (
nuclear factor kappa B
).
En effet, plusieurs gènes codant des protéines directement impliquées dans cette voie de signalisation sont surexprimés lorsque l’expression de
PRMT2
est faible, notamment les gènes
NFKB1, NFKB2, RELA
et
RELB
. L’expression de gènes codant des cytokines pro-inflammatoires, interleukine 6 (IL-6) et TNF-α (
tumor necrosis factor
), est également augmentée chez ces patients [
4
] (
Figure 1
). Il a été montré que la ferritine sérique est dérégulée chez la plupart des patients atteints de leucémie aiguë myéloblastique, et que des concentrations élevées de ferritine dans le sang sont corrélées à l’inflammation et à la chimiorésistance [
5
]. Les résultats obtenus chez les patients « à faible PRMT2 », qui ont un contexte inflammatoire prononcé, corroborent cette hypothèse car ces patients expriment davantage les gènes
FTH1
et
FTL
, codant respectivement les chaînes lourde et légère de la ferritine [
4
].
 | Figure 1
Conséquences de l’absence ou de la faible quantité de l’arginine méthyltransférase PRMT2 dans différents modèles de leucémie aiguë myéloblastique
.
LAM : leucémie aiguë myéloblastique ; PRMT2 :
protein arginine methyltransferase 2
; NF-κB :
nuclear factor kappa B
; TNF-α :
tumor necrosis factor
; IL-6 : interleukine 6 ; STAT3 :
signal transducer and activator of transcription 3
.
|
|
Rôle de PRMT2 dans un modèle murin
En raison du rôle de PRMT2 dans la régulation des voies de signalisation de la leptine, les souris mutantes privées de PRMT2 (souris
Prmt2
-/-
) [
6
] sont plus maigres que les souris témoins [
7
]. Les résultats de l’analyse de l’hématopoïèse chez les souris
Prmt2
-/-
semblent indiquer que PRMT2 ne joue pas un rôle essentiel dans ce processus. En effet, les populations de cellules matures et de cellules progénitrices de la moelle osseuse ne sont pas affectées par l’absence de cette enzyme, et la capacité des cellules progénitrices provenant de souris
Prmt2
-/-
à reconstituer une hématopoïèse après transplantation avec des cellules compétitrices est préservée. Néanmoins, la réponse inflammatoire induite par l’injection de lipopolysaccharides est plus forte chez les souris
Prmt2
-/-
, comme l’atteste la production accrue de TNF-α et IL-6 par les macrophages dérivés de moelle osseuse [
4
] (
Figure 1
). Ce constat indique que PRMT2 est un facteur atténuateur de la réponse inflammatoire.
|
Le lien étroit entre PRMT2 et les voies de l’inflammation dans les leucémies aiguës myéloblastiques
Afin d’évaluer le rôle de PRMT2 dans les leucémies aiguës myéloblastiques, nous avons produit des lignées de cellules leucémiques privées de PRMT2 (
PRMT2
KO
) à partir des cellules HL-60 sensibles aux lipopolysaccharides, en utilisant l’outil d’édition génomique CRISPR-Cas9. L’absence de PRMT2 dans ces cellules n’est pas compensée par une surproduction d’autres enzymes de la même famille, et n’entraîne pas de changement phénotypique ou de leur prolifération. Néanmoins, la comparaison des profils de séquençage des ARN messagers des cellules privées de PRMT2 et des cellules produisant cette protéine montre un enrichissement des signatures géniques liées à l’inflammation en l’absence de PRMT2, concernant notamment la voie de signalisation par le TNF-α et celle impliquant NF-κB (ce que l’on retrouve chez les patients « à faible PRMT2 »), ainsi que la cascade de signalisation JAK/STAT3/IL-6. Afin de confirmer l’implication de PRMT2 dans le contrôle des processus inflammatoires dans les leucémies aiguës myéloblastiques, les lignées cellulaires ont été traitées avec des lipopolysaccharides afin de déclencher une réponse inflammatoire dans ce modèle cellulaire. Comme attendu, nous avons constaté que les cellules HL-60 privées de PRMT2 produisent de plus grandes quantités d’IL-6 que les cellules HL-60 témoins. En raison de la sécrétion accrue d’IL-6 dans le milieu de culture des cellules privées de PRMT2, nous avons également recherché une modification de l’activité de la protéine STAT3 (
signal transducer and activator of transcription 3
), un activateur de la transcription impliqué dans la réponse inflammatoire, et constaté que cette protéine est davantage phosphorylée dans ces cellules. La phosphorylation de STAT3, en favorisant sa translocation dans le noyau cellulaire sous forme de dimère phosphorylé actif, permet son activité transcriptionnelle. Notamment, nous avons constaté une augmentation de l’expression de ses gènes cibles, ce qui a pour effet d’exacerber l’inflammation (
Figure 1
). Il est à noter que lors d’une stimulation par des lipopolysaccharides, les autres voies de signalisation pouvant mener à la phosphorylation de STAT3, telles que les voies impliquant les MAPK (
mitogen-associated protein kinases
), ne sont pas affectées par l’absence de PRMT2 [
4
]. L’augmentation de la production d’IL-6 semble donc seule responsable de la phosphorylation accrue de STAT3 dans les cellules dépourvues de PRMT2. La production accrue d’IL-6 par ces cellules, quant à elle, résulte d’une hausse de l’activité de certains facteurs de la voie NF-κB, notamment d’une recrudescence de la translocation de p65 dans le noyau cellulaire. L’ensemble de ces résultats indique que PRMT2 contrôle l’activation de STAT3 en modulant la production d’IL-6, probablement
via
un contrôle de la voie de signalisation impliquant NF-κB (
Figure 2B
).
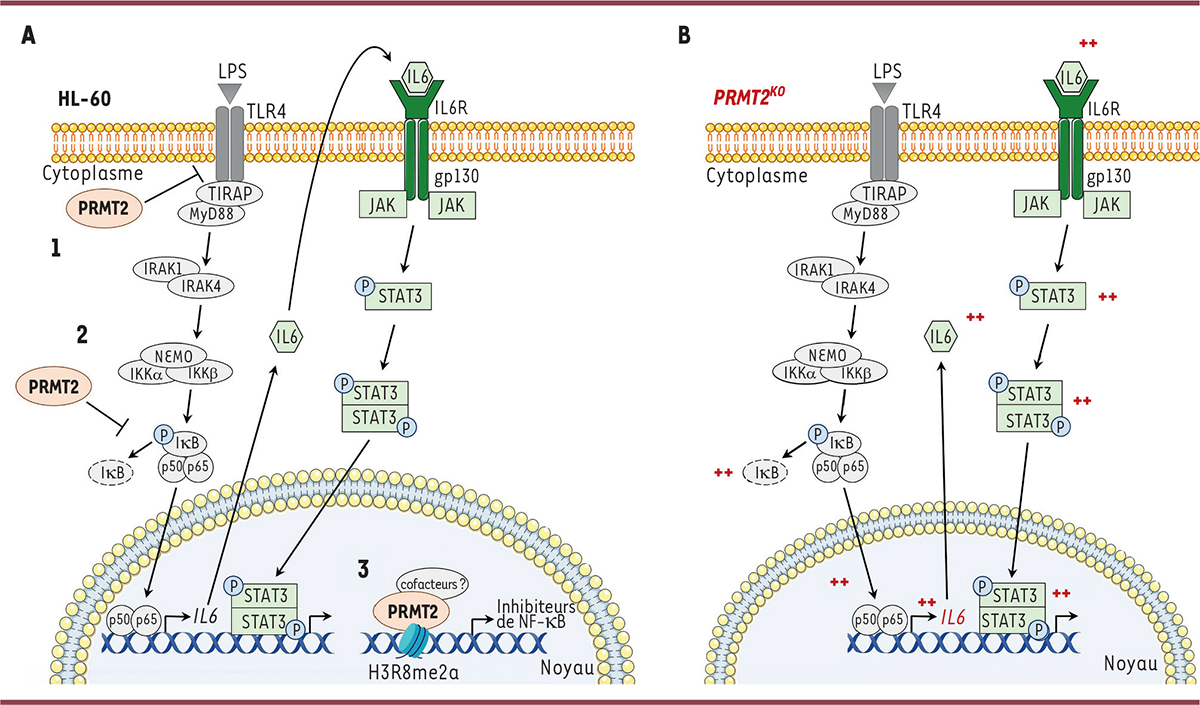
 | Figure 2
A
.
Rôles présumés de PRMT2 dans le contrôle de la voie de signalisation impliquant NF-κB dans les cellules de leucémie aiguë myéloblastique HL-60
.
À la membrane plasmique, PRMT2 pourrait inhiber le récepteur TLR4 par méthylation (1). Dans le cytoplasme, PRMT2 pourrait agir directement sur la voie de signalisation impliquant le facteur de transcription NF-κB (dimère p50/p65) en méthylant un facteur clé de cette cascade de signalisation, empêchant ainsi son activation, ce qui conduit à la séquestration de la protéine p65 dans le cytoplasme (2), à une diminution de la production d’IL-6 par les cellules HL-60, et à une diminution de l’activation de STAT3. Dans le noyau cellulaire, PRMT2 pourrait contrôler la transcription de gènes codant des protéines régulatrices de la voie impliquant NF-κB
via
la méthylation du résidu arginine situé en position 8 de l’histone H3 (H3R8), ou en tant que protéine constitutive de complexes transcriptionnels (3).
B. Dérégulation des voies de l’inflammation en absence de l’arginine méthyltransférase PRMT2 dans les cellules HL-60
.
Les augmentations d’activité de certaines protéines impliquées dans la réponse inflammatoire dans les cellules HL-60 privées de PRMT2 (cellules
PRMT2
KO
) sont indiquées par le signe + (en rouge). LPS : lipopolysaccharides ; TLR4 :
Toll-like receptor 4
; TIRAP :
TIR domain-containing adaptor protein
; MyD88 :
Myeloid differentiation primary response 88
; IRAK :
Interleukin-1 receptor-associated kinase
; NEMO :
NF-κB essential modulator
; IKK :
I-
κ
B kinase
; JAK :
Janus kinase
.
|
|
Hypothèses sur le rôle de PRMT2 dans la voie de signalisation impliquant NF-κB
La méthylation de STAT3 par PRMT2 a déjà été décrite dans l’hypothalamus lors de la stimulation par la leptine [
7
]. Toutefois, nous n’avons pas identifié d’interaction directe entre PRMT2 et STAT3 dans les cellules HL-60. Il est donc peu probable que STAT3 soit un substrat de PRMT2 dans les cellules de leucémie aiguë myéloblastique. Par conséquent, la modulation de l’activité de STAT3 par PRMT2 doit avoir un mécanisme indirect. PRMT2 pourrait méthyler le récepteur des lipopolysaccharides, TLR4 (
Toll-like receptor 4
), comme cela a déjà été montré précédemment [
8
], ou exercer son activité de méthylation sur une des sous-unités fonctionnelles de NF-κB afin d’empêcher l’activation de la cascade de signalisation en aval de ce facteur de transcription. PRMT2 pourrait également contrôler la transcription de gènes codant des protéines régulatrices de la voie NF-κB, soit par la méthylation de résidus arginine situés sur la queue des histones, soit en tant que protéine constitutive de complexes transcriptionnels indépendamment de sa fonction enzymatique. PRMT2 pourrait aussi faire partie de complexes protéiques de signalisation cellulaire, là encore sans y contribuer par sa fonction enzymatique (
Figure 2A
).
|
Nous avons découvert que l’arginine méthyltransférase PRMT2 est un acteur essentiel du contrôle de l’inflammation dans les leucémies aiguës myéloblastiques en analysant des modèles murins et cellulaires dépourvus de cet enzyme. D’autres PRMT sont impliquées dans la modulation de la réponse inflammatoire dans diverses maladies. La majorité des travaux de recherche ont abouti à la conclusion que la méthylation de la sous-unité p65 ou son interaction avec des PRMT augmente la transcription des gènes dépendant de la voie de signalisation impliquant NF-κB [
9
]. Par ailleurs, des travaux récents ont permis d’identifier un sousensemble de patients atteints d’une leucémie aiguë myéloblastique, adultes ou enfants, chez lesquels des gènes pro-inflammatoires étaient fortement exprimés dans leurs cellules leucémiques. Le rôle central de la réponse inflammatoire dans la leucémogenèse incite à poursuivre l’évaluation de l’efficacité de molécules anti-inflammatoires, telles que la dexaméthasone, dans le traitement des leucémies aiguës myéloblastiques [
10
].
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article
.
|
1.
Jarrold
J
,
Davies
CC.
PRMTs and arginine methylation: Cancer’s best-kept secret?
Trends Mol Med
.
2019;
;
25
:
:993.
–
1009
.
2.
Sauter
C
,
Simonet
J
,
Guidez
F
,
et al.
.
Protein arginine methyltransferases as therapeutic targets in hematological malignancies.
.
Cancers
.
2022;
;
14
:
:5443.
.
3.
Cura
V
,
Cavarelli
J.
Structure, activity and function of the PRMT2 protein arginine methyltransferase.
.
Life
.
2021;
;
11
:
:1263.
.
4.
Sauter
C
,
Morin
T
,
Guidez
F
,
et al.
.
Protein arginine methyltransferase 2 controls inflammatory signaling in acute myeloid leukemia.
.
Commun Biol
.
2024;
;
7
:
:753.
.
5.
Bertoli
S
,
Paubelle
E
,
Bérard
E
,
et al.
.
Ferritin heavy/light chain (FTH1/FTL) expression, serum ferritin levels, and their functional as well as prognostic roles in acute myeloid leukemia.
.
Eur J Haematol
.
2019;
;
102
:
:131.
–
42
.
6.
Yoshimoto
T
,
Boehm
M
,
Olive
M
,
et al.
.
The arginine methyltransferase PRMT2 binds RB and regulates E2F function.
.
Exp Cell Res
.
2006;
;
312
:
:2040.
–
53
.
7.
Iwasaki
H
,
Kovacic
JC
,
Olive
M
,
et al.
.
Disruption of protein arginine N-methyltransferase 2 regulates leptin-signaling and produces leanness
in vivo
through loss of STAT3 methylation
.
.
Circ Res
.
2010;
;
107
:
:992.
–
1001
.
8.
Wang
J
,
Hua
H
,
Wang
F
,
et al.
.
Arginine methylation by PRMT2 promotes IFN-β production through TLR4/IRF3 signaling pathway.
.
Mol Immunol
.
2021;
;
139
:
:202.
–
10
.
9.
Wei
H
,
Wang
B
,
Miyagi
M
,
et al.
.
PRMT5 dimethylates R30 of the p65 subunit to activate NF-κB.
.
Proc Natl Acad Sci USA
.
2013;
;
110
:
:13516.
–
21
.
10.
Bertoli
S
,
Picard
M
,
Bérard
E
,
et al.
.
Dexamethasone in hyperleukocytic acute myeloid leukemia.
.
Haematologica
.
2018;
;
103
:
:988.
–
98
.
|