Ces dernières années ont été témoin d’un réel progrès médical dans le traitement de certains cancers grâce à l’utilisation de l’immunothérapie. Contrairement aux traitements traditionnels, l’immunothérapie ne cible pas les cellules cancéreuses elles-mêmes, mais active ou renforce le système immunitaire afin qu’il les combatte plus efficacement. Certaines de ces thérapies visent à bloquer les signaux de régulation négatifs que les cellules cancéreuses envoient aux lymphocytes T [ 1 ]. C’est le cas des inhibiteurs de points de contrôle immunitaire, ciblant par exemple les molécules inhibitrices CTLA-4 ou PD-1, qui libèrent l’action antitumorale des lymphocytes T en bloquant les interactions de ces récepteurs inhibiteurs avec leurs ligands. Les inhibiteurs de points de contrôle immunitaire, seuls ou en combinaison avec d’autres traitements, sont utilisés contre différents types de cancer, parmi lesquels le mélanome, le cancer du poumon non à petites cellules, ou le carcinome rénal [ 1 ]. La réponse antitumorale à ces inhibiteurs est souvent durable. Néanmoins, ces thérapies ne profitent qu’à une minorité de patients [ 1 ].
En 2013, des études pionnières ont permis d’identifier le rôle du microbiote intestinal dans l’efficacité des agents anticancéreux chez la souris [ 2 ] ( → ).
(→) Voir la Synthèse de M. Vétizou et al., m/s n° 11, novembre 2016, page 974
Ces découvertes ont été suivies par des études chez les patients, démontrant plus particulièrement le lien entre le microbiote et l’efficacité des inhibiteurs de points de contrôle immunitaire [ 3 ] ( → ).
(→) Voir la Nouvelle de M. Pronost et al., m/s n° 11, novembre 2022, page 963
De nombreux travaux ont caractérisé les différentes espèces de bactéries intestinales dont la présence favorise, voire prédit, la réponse antitumorale à ces inhibiteurs chez la souris ou chez les patients, comme par exemple Bifidobacterium pseudolongum [ 4 ].
Des stratégies thérapeutiques modulant le microbiote en combinaison avec les inhibiteurs de points de contrôle immunitaire sont actuellement explorées pour accroître l’efficacité de l’immunothérapie. À titre d’exemple, la résistance aux anticorps anti-PD-1 a pu être surmontée chez des patients atteints de mélanome métastatique réfractaire grâce à la transplantation de microbiote fécal provenant de donneurs sensibles à ces anticorps [ 5 ]. Plus largement, puisque l’alimentation influence la composition et la fonction de la flore intestinale, l’identification de suppléments alimentaires favorisant un microbiote intestinal propice à une meilleure réponse aux traitements anti-cancéreux pourrait offrir une stratégie simple pour augmenter la survie des patients atteints de cancer.
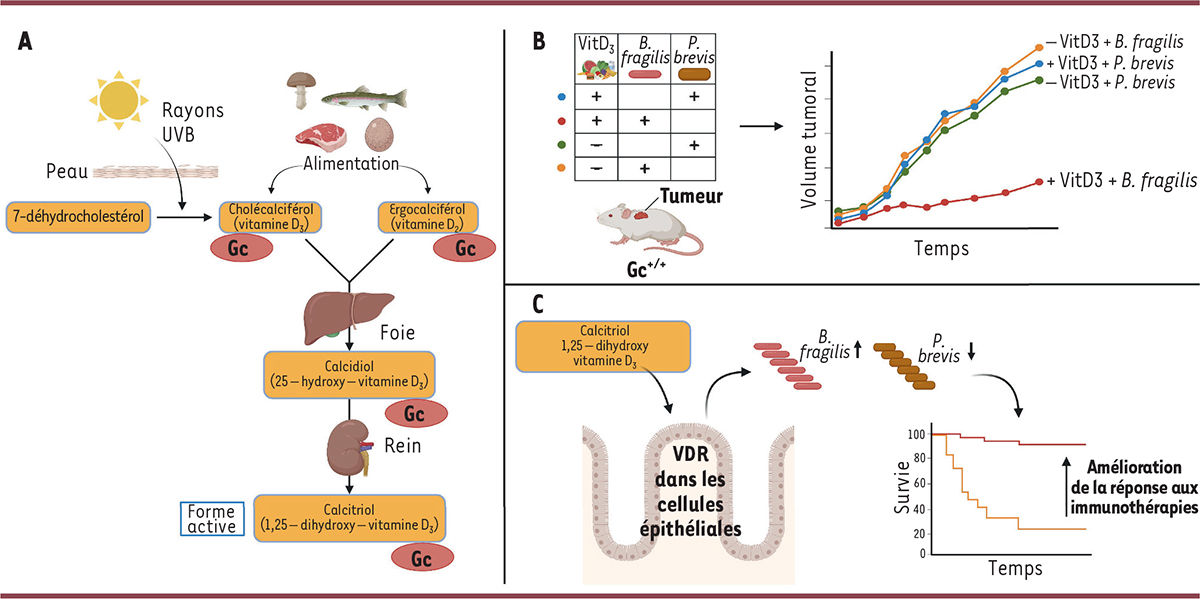
La vitamine D, ou calciférol, est une vitamine liposoluble indispensable à l’absorption intestinale du calcium alimentaire ( Figure 1A ). Elle participe à l’homéostasie du calcium et du phosphore, à la minéralisation de certains tissus (os, cartilage, dents) pendant et après la croissance [ 6 ] ( → ), ainsi qu’au fonctionnement de notre système immunitaire. La vitamine D influe sur la diversité du microbiote intestinal murin et humain [ 7 ]. Elle existe sous deux formes : la vitamine D 3 (cholécalciférol), majoritairement synthétisée dans la peau sous l’effet des rayons ultraviolets, et la vitamine D 2 (ergocalciférol), apportée par l’alimentation ( Figure 1A ). Les vitamines D 2 et D 3 sont converties par différentes enzymes du foie en un précurseur (25-hydroxycholécalciférol ou 25-(OH)D 3 ), qui est ensuite hydroxylé dans le rein pour donner la forme active et circulante de la vitamine D : le 1,25-dihydroxycholécalciférol (1,25-(OH) 2 D 3 ) ou calcitriol ( Figure 1A ). La disponibilité de cette forme active est contrôlée par la protéine plasmatique de liaison à la vitamine D ( vitamin D-binding protein ), également connue sous le nom de globuline Gc ( group-specific component ), qui se lie à la vitamine D et à ses métabolites [ 8 ] ( Figure 1A ).
(→) Voir la Synthèse de E. Tissandié et al., m/s n° 12, décembre 2006, page 1095
| Figure 1
Vitamine D
3
, microbiote et impact sur la réponse aux immunothérapies du cancer dirigées contre les points de contrôle immunitaire. A
.
Schéma de la synthèse de la vitamine D
3
.
B
.
La bactérie
Bacteroides fragilis
ralentit la croissance tumorale chez la souris, à condition que son alimentation soit supplémentée en vitamine D
3
(VitD
3
).
C
.
Schéma récapitulatif : la vitamine D
3
, en agissant sur les cellules épithéliales intestinales
via
son récepteur (VDR), remodèle le microbiote intestinal, ce qui ralentit la croissance tumorale chez la souris et pourrait améliorer la survie des patients ayant un cancer traité par immunothérapie.
|
Dans un article récent, Giampazolias et al . [ 9 ] rapportent que la vitamine D peut agir sur le microbiome et l’immunité antitumorale chez la souris et chez l’homme. En particulier, les résultats de leurs travaux de recherche chez la souris montrent que l’augmentation de la disponibilité de la vitamine D, obtenue par la suppression génétique de la globuline Gc ou par une supplémentation alimentaire en vitamine D, modifie le microbiote intestinal, ce qui renforce l’immunité antitumorale. Chez l’homme, ces auteurs montrent que des niveaux élevés de vitamine D sont corrélés à une plus faible incidence de cancer.
Chez des souris porteuses de tumeurs et déficientes en globuline Gc (souris mutantes de génotype Gc –/– ), les auteurs ont constaté un retard de la croissance tumorale ainsi qu’une meilleure réponse antitumorale aux inhibiteurs de points de contrôle immunitaire. Cette dernière, dépendante de l’immunité innée et adaptative, est liée à une différence de microbiote entre les souris Gc –/– et Gc +/+ , puisqu’elle est transférable à des souris Gc +/+ élevées dans la même cage ou ayant reçu les fèces de souris Gc –/– . Partant du constat que les souris Gc –/– ont de faibles taux sanguins de vitamine D du fait de sa redistribution vers les tissus en l’absence de la protéine Gc, les auteurs ont étudié le rôle de cette vitamine dans la croissance tumorale. Lorsqu’elles sont soumises à un régime alimentaire déficient en vitamine D 3 , les souris Gc –/– perdent complètement leur capacité accrue à résister aux tumeurs et à transmettre cette résistance à des souris Gc +/+ par transfert fécal. Au contraire, une supplémentation alimentaire en vitamine D 3 chez des souris Gc +/+ entraîne une diminution « microbiote-dépendante » de la croissance tumorale. L’ensemble des résultats obtenus montre que des niveaux élevés de vitamine D favorisent un microbiote bénéfique à l’immunité anticancéreuse chez la souris.
Les auteurs ont ensuite étudié les mécanismes sous-jacents à l’activité antitumorale de la vitamine D. Ils ont d’abord établi que l’expression du récepteur de la vitamine D − un facteur de transcription responsable des effets biologiques de cette vitamine − par les cellules épithéliales intestinales est essentielle pour promouvoir la résistance à la croissance tumorale et pour le développement d’une flore intestinale favorable. Grâce à des études métagénomiques des matières fécales de souris, ils ont découvert que la bactérie Bacteroides fragilis , déjà connue pour ses effets bénéfiques lors d’un traitement par inhibiteur de point de contrôle immunitaire [ 10 ], est plus abondante dans les matières fécales des souris présentant des taux sanguins élevés de vitamine D, au détriment de la bactérie Prevotella brevis . L’administration orale de B. fragilis suffit à induire une résistance accrue aux tumeurs chez les souris Gc +/+ , à condition qu’elles ne soient pas privées de vitamine D ( Figure 1B ).
La modulation du microbiote intestinal par la vitamine D et son récepteur chez l’homme et la souris a fait l’objet de nombreuses études, aux résultats contrastés quant aux espèces bactériennes affectées par une supplémentation en vitamine D, et qui n’ont pas encore permis de comprendre le mécanisme de l’expansion ou au contraire de la régression des espèces concernées [ 7 ]. Dans l’étude de Giampazolias et al . [ 9 ], le lien entre l’expression du récepteur de la vitamine D dans les cellules épithéliales intestinales et l’expansion de B. fragilis chez la souris reste également à élucider.
De nombreuses études ont tenté de corréler le polymorphisme des gènes liés au métabolisme de la vitamine D (synthèse, biodisponibilité, signalisation) ou les taux sanguins de vitamine D, libre ou totale, avec le risque de cancer ou la réponse aux traitements anticancéreux chez l’homme [ 11 ]. Cependant, ces études ont produit des résultats contradictoires. Pour contourner les limitations inhérentes aux données recueillies (par exemple, l’impact de l’alimentation ou de l’exposition au soleil), les auteurs ont utilisé une signature transcriptomique des gènes cibles du récepteur de la vitamine D comme substitut de la biodisponibilité et de l’activité de la vitamine D dans les tissus. Ils montrent que cette signature, composée de 237 gènes, est positivement corrélée à la survie de patients atteints de cancer du foie, du sein, de la peau et de la prostate, à un stade moins avancé de leur maladie, et à une meilleure réponse des patients aux traitements par inhibiteurs de points de contrôle immunitaire. Ainsi, une faible biodisponibilité tissulaire de vitamine D est associée à une résistance à ce traitement et à une survie plus faible des patients.
Les auteurs suggèrent que la disponibilité de la vitamine D oriente le microbiote intestinal vers une flore favorisant l’immunité antitumorale et une réponse plus efficace aux inhibiteurs de points de contrôle immunitaire chez la souris, et que la bioactivité de cette vitamine est associée à une évolution favorable de la maladie cancéreuse chez l’homme. Ils envisagent donc la supplémentation en vitamine D comme une option thérapeutique potentielle ( Figure 1C ). Cependant, la littérature médicale sur l’efficacité de la supplémentation en vitamine D dans la réponse antitumorale chez les patients, bien qu’abondante, est contradictoire [ 12 ]. La vitamine D joue de nombreux rôles essentiels pour notre santé, qu’il s’agisse de son rôle dans l’homéostasie phospho-calcique, dans la minéralisation osseuse, ou encore dans le fonctionnement du système immunitaire et l’induction de la tolérance immunitaire, son récepteur étant exprimé par de nombreuses cellules de l’immunité innée et adaptative [ 13 ]. La vitamine D est également impliquée dans le maintien de l’intégrité de la barrière épithéliale intestinale. Cette pléiotropie explique en partie la difficulté de conclure à la spécificité d’un bénéfice thérapeutique de la supplémentation en vitamine D en cancérologie, en vaccinologie et dans les maladies inflammatoires chroniques de l’intestin [ 14 ]. Ainsi, d’autres travaux de recherche, tant dans des modèles animaux précliniques que chez l’homme, sont nécessaires pour clarifier les liens entre la disponibilité de la vitamine D, le microbiote et les réponses immunitaires immunogénique et tolérogénique. Ces études devraient permettre de mieux comprendre comment mobiliser le microbiote intestinal par la supplémentation en vitamine D afin de maximiser l’effet bénéfique de nouvelles thérapies.