| |
| Med Sci (Paris). 40(12): 914–924. doi: 10.1051/medsci/2024181.Les maladies génétiques de la machinerie épigénétique Maud de Dieuleveult1,2* and Guillaume Velasco3** 1Université Paris Cité, Inserm UMR1163, Institut Imagine
,
Paris
,
France 2Banque nationale de données maladies rares, DSI-I&D, APHP
,
Paris
,
France 3Université Paris Cité, CNRS UMR7216, Épigénétique et destin cellulaire
,
Paris
,
France |
Vignette (© Biorender.com).
Le développement de notre organisme et de ses grandes fonctions physiologiques dépend de l’intégrité de deux types d’instructions étroitement liées : l’une reposant sur la séquence du génome et l’autre sur sa structure sous forme de chromatine, assemblage de protéines histones et d’ADN. Alors que l’information génétique codée par la séquence d’ADN est identique dans la majorité des types cellulaires de notre organisme, l’information épigénétique est, quant à elle, variable. Ceci détermine les phénotypes cellulaires et leurs fonctions en régulant l’expression du génome dans le temps et l’espace. Les bases moléculaires de cette information épigénétique, ou épigénome, reposent principalement sur des modifications chimiques de la chromatine ciblant l’ADN ou les histones, définissant ainsi un « code » ou un programme épigénétique [
1
].
L’écriture, l’effacement, le remaniement ainsi que la lecture de l’épigénome dépendent de l’activité de la machinerie épigénéti que composée d’un ensemble de protéines ou « épifacteurs » [
2
] codés par des gènes nommés dans la littérature « épigènes » [
3
], « gènes EM (
epigenetic machinery
) [
4
] ou encore « gènes épigénétiques » [
5
]. C es facteurs possèdent, pour la plupart, des activités enzymatiques qui sont essentielles à l’établissement et au maintien des programmes d’expression génique spécifiques au fonctionnement et à l’identité cellulaire.
Des modifications de l’épigénome, appelées « épimutations », c’est-à-dire des gains ou des pertes transmissibles de la méthylation de l’ADN (ajout d’un groupement méthyle sur le carbone en position 5 de la cytosine produisant la 5-méthylcytosine ou 5mC) ou d’autres modifications chromatiniennes (modifications post-traductionnelles des protéines histones), sont des signatures pathologiques décrites dans de nombreuses maladies. Le cas des cancers est le plus documenté [
6
]. Si l’implication de ces épimutations dans le développement de cancers est maintenant établie [
7
,
8
]
1,
, leur rôle précis dans l’émergence et le développement des maladies en général reste encore à définir. Cependant, la découverte de maladies génétiques impliquant des processus épigénétiques, comme les maladies de l’empreinte parentale
2
ou les maladies génétiques de la machinerie épigénétique (MGME) faisant l’objet de cette revue, met en lumière la composante épigénétique dans l’étiologie de maladies souvent rares.
Depuis une quinzaine d’années, la démocratisation et l’utilisation en routine des techniques de séquençage à haut débit en diagnostic clinique ont accéléré l’identification de nouvelles MGME, une classe de maladies monogéniques rares, causées par des mutations génétiques altérant la fonction d’épifacteurs. L’étude de ces maladies et des mécanismes moléculaires mis en jeu offre donc une opportunité unique de mieux comprendre les relations entre altérations épigénétiques et maladies humaines, bénéficiant à la recherche clinique et à la recherche fondamentale. |
La définition d’épigène : considération et classification
Afin de mieux comprendre le fonctionnement de la machinerie épigénétique, la nécessité de la définir, de recenser ses acteurs et de décrire leurs fonctions est une première étape importante. Parmi les quelques 20 000 gènes du génome humain
3,
, les données de la littérature estiment que 1 à 4 % sont des gènes codant des acteurs de la machinerie épigénétique ou épifacteurs [
2
,
4
,
9
]. La variabilité du nombre d’épigènes recensés repose essentiellement sur la définition des mécanismes épigénétiques
4
et leurs considérations fonctionnelles, à savoir si cette variabilité englobe les modifications de l’ADN et des histones et s’étend aux constituants de la chromatine, y compris les ARN non codants et leurs modifications.
Si les frontières définissant formellement la machinerie épigénétique peuvent être floues, son cœur reste constant. Il existe en effet un consensus sur les quatre grandes catégories d’épifacteurs du cœur de cette machinerie : 1) les
écrivains
, qui déposent les marques chimiques sur les histones et l’ADN ; 2) les
effaceurs
, qui enlèvent ces marques ; 3) les
lecteurs
, qui se lient à ces modifications ; et 4) les
facteurs de remodelage de la chromatine
, qui régulent l’organisation des nucléosomes, unités fonctionnelles de la chromatine (
Figure 1A
). À ces quatre catégories peut être intégrée une série de cofacteurs protéiques, comme les protéines histones et leurs variants, des facteurs de transcription, et des ARN non-codants.
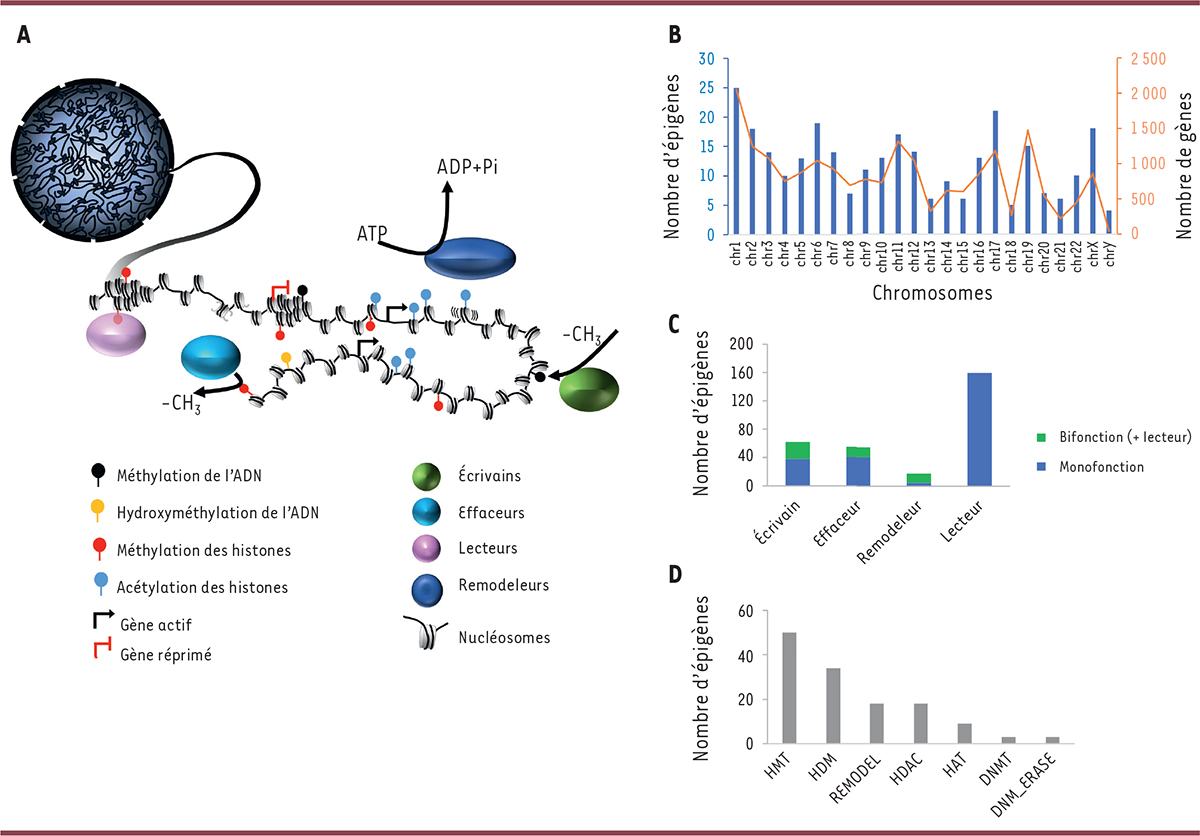
 | Figure 1
Le génome et l’épigénome. A
.
Représentation du génome nucléaire humain structuré sous forme de chromatine, dont l’unité fonctionnelle est le nucléosome, assemblage d’ADN et de protéines histones. Des modifications chimiques de l’ADN (méthylation 5mC et hydroxyméthylation, qui est une forme oxydée de la 5mC) et des histones (exemples : méthylation, acétylation) modifient la structure de la chromatine et affectent l’expression des gènes. La présence de ces modifications chimiques, ou marques épigénétiques, qui constituent l’épigénome, dépendent d’activités enzymatiques de protéines appelées « écrivains » ou « effaceurs », selon leur capacité à ajouter ou enlever une marque. Ces marques sont reconnues par des protéines appelées « lecteurs » capables de recruter à leur tour d’autres facteurs épigénétiques. La structure chromatinienne peut aussi être façonnée par des facteurs de remodelage, dont l’activité dépend de l’énergie fournie par les molécules d’ATP. Écrivains, effaceurs, lecteurs et remodeleurs constituent le cœur de la machinerie épigénétique (Contribution graphique Laure Ferry, UMR7216).
B
.
Graphiques présentant la localisation chromosomique des 295 épigènes codant les épifacteurs constituant le cœur de la machinerie épigénétique.
C
.
Histogramme présentant la distribution des 295 épigènes selon leur catégorie fonctionnelle (monofonction en bleu, ou bifonction en vert). La classe des lecteurs est majoritaire. Certains écrivains, effaceurs et lecteurs possèdent également une fonction de lecteur (Bifonction).
D
.
Parmi les épifacteurs, la classe des HMT (histone méthyltransférase) est la plus représentée, suivie par celle des HDM (histone déméthylase), REMODEL (facteurs de remodelage), HDAC (histone déacétylase), HAT (histone acétyltransférase), DNMT (ADN méthyltranferase), et DNM_ERASE (ADN déméthylase).
|
En conséquence, la définition d’épigènes en tant que gènes codant des protéines qui modulent l’épigénome d’une cellule a été proposée en 2023, et comprend environ 900 épifacteurs [
2
]. Ces derniers se répartissent en 17 familles : 1) les écrivains des histones, 2) les effaceurs des histones, 3) les lecteurs des histones, 4) les remodeleurs de la chromatine, 5) les chaperons des histones, 6) les protéines histones, 7) les modificateurs de l’ADN, 8) les modificateurs des ARN, 9) les protéines du groupe polycomb, 10) les facteurs de transcription, 11) les cofacteurs des écrivains des histones, 12) les cofacteurs des effaceurs des histones, 13) les cofacteurs des lecteurs des histones, 14) les cofacteurs des remodeleurs de la chromatine, 15) les cofacteurs des chaperons d’histones, 16) les cofacteurs des modificateurs de l’ADN, et 17) les cofacteurs des modificateurs des ARN [
3
]. La base de données EpiFactors (
https://epifactors.autosome.org/
) fournit des informations sur les domaines fonctionnels des épifacteurs, leurs fonctions, leurs substrats et leurs interactions en complexes macromoléculaires. Plus d’une centaine de longs ARN non-codants impliqués dans des régulations épigénétiques y sont également référencés. La base Epifactors repose sur le croisement de plusieurs ressources incluant des bases de données ciblant les histones, les remodeleurs de la chromatine, la base Uniprot (
https://www.uniprot.org
) et des données de la littérature. Les fonctions d’épifacteurs les plus représentées sont celles d’écrivains de modifications d’histones, des remodeleurs de la chromatine et des lecteurs de modifications des histones. L’acétylation et la méthylation des histones sont les modifications les plus répertoriées. Les domaines protéiques PHD (
plant homeo domain
) et bromodomaine pour les lecteurs, et SET (
Su(var)3-9, enhancer-of-zeste and Trithorax
) pour les écrivains des marques d’histones sont les plus représentés au sein des épifacteurs.
Sur la base des critères stricts de présence de domaines enzymatiques fonctionnels responsables des modifications chimiques de la chromatine et/ou des domaines capables de lier ces modifications, Boukas
et al
. ont identifié 295 épifacteurs qui constituent le cœur de la machinerie épigénétique [
4
] (
http://www.epigenetic-machinery.org/
) (
Figure 1B
). Parmi ces 295 épigènes, dont la localisation ne semble pas être enrichie sur un chromosome en particulier, une majorité est associée à la machinerie relative aux histones et une petite fraction est constituée de remodeleurs ou de composants de la machinerie de méthylation de l’ADN. La catégorie des lecteurs constitue le groupe le plus important (211) et celle des remodeleurs le plus petit (18). Les groupes des écrivains et des effaceurs sont de tailles comparables (respectivement 62 et 55) (
Figure 1C, D
). Notons que les trois catégories enzymatiques (écrivains, effaceurs et remodeleurs) s’excluent mutuellement. En revanche, un sous-groupe de 51 épigènes codent des protéines qui présentent à la fois un domaine enzymatique (écrivain, effaceur ou remodeleur) et un domaine de lecteur, suggérant que ces facteurs possèdent une double fonction épigénétique. En général, les écrivains à double fonction ont tendance à catalyser l’ajout de la même marque que celle qu’ils lisent.
|
Les MGME : une classe à part de maladies génétiques rares
Les maladies rares (MR) sont des maladies qui touchent moins de 1 personne sur 2 000 en Europe, et plus de 5 000 MR ont été recensées [
10
]. Soixante-dix % des MR sont d’origine génétique et concernent plus de 30 millions de personnes en Europe (Eurordis). Dans le monde, ce chiffre atteint plus de 300 millions de personnes atteintes.
Les MGME, regroupant les appellations de « chromatinopathies » ou de « maladies rares d’origine épigénétique » (RDEO) [
11
] sont des maladies génétiques rares (
Figure 2A
) altérant les fonctions, de la machinerie épigénétique et entraînant des altérations de l’épigénome [
12
]. Le recensement, au début des années 2000 [
13
], d’une dizaine de ces maladies, appelées « maladies de la chromatine », comprenant, entre autres, les syndromes ATR-X (
alpha-thalassemia mental retardation X-linked syndrome ;
ORPHA:847)
5
, ICF (
immunodeficiency, centromere instability and facial anomalies syndrome ;
ORPHA:2268), Rett (ORPHA:778), Rubinstein-Taybi (ORPHA:783) et Coffin-Lowry (ORPHA:192), et impliquant, respectivement, les épifacteurs ATRX (remodeleur), DNMT3B (
DNA methyltransferase 3 Beta
; écrivain de la méthylation de l’ADN), MECP2
(methyl-CpG binding protein 2
; lecteur de la méthylation de l’ADN), CBP (
CREB binding protein
; écrivain de l’acétylation des histones) et RSK2 (
ribosomal protein S6 kinase A3
; écrivain de la phosphorylation des histones), a rapidement suscité l’intérêt de la communauté scientifique, en particulier la communauté impliquée dans l’épigénétique. En effet, l’étude de ces maladies et de leurs mécanismes moléculaires peut nous renseigner sur le lien de causalité entre l’information épigénétique et l’émergence de phénotypes chez l’homme.
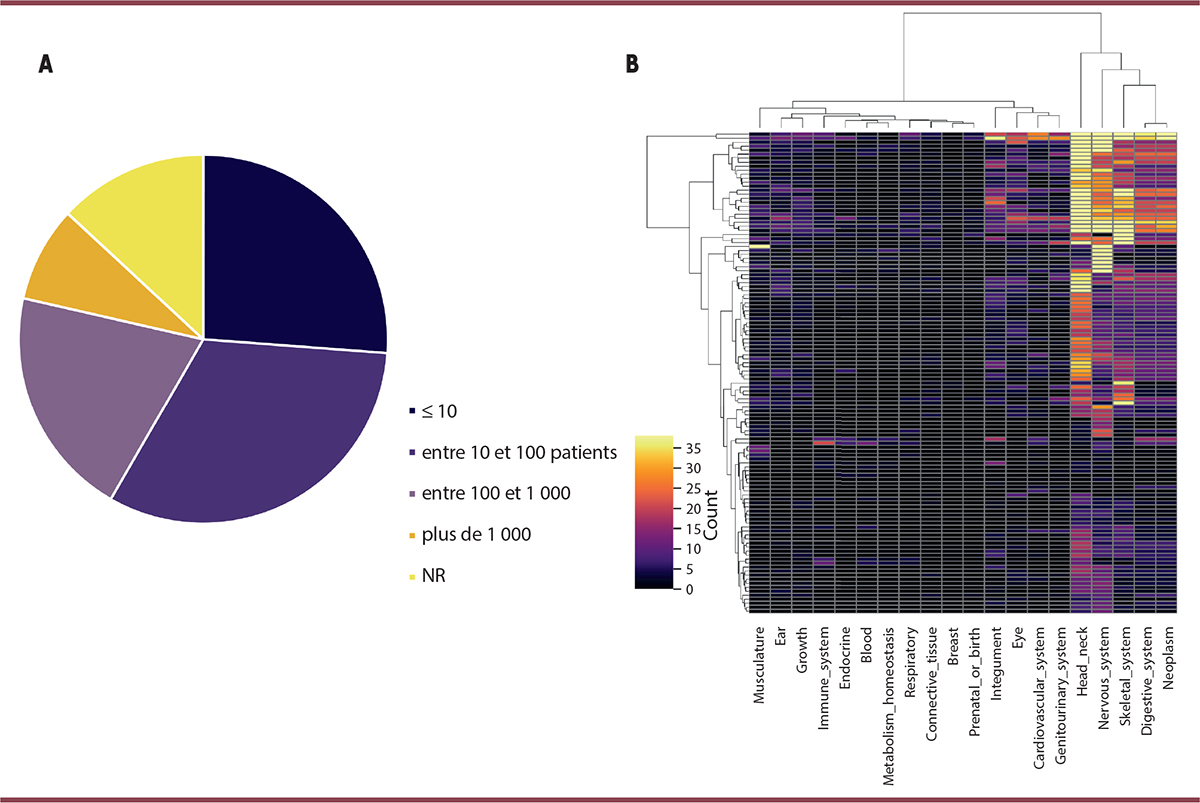
 | Figure 2
Données cliniques françaises des MGME. A
.
Nombre de MGME en France selon les effectifs disponibles de la Banque nationale de données maladies rares (données de novembre 2023).
B
. Heatmap
représentant la distribution des phénotypes pour 120 MGME (d’après la base de données MONDO). Le système nerveux central, les malformations de la face et des anomalies du squelette sont les signes cliniques les plus fréquents. (Contribution bio-informatique de Fabien Maury, Institut Imagine).
|
Tableau I.
| Code ORPHA |
Description de la maladie |
| ORPHA:847 |
https://www.orpha.net/fr/disease/detail/847
|
|
| ORPHA:2268 |
https://www.orpha.net/fr/disease/detail/2268
|
|
| ORPHA:778 |
https://www.orpha.net/fr/disease/detail/778
|
|
| ORPHA:783 |
https://www.orpha.net/fr/disease/detail/783
|
|
| ORPHA:192 |
https://www.orpha.net/fr/disease/detail/192
|
|
| ORPHA:3447 |
https://www.orpha.net/fr/disease/detail/3447
|
|
| ORPHA:659396 |
https://www.orpha.net/fr/disease/detail/659396
|
|
| ORPHA:659463 |
https://www.orpha.net/fr/disease/detail/659463
|
|
| ORPHA:2322 |
https://www.orpha.net/fr/disease/detail/2322
|
|
| ORPHA:821 |
https://www.orpha.net/fr/disease/detail/821
|
|
| ORPHA:404443 |
https://www.orpha.net/fr/disease/detail/404443
|
|
| ORPHA:658595 |
https://www.orpha.net/fr/disease/detail/658595
|
|
| ORPHA:97340 |
https://www.orpha.net/fr/disease/detail/97340
|
|
| ORPHA:456318 |
https://www.orpha.net/fr/disease/detail/456318
|
|
| ORPHA:314404 |
https://www.orpha.net/fr/disease/detail/314404
|
Correspondance des codes ORPHA et des liens décrivant la maladie.
|
Les données actuelles de la littérature font état de plus de 80 MGME, pour un peu plus de 70 épigènes mis en cause. Ce chiffre peut être étendu à environ 180 maladies impliquant 148 gènes, en considérant la définition élargie des épigènes que nous avons précédemment mentionnée [
3
]. Sur le plan clinique, ces maladies présentent des convergences évidentes de symptômes : des anomalies du développement, un retard ou une avance staturale, ainsi qu’une déficience intellectuelle. Plus de 80 % des patients atteints de MGME présentent une déficience intellectuelle et environ 70 % des anomalies de croissance [
4
,
12
,
14
] (
Figure 2B
). Cela souligne donc le rôle essentiel de la machinerie épigénétique dans l’étiologie des déficiences intellectuelles et des anomalies du développement [
15
,
16
]. Dans une étude récente, 130 épigènes ont été mis en cause dans les maladies neurodéveloppementales [
9
], avec une surreprésentation des histones méthyltransférases (HMT) et des histones acétyltransférases. Ces épifacteurs montrent une convergence fonctionnelle révélée par leur appartenance commune à de larges complexes protéiques, tels que COMPASS (
complex proteins associated with Set1
), PRC2 (
polycomb repressive complex 2
), NuRD (
nucleosome remodeling and deacetylase
) et BAF (
Brg/Brahma-associated factors
) [
9
]. Ces données démontrent un lien étroit entre convergence fonctionnelle des épifacteurs et convergence phénotypique des MGME. Le fait qu’aucun variant pathogène n’ait encore pu être identifié pour certains épigènes peut s’expliquer par la difficulté de leur identification par séquençage et interprétation ainsi que par l’intolérance à leur perte de fonction dans le développement précoce.
Ces maladies présentent également un spectre large d’expressions phénotypiques comparativement aux autres maladies d’origine génétique [
12
] (
Figure 2B
). En plus de la déficience intellectuelle et des anomalies de croissance, d’autres manifestations cliniques communes ont été décrites : des dysmorphies faciales, des anomalies cardiaques, des dysmorphies squelettiques, des anomalies du développement, une immunodéficience et une prédisposition à certains cancers. Cette prédisposition aux cancers ne semble pas être la règle pour toutes les MGME et concerne un peu moins de 40 % d’entre elles [
17
]. Cependant, à la lumière de l’impact environnemental
6
et de celui du vieillissement sur l’épigénome, des études longitudinales sont nécessaires pour analyser plus précisément la relation entre MGME et émergence de cancers (
Figure 3
).
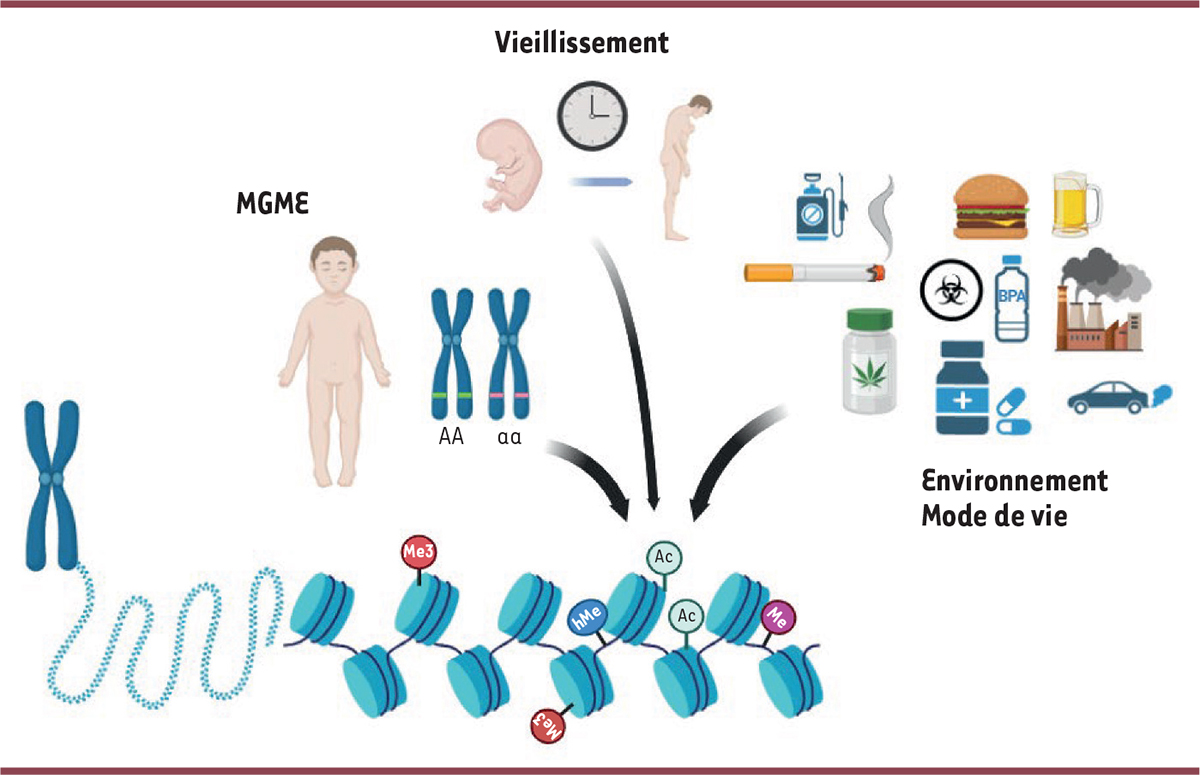
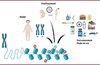 | Figure 3
Les causes majeures d’altérations de l’épigénome
.
Trois causes majeures peuvent modifier profondément l’épigénome au cours du développement et de la vie des individus : la présence d’un variant qui peut être pathogène (comme c’est le cas des MGME), le vieillissement, et les facteurs environnementaux (pollutions, traitements, alcool, tabac, régimes alimentaires, pesticides, etc. (Figure créée avec BioRender.com).
|
|
Épigènes et maladies : l’importance de la dose
Le développement des techniques de séquençage et leur utilisation systématique en diagnostic ont permis d’accroître nos connaissances sur les MGME et leurs caractéristiques singulières au sein des maladies génétiques, tant au niveau des manifestations cliniques qu’au niveau de leur mode de transmission. Alors que 80 % des maladies génétiques affectant des activités enzymatiques sont héréditaires à transmission récessive [
18
], les MGME sont en grande majorité autosomales à transmission dominante, avec des mutations qui apparaissent
de novo
, à l’origine d’une haploinsuffisance, ou d’un gain de fonction dans de rares cas [
14
]. Les machineries enzymatiques les plus affectées dans les MGME sont les histones méthyltransférases (HMT) (35 %) et les remodeleurs (22 %). D’un point de vue fonctionnel, la classe des lecteurs (75 %), avec une très large contribution des lecteurs d’histones (65 %), puis celle des écrivains (34 %), sont les plus représentées au sein des MGME [
3
,
11
].
En 2019, Boukas
et al
. se sont intéressés à l’importance du rôle des épigènes en santé, en analysant la tolérance des 295 épigènes aux variations fonctionnelles et leur expression dans différents tissus [
19
–
21
]. Pour cela, ils ont utilisé la base de données d’exomes ExAC [
22
] et le score pLI (
probability of loss of function intolerance
), qui permet d’identifier les variants génétiques potentiellement responsables de maladies par haploinsuffisance. De manière remarquable, et au même titre que les facteurs de transcription [
18
], les épigènes constituent une classe de gènes très sensible et intolérante à la variation du nombre de copies fonctionnelles, une caractéristique de l’haploinsuffisance. Logiquement, il apparaît que les épigènes codant des épifacteurs à double fonction semblent particulièrement intolérants à la variation de dose. Cette intolérance à la perte de fonction d’un épigène est liée à leur fonction d’écrivain, d’effaceur, de lecteur ou de remodeleur, ce qui souligne l’importance de l’intégrité de l’épigénome dans le fonctionnement de notre organisme. De plus, certains épigènes présentent un niveau élevé de co-expression dans certains tissus, reflétant des convergences fonctionnelles essentielles aux fonctionnements des organes associés.
|
Quelles informations apportent l’étude des épigénotypes dans les MGME ? Utilité diagnostique
Parmi les millions de SNV (
single nucleotide variants
) identifiés par les techniques de séquençage à haut débit réalisées à la suite d’un suivi clinique, l’évaluation de leur potentiel pathogène, qui suit les recommandations internationales de l’
American College of Medical Genetics
(ACMG), est fondée, entre autres, sur leur fréquence en population générale dans les bases de données de patients, ainsi que sur des prédictions
in silico
et des approches fonctionnelles [
23
]. Cependant, pour certains individus, ces outils ne permettent pas de conclure, laissant des variants de signification inconnue (ou VSI) [
24
]. La résolution des VSI nécessite des approches fonctionnelles souvent longues et difficiles à mettre en place en clinique, avec l’utilisation de modèles cellulaires ou animaux peu compatibles avec la temporalité du diagnostic.
Depuis une dizaine d’années, l’étude de profils de méthylation de l’ADN du sang des patients atteints de maladies rares émerge comme un outil d’aide au diagnostic performant dans la résolution des VSI. L’utilisation de ces données épigénomiques comme « épisignatures » provenant de l’étude EWAS (
epigenome-wide association study
), repose sur des données de la littérature mettant en évidence des interactions fonctionnelles des différentes machineries épigénétiques entre elles. Ainsi, des altérations fonctionnelles de la machinerie relative aux histones, celle des remodeleurs et des lecteurs, et, logiquement, celle de la méthylation de l’ADN, auront toutes potentiellement des conséquences sur les profils de la méthylation de l’ADN, marque épigénétique la plus facile d’accès dans une approche de diagnostic clinique car liée directement à l’ADN de manière covalente et stable [
25
,
26
]. L’utilisation de la méthylation de l’ADN en diagnostic est un domaine de recherche en plein essor et fournit déjà des signatures spécifiques de méthylation pour plus de 70 MGME. Ces épisignatures constituent des bases de données qui sont aujourd’hui utilisées en Europe et aux États-Unis dans le diagnostic des MGME [
27
,
28
]. Par exemple, le test EpiSign [
29
] ou la plateforme EpigenCentral [
30
] constituent des outils apportant une dimension innovante et complémentaire aux méthodes standards d’investigation génétique. Le principe repose sur la comparaison de profils de méthylation de patients en attente de diagnostic à une base de données regroupant des profils de référence à la fois pour les MGME et pour des sujets sains. Ces méthylomes de l’ADN sont générés par la technologie des puces
Illumina
7
qui couvrent, selon les versions de puces utilisées, entre 450 000 et 900 000 sites CpG de méthylation représentatifs des 30 millions de sites du génome humain. La méthode de classification des profils de méthylation fait appel à l’intelligence artificielle et à l’apprentissage automatique (
machine learning
) : des modèles d’apprentissage dans lesquels un modèle de classification est entraîné sur les profils de méthylation de l’ADN de cohortes de référence de patients et de sujets sains. En plus de cette classification, l’analyse en composantes principales (ACP) et le regroupement hiérarchique sont des outils informatiques qui fournissent des visualisations complémentaires sur les similitudes entre méthylomes de l’ADN. En France, malgré un certain retard, l’exploitation des épisignatures dans le diagnostic des MGME est en plein développement et plusieurs structures de génétique médicale mettent en place des services dédiés à leur utilisation [
31
].
Malgré des avancées significatives et prometteuses [
27
,
28
,
31
–
34
], il reste des limites importantes à l’utilisation optimale des épisignatures en clinique, notamment dues à la présence de nombreux biais d’identification [
31
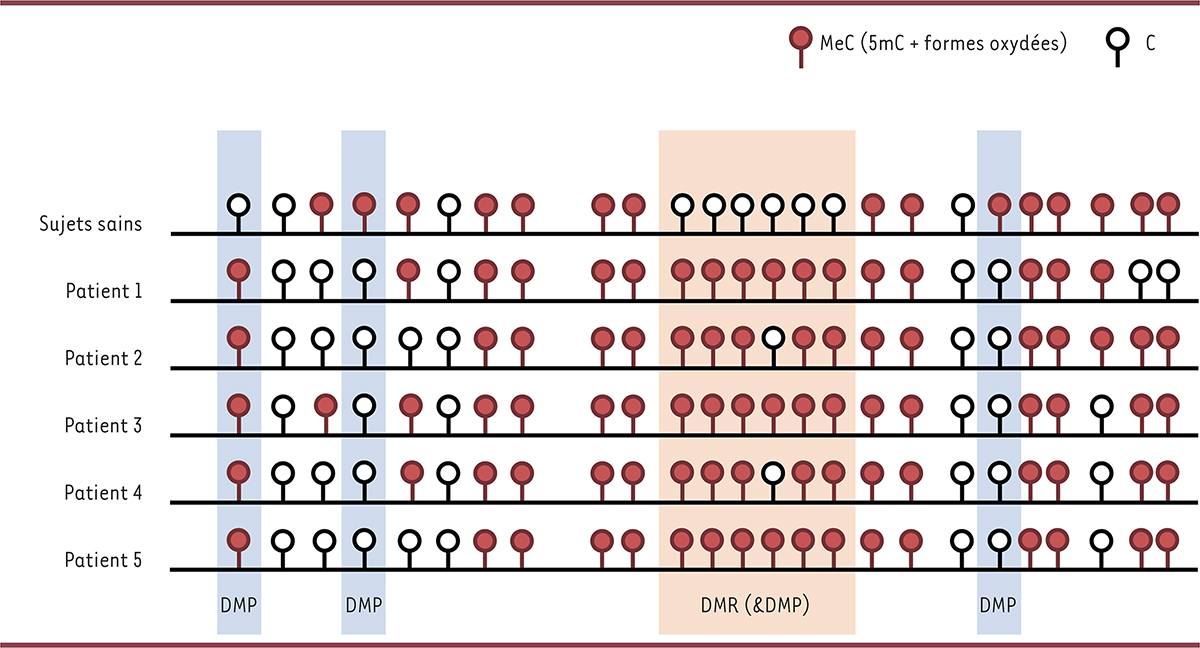
]. Un point critique est l’absence d’un consensus international public concernant les critères statistiques des épisignatures en diagnostic. En effet, les MGME étant des maladies rares, voir ultra rares,, les cohortes de patients peuvent être très restreintes, parfois même limitées à un ou deux cas. Dans un tel contexte, il est difficile d’avoir la puissance statistique nécessaire pour définir une épisignature robuste et spécifique à certaines maladies. Une très large cohorte de référence de sujets sains est donc indispensable (avec plus de 100 individus) comprenant différentes classes d’âge, de sexe et d’ethnies afin d’éviter les phénomènes de faux positifs ou de faux négatifs. Une stratégie proposée consiste à prendre en considération des variations de méthylation au niveau de régions contenant plusieurs sites de méthylation (DMR, pour
differentially methylated region
) au lieu de sites individualisés (DMP, pour
differentially methylated probe
) en y intégrant des méthodes statistiques appropriées [
35
] (
Figure 4
).
 | Figure 4
Utilisation des DMP et DMR comme épisignatures
.
Schéma décrivant l’identification des DMP (
differentially methylated position
) (fond bleu clair) et des DMR (
differentially methylated region
) (fond orange clair) par comparaison entre patients et sujets sains, par exemple dans le cas d’analyse par puces de méthylation. Cette technique, qui fait intervenir la conversion de l’ADN au bisulfite de sodium (traitement chimique qui va convertir les cytosines [C] non méthylées de l’ADN en uracile, puis en thymines après amplification par PCR), ne permet pas de distinguer la 5-methylcytosine (MeC) de ses formes oxydées (comme la 5-hydroxymethylcytosine, la 5-formylcytosine et la 5-carbamylcytosine).
|
La constitution de cohortes de patients plus importantes et de référence apparaît donc essentielle et nécessite de mettre en place des collaborations internationales. L’accès aux données brutes de méthylation et leur mutualisation, en respectant évidemment l’anonymisation des échantillons et la réglementation éthique qui s’impose, serait également particulièrement bénéfique pour l’ensemble de la communauté impliquée dans la recherche biomédicale ainsi que pour les patients.
Outre les biais statistiques évoqués, des biais d’identification d’épisignatures liés à des paramètres physiologiques sont également à considérer. En effet, les profils de méthylation sont générés à partir du sang total des sujets, un tissu hétérogène en termes de populations cellulaires, qui varient selon l’âge, et est soumis directement à l’environnement (
Figure 3
). Tous ces facteurs, connus pour affecter les profils de méthylation, sont des facteurs confondants qui peuvent fausser l’identification d’épisignatures spécifiques à chaque MGME, c’est-à-dire celles qui résultent directement du génotype des patients. Aussi, même si l’utilisation d’outils bio-informatiques et la constitution d’une large cohorte de référence peuvent corriger certains de ces biais, l’utilisation en complément d’autres échantillons, tels que l’épithélium buccal (geste non-invasif) ou la peau, peut s’avérer pertinente. De plus, une validation expérimentale, fondée sur une autre technique que les puces de méthylation, peut également s’avérer nécessaire afin d’augmenter la robustesse des épisignatures.
Informations fonctionnelles
En plus de leur utilité diagnostique, les méthylomes des MGME constituent une source d’information précieuse pour la recherche fondamentale en épigénétique. La comparaison des profils de méthylations entre MGME et leur degré de ressemblance peuvent révéler des liens fonctionnels entre les différentes machineries épigénétiques et ainsi nous éclairer sur l’interdépendance de certains mécanismes moléculaires ou nous renseigner sur les interactions fonctionnelles entre épifacteurs chez l’homme. Par exemple, certaines DMPs pour le syndrome de Weaver (ORPHA:3447 ;
EZH2, enhancer of zeste 2
) sont communes au syndrome de Cohen-Gibson (ORPHA:659396 :
EED, embryonic ectoderm development
) et à celui de Imagawa-Motsumoto (ORPHA:659463 ;
SUZ12, suppressor of zeste 12
), en accord avec le lien fonctionnel fort entre les trois épifacteurs, EZH2, EED et SUZ12, qui constituent le cœur du complexe polycomb PRC2, responsable de la méthylation H3K27me2/me3 [
34
,
36
]. Dans le cas du syndrome de Kabuki (ORPHA:2322), les deux soustypes de patients, définissant respectivement les syndromes Kabuki 1 et 2, ont des variants pathogènes respectivement du gène
KMT2D
(
lysine methyltransferase 2D
: histone méthyltransférase de H3K4) et
KDM6A
(
lysine demethylase 6A
: histone déméthylase de H3K27me2/me3), à l’origine de profils de méthylation similaires [
32
]. Cela reflète une convergence fonctionnelle de ces deux épifacteurs, notamment par leur implication dans le complexe COMPASS [
37
]. Un autre exemple d’indicateur fonctionnel apporté par les méthylomes est la forte similitude des profils de méthylation de patients atteints du syndrome de Sotos (ORPHA:821 ;
NSD1 : nuclear receptor binding SET domain protein 1 ;
HMT H3K36me3) et Tatton-Brown-Rahman (TBRS) (ORPHA:404443 ;
DNMT3A, DNA methyltransferase 3 alpha
; ADN méthyltransférase). Les mécanismes de cette interaction ont été élucidés grâce à des études conduites chez la souris [
38
] qui démontrent 1) le rôle essentiel des modifications H3K36me2 et H3K36me3 comme déterminants de la méthylation de l’ADN, et 2) le rôle des enzymes DNMT3A et DNMT3B comme lecteurs de ces marques d’histones
via
leur domaine PWWP
8,
[
38
,
39
]. L’identification de variants pathogènes au sein de ce domaine chez des patients atteints des syndromes TBRS et ICF1 (causé par des variants de
DNMT3B
) a été un premier révélateur de ces découvertes mécanistiques d’adressage de la méthylation sur le génome. L’étude du syndrome ICF a également permis de révéler des mécanismes moléculaires convergents, mis en évidence par la comparaison des profils de méthylation de l’ADN entre les quatre soustypes de patients ICF souffrant de mutations dans les gènes codant DNMT3B, codant les facteurs de transcription ZBTB24 (
Zinc finger and BTB domain containing 24
) et CDCA7 (
cell division cycle associated 7
), ou encore codant le remodeleur de la chromatine, HELLS (
helicase, lymphoid specific
) [
40
].
L’étape suivante dans la compréhension des mécanismes moléculaires des MGME consistera à intégrer aux données de méthylation de l’ADN, la cartographie d’autres marques épigénétiques (comme l’hydroxyméthylation de l’ADN [
41
], la méthylation/acétylation d’histones, les variants d’histones), des données de conformation (
ATAC [assay for transposase-accessible chromatin]-seq, DNase-seq
) et d’interaction en trois dimensions de la chromatine (Hi-C) afin d’en préciser la compréhension globale dans un contexte sain et pathologique [
42
].
|
Relations entre génotypes, épigénotypes et phénotypes des MGME
Bien que leur relation de causalité ne soit pas toujours clairement démontrée, des données de la littérature indiquent qu’il existe de fortes corrélations entre la nature du variant génétique, l’impact sur la méthylation de l’ADN, et les manifestations cliniques des patients atteints de MGME. Des variants pathogènes entraînant la perte de fonction de DNMT3A sont responsables du syndrome TBRS, tandis que ceux à l’origine d’un gain de fonction de la protéine causent le syndrome de Heyn-Sproul-Jackson (HESJAS ; ORPHA:658595), avec des phénotypes de croissance opposés : contrairement au syndrome TBRS, qui se caractérise par une hypométhylation (perte de méthylation 5mC par rapport à la normale) de l’ADN [
43
] associée à une avance staturale, le syndrome HESJAS présente un phénomène d’hyperméthylation de l’ADN (gain de méthylation 5mC par rapport à la normale) associé à un retard statural sévère [
44
]. De manière similaire, un variant perte de fonction dans le gène
NSD1
(syndrome de Sotos) ou une duplication du gène (syndrome de Mac-Alpine, ORPHA:97340) conduit à des épisignatures et des phénotypes de tailles opposées [
32
]. Dans le syndrome de Weaver, ce lien entre génotypes, épigénotypes et phénotypes est illustré par le cas d’un patient présentant une atténuation des défauts de méthylation associée à un phénotype modéré causé par un mosaïcisme somatique [
34
].
Le cas du syndrome ICF est également représentatif de cette relation entre génotypes, épigénotypes et phénotypes. Les quatre sous-types de patients ICF (ICF1-4) définis par la présence de variants pathogènes dans les gènes
DNMT3B, ZBTB24, CDCA7 et HELLS
, se scindent en deux groupes qui se distinguent à la fois par leur profil de méthylation et leurs signes cliniques [
40
,
45
,
46
].
|
Nécessité d’établir un lien direct entre génotypes, épigénotypes et phénotypes
Les MGME étant des maladies génétiques affectant les fonctions d’épifacteurs, il est très probable que l’équilibre entre euchromatine et hétérochromatine soit perturbé, ce qui affecte la régulation de l’expression du génome, notamment les programmes d’expression génique tissulaire tout au long du développement. Cependant, il semble que les mécanismes physiopathologiques impliqués soient multiples avec, notamment, la considération de cibles protéiques non-histones pour les écrivains, ce qui peut moduler la fonction des protéines ciblées [
47
]. Il est également possible que les mécanismes pathogéniques en cause ne soient pas directement liés à l’activité de l’épifacteur muté. C’est le cas des deux MGME causées par des variants pathogènes du gène
DNMT1
(
DNA methyltransferase 1
) : les syndromes HSN1E (ORPHA:456318) et ADCA-DN (ORPHA:314404). Bien que des épisignatures de méthylation de l’ADN aient été identifiées dans ces syndromes, le caractère tardif des symptômes à l’âge adulte, et distinct par rapport à d’autres syndromes causés par une perte fonctionnelle de deux autres DNMT (DNMT3A et DNMT3B), interroge quant au lien entre les anomalies de méthylation de l’ADN identifiées et les manifestations cliniques de ces patients mutés pour
DNMT1
. Une hypothèse serait que les variants protéiques de DNMT1 altèreraient des fonctions cytoplasmiques essentielles à la survie neuronale, à l’origine de la neurodégénérescence affectant ces patients [
48
,
49
].
La relation directe entre épisignatures et phénotypes des MGME est donc loin d’être triviale. Pour autant, elle peut nous renseigner sur des liens potentiels entre des épimutations identifiées au niveau de certains gènes et les symptômes cliniques des maladies. La plupart des méthylomes de l’ADN sont réalisés à partir du sang des patients, pour des raisons éthiques et de faisabilité en clinique. Sachant qu’une majorité de MGME présente des anomalies du développement et de la croissance ainsi que des déficits intellectuels, l’utilisation du sang comme tissu d’investigation semble limitée pour étudier les relations entre génotypes, épigénotypes et phénotypes de la majorité des MGME. C’est pourquoi ces corrélations peuvent souvent être interprétées comme peu pertinentes pour la compréhension des MGME.
En conséquence, et afin de répondre formellement à la question majeure du lien entre ces épisignatures et les manifestations cliniques des patients, il est nécessaire de combiner de multiples approches dans des contextes cellulaires pertinents pour ces maladies. Ceci inclut des stratégies multi-omiques intégrant des données d’épigénomique (modifications chimiques et organisation de la chromatine), de génomique, de transcriptomique, de protéomique, de métabolomique [
3
], d’édition de l’épigénome
9
dans des systèmes cellulaires provenant de modèles animaux [
50
] ou d’organoïdes [
51
]. Des approches à l’échelle de la cellule unique seront également indispensables, en particulier dans les investigations concernant le fonctionnement du système neuronal.
L’utilisation de modèles animaux est une approche judicieuse dans le contexte des MGME pour décrypter les mécanismes moléculaires mis en cause. La souris et le poisson zèbre sont notamment des modèles particulièrement informatifs dans l’étude du développement embryonnaire [
50
]. Parmi les nombreux modèles de MGME générés (23 écrivains, 10 effaceurs, 27 lecteurs et 10 remodeleurs mutés [
50
]), une majorité reproduit les phénotypes humains, avec un spectre large de manifestations, incluant des défauts de viabilité, de croissance, de développement neuronal et squelettique, de développement cardiaque, des yeux, de mémoire et de comportements.
|
Perspectives thérapeutiques des MGME
L’identification de voies moléculaires mises en cause dans les MGME constitue autant de cibles thérapeutiques potentielles. La correction des perturbations de l’épigénome et de leurs conséquences sur le transcriptome semble être la piste privilégiée dans l’élaboration de futurs traitements [
5
,
14
]. Ces thérapies épigénétiques reposent sur l’utilisation d’épidrogues, qui sont des composés chimiques modifiant les propriétés enzymatiques d’épifacteurs, dans le but de compenser ou de corriger les profils épigénomiques pathologiques. Bien qu’étant déjà utilisées dans le traitement des cancers, ces thérapies n’ont pas encore été approuvées pour traiter les MGME, mais font l’objet de plusieurs études expérimentales [
14
]. Certaines données de la littérature sont encourageantes et montrent qu’il existe un espoir de traitement des symptômes neurologiques pour les MGME [
14
]. Une étude conduite sur un modèle murin du syndrome de Rett, mutant pour le lecteur
MECP2
(
methyl-CpG binding protein 2
), montre qu’une restauration de la copie sauvage du gène améliore nettement le phénotype des souris [
52
]. D’autres travaux utilisant également des modèles murins [
14
,
52
–
54
] suggèrent qu’un traitement postnatal à l’aide d’épidrogues serait possible pour les syndromes de Rubinstein-Taybi et de Kabuki. Grâce à la malléabilité de l’épigénome, ces thérapies pourraient être mises en place dès le plus jeune âge afin de corriger des épimutations et leurs conséquences. La mise en place de thérapies épigénétiques suscite donc l’espoir de parvenir à corriger certaines manifestations cliniques des MGME.
|
Conclusions et perspectives
L’identification croissante des MGME, ainsi que la documentation de leurs caractéristiques moléculaires et cliniques, représentent une réelle avancée dans le domaine biomédical. En complément des approches génétiques classiques, l’utilisation des épisignatures à des fins diagnostiques est un réel bénéfice pour les patients et leurs familles [
28
]. Au regard de l’apport significatif des épisignatures dans l’amélioration du diagnostic des MGME, il est urgent de considérer les investigations de la méthylation de l’ADN comme approche systématique et complémentaire aux exomes dans les services de génétique, spécialement dans le cas des variants nucléotidiques de signification inconnue et pour les diagnostics cliniques incertains. Le développement de services dédiés dans le domaine clinique présente donc un intérêt grandissant. Cependant, le recours systématique aux épisignatures dans le diagnostic passe nécessairement par plus de transparence et de cohérence sur le mode opératoire de leur identification (technique utilisée, traitement des données, etc.) et sur leurs critères d’analyse bioinformatiques et statistiques précis.
L’étude des MGME nous renseigne sur le lien entre altérations (épi)génétiques et manifestations cliniques. Le contexte monogénique de ces maladies représente un modèle d’étude idéal pour évaluer le rôle de l’épigénétique en santé. Même si certaines données suggèrent fortement l’existence d’un lien causal entre les épimutations et les symptômes cliniques, les preuves formelles manquent, en partie à cause de la difficulté d’établir des modèles cellulaires humains pertinents pour l’étude des MGME et aussi du manque de profondeur et de diversité des investigations moléculaires. Le développement d’approches multi-omiques en cellule unique, et de l’édition de l’épigénome couplé à l’utilisation des organoïdes, permettra d’évaluer précisément l’importance de l’épigénétique en santé, notamment dans des maladies neurodéveloppementales complexes, et de mettre en place des thérapies ciblées au bénéfice des patients. |
Footnotes |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article
.
|
1.
Allis
CD
,
Jenuwein
T.
The molecular hallmarks of epigenetic control.
.
Nat Rev Genet
.
2016;
;
17
:
:487.
–
500
.
2.
Marakulina
D
,
Vorontsov
IE
,
Kulakovskiy
IV
,
et al.
.
EpiFactors 2022: expansion and enhancement of a curated database of human epigenetic factors and complexes.
.
Nucleic Acids Research
.
2023;
;
51
:
:D564.
–
70
.
3.
Nava
AA
,
Arboleda
VA.
The omics era: a nexus of untapped potential for Mendelian chromatinopathies.
.
Hum Genet
.
2024;
;
143
:
:475.
–
95
.
4.
Boukas
L
,
Havrilla
JM
,
Hickey
PF
,
et al.
.
Coexpression patterns define epigenetic regulators associated with neurological dysfunction.
.
Genome Res
.
2019;
;
29
:
:532.
–
42
.
5.
Berdasco
M
,
Esteller
M.
Genetic syndromes caused by mutations in epigenetic genes.
.
Hum Genet
.
2013;
;
132
:
:359.
–
83
.
6.
Brookes
E
,
Shi
Y.
Diverse epigenetic mechanisms of human disease.
.
Annu Rev Genet
.
2014;
;
48
:
:237.
–
68
.
7.
Zoghbi
HY
,
Beaudet
AL.
Epigenetics and Human Disease.
.
Cold Spring Harb Perspect Biol
.
2016;
;
8
:
:a019497.
.
8.
Garraway
LA
,
Lander
ES.
Lessons from the cancer genome.
.
Cell
.
2013;
;
153
:
:17.
–
37
.
9.
Ciptasari
U
,
Bokhoven
H van.
The phenomenal epigenome in neurodevelopmental disorders.
.
Hum Mol Genet
.
2020;
;
29
:
:R42.
–
50
.
10.
Nguengang
Wakap S
,
Lambert
DM
,
Olry
A
,
et al.
.
Estimating cumulative point prevalence of rare diseases: analysis of the Orphanet database.
.
Eur J Hum Genet
.
2020;
;
28
:
:165.
–
73
.
11.
Fu
MP
,
Merrill
SM
,
Sharma
M
,
et al.
.
Rare diseases of epigenetic origin: Challenges and opportunities.
.
Front Genet
.
2023
;
:14.
.
12.
Bjornsson
HT.
The Mendelian disorders of the epigenetic machinery.
.
Genome Res
.
2015;
;
25
:
:1473.
–
81
.
13.
Hendrich
B
,
Bickmore
W.
Human diseases with underlying defects in chromatin structure and modification.
.
Hum Mol Genet
.
2001;
;
10
:
:2233.
–
42
.
14.
Fahrner
JA
,
Bjornsson
HT.
Mendelian disorders of the epigenetic machinery: postnatal malleability and therapeutic prospects.
.
Hum Mol Genet
.
2019;
;
28
:
:R254.
–
64
.
15.
Iwase
S
,
Bérubé
NG
,
Zhou
Z
,
et al.
.
Epigenetic Etiology of Intellectual Disability.
.
J Neurosci
.
2017;
;
37
:
:10773.
–
82
.
16.
Tatton-Brown
K
,
Loveday
C
,
Yost
S
,
et al.
.
Mutations in Epigenetic Regulation Genes Are a Major Cause of Overgrowth with Intellectual Disability.
.
Am J Hum Genet
.
2017;
;
100
:
:725.
–
36
.
17.
Plass
C
,
Pfister
SM
,
Lindroth
AM
,
et al.
.
Mutations in regulators of the epigenome and their connections to global chromatin patterns in cancer.
.
Nat Rev Genet
.
2013;
;
14
:
:765.
–
80
.
18.
Jimenez-Sanchez
G
,
Childs
B
,
Valle
D.
Human disease genes.
.
Nature
.
2001;
;
409
:
:853.
–
5
.
19.
Deciphering Developmental Disorders Study. Large-scale discovery of novel genetic causes of developmental disorders.
.
Nature
.
2015;
;
519
:
:223.
–
8
.
20.
Zaidi
S
,
Choi
M
,
Wakimoto
H
,
et al.
.
De novo mutations in histone-modifying genes in congenital heart disease.
.
Nature
.
2013;
;
498
:
:220.
–
3
.
21.
Feinberg
AP
,
Koldobskiy
MA
,
Göndör
A.
Epigenetic modulators, modifiers and mediators in cancer aetiology and progression.
.
Nat Rev Genet
.
2016;
;
17
:
:284.
–
99
.
22.
Lek
M
,
Karczewski
KJ
,
Minikel
EV
,
et al.
.
Analysis of protein-coding genetic variation in 60,706 humans.
.
Nature
.
2016;
;
536
:
:285.
–
91
.
23.
Richards
S
,
Aziz
N
,
Bale
S
,
et al.
.
Standards and guidelines for the interpretation of sequence variants: a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology.
.
Genet Med
.
2015;
;
17
:
:405.
–
24
.
24.
Starita
LM
,
Ahituv
N
,
Dunham
MJ
,
et al.
.
Variant Interpretation: Functional Assays to the Rescue.
.
Am J Hum Genet
.
2017;
;
101
:
:315.
–
25
.
25.
Greenberg
MVC
,
Bourc’his
D.
The diverse roles of DNA methylation in mammalian development and disease.
.
Nat Rev Mol Cell Biol
.
2019;
;
20
:
:590.
–
607
.
26.
Geiman
TM
,
Robertson
KD.
Chromatin remodeling, histone modifications, and DNA methylation-how does it all fit together?
J Cell Biochem
.
2002;
;
87
:
:117.
–
25
.
27.
Levy
MA
,
McConkey
H
,
Kerkhof
J
,
et al.
.
Novel diagnostic DNA methylation episignatures expand and refine the epigenetic landscapes of Mendelian disorders.
.
HGG Adv
.
2022;
;
3
:
:100075.
.
28.
Harris
JR
,
Gao
CW
,
Britton
JF
,
et al.
.
Five years of experience in the Epigenetics and Chromatin Clinic: what have we learned and where do we go from here?
Hum Genet
.
2024;
;
143
:
:607.
–
24
.
29.
Sadikovic
B
,
Levy
MA
,
Aref-Eshghi
E.
Functional annotation of genomic variation: DNA methylation episignatures in neurodevelopmental Mendelian disorders.
.
Hum Mol Genet
.
2020;
;
29
:
:R27.
–
32
.
30.
Turinsky
AL
,
Choufani
S
,
Lu
K
,
et al.
.
EpigenCentral: Portal for DNA methylation data analysis and classification in rare diseases.
.
Hum Mutat
.
2020;
;
41
:
:1722.
–
33
.
31.
Husson
T
,
Lecoquierre
F
,
Nicolas
G
,
et al.
.
Episignatures in practice: independent evaluation of published episignatures for the molecular diagnostics of ten neurodevelopmental disorders.
.
Eur J Hum Genet
.
2024;
;
32
:
:190.
–
9
.
32.
Aref-Eshghi
E
,
Kerkhof
J
,
Pedro
VP
,
et al.
.
Evaluation of DNA Methylation Episignatures for Diagnosis and Phenotype Correlations in 42 Mendelian Neurodevelopmental Disorders.
.
Am J Hum Genet
.
2020;
;
106
:
:356.
–
70
.
33.
Awamleh
Z
,
Goodman
S
,
Kallurkar
P
,
et al.
.
Generation of DNA Methylation Signatures and Classification of Variants in Rare Neurodevelopmental Disorders Using EpigenCentral.
.
Curr Protoc
.
2022;
;
2
:
:e597.
.
34.
Choufani
S
,
Gibson
WT
,
Turinsky
AL
,
et al.
.
DNA Methylation Signature for EZH2 Functionally Classifies Sequence Variants in Three PRC2 Complex Genes.
.
Am J Hum Genet
.
2020;
;
106
:
:596.
–
610
.
35.
Grolaux
R
,
Hardy
A
,
Olsen
C
,
et al.
.
Identification of differentially methylated regions in rare diseases from a single-patient perspective.
.
Clin Epigenetics
.
2022;
;
14
:
:174.
.
36.
Margueron
R
,
Reinberg
D.
The Polycomb complex PRC2 and its mark in life.
.
Nature
.
2011;
;
469
:
:343.
–
9
.
37.
Piunti
A
,
Shilatifard
A.
Epigenetic balance of gene expression by Polycomb and COMPASS families.
.
Science
.
2016;
;
352
:
:aad9780.
.
38.
Weinberg
DN
,
Papillon-Cavanagh
S
,
Chen
H
,
et al.
.
The histone mark H3K36me2 recruits DNMT3A and shapes the intergenic DNA methylation landscape.
.
Nature
.
2019;
;
573
:
:281.
–
6
.
39.
Baubec
T
,
Colombo
DF
,
Wirbelauer
C
,
et al.
.
Genomic profiling of DNA methyltransferases reveals a role for DNMT3B in genic methylation.
.
Nature
.
2015;
;
520
:
:243.
–
7
.
40.
Velasco
G
,
Grillo
G
,
Touleimat
N
,
et al.
.
Comparative methylome analysis of ICF patients identifies heterochromatin loci that require ZBTB24, CDCA7 and HELLS for their methylated state.
.
Hum Mol Genet
.
2018;
;
27
:
:2409.
–
24
.
41.
De Dieuleveult
M
,
Bizet
M
,
Colin
L
,
et al.
.
The chromatin remodelling protein LSH/HELLS regulates the amount and distribution of DNA hydroxymethylation in the genome.
.
Epigenetics
.
2021;
;
0
:
:1.
–
22
.
42.
Luperchio
TR
,
Boukas
L
,
Zhang
L
,
et al.
.
Leveraging the Mendelian disorders of the epigenetic machinery to systematically map functional epigenetic variation.
.
Elife
.
2021;
;
10
:
:e65884.
.
43.
Jeffries
AR
,
Maroofian
R
,
Salter
CG
,
et al.
.
Growth disrupting mutations in epigenetic regulatory molecules are associated with abnormalities of epigenetic aging.
.
Genome Res
.
2019;
;
29
:
:1057.
–
66
.
44.
Heyn
P
,
Logan
CV
,
Fluteau
A
,
et al.
.
Gain-of-function DNMT3A mutations cause microcephalic dwarfism and hypermethylation of Polycomb-regulated regions.
.
Nat Genet
.
2019;
;
51
:
:96.
–
105
.
45.
Weemaes
CMR
,
Tol
MJD van
,
Wang
J
,
et al.
.
Heterogeneous clinical presentation in ICF syndrome: correlation with underlying gene defects.
.
Eur J Hum Genet
.
2013;
;
21
:
:1219.
–
25
.
46.
Thijssen
PE
,
Ito
Y
,
Grillo
G
,
et al.
.
Mutations in CDCA7 and HELLS cause immunodeficiency-centromeric instability-facial anomalies syndrome.
.
Nat Commun
.
2015;
;
6
:
:7870.
.
47.
Biggar
KK
,
Li
SS-C.
Non-histone protein methylation as a regulator of cellular signalling and function.
.
Nat Rev Mol Cell Biol
.
2015;
;
16
:
:5.
–
17
.
48.
Maresca
A
,
Del
Dotto V
,
Capristo
M
,
et al.
.
DNMT1 mutations leading to neurodegeneration paradoxically reflect on mitochondrial metabolism.
.
Hum Mol Genet
.
2020;
;
29
:
:1864.
–
81
.
49.
Baets
J
,
Duan
X
,
Wu
Y
,
et al.
.
Defects of mutant DNMT1 are linked to a spectrum of neurological disorders.
.
Brain
.
2015;
;
138
:
:845.
–
61
.
50.
Di Fede
E
,
Grazioli
P
,
Lettieri
A
,
et al.
.
Epigenetic disorders: Lessons from the animals-animal models in chromatinopathies.
.
Front Cell Dev Biol
.
2022;
;
10
:
:979512.
.
51.
Kim
J
,
Koo
B-K
,
Knoblich
JA.
Human organoids: model systems for human biology and medicine.
.
Nat Rev Mol Cell Biol
.
2020;
;
21
:
:571.
–
84
.
52.
Guy
J
,
Gan
J
,
Selfridge
J
,
et al.
.
Reversal of neurological defects in a mouse model of Rett syndrome.
.
Science
.
2007;
;
315
:
:1143.
–
7
.
53.
Alarcón
JM
,
Malleret
G
,
Touzani
K
,
et al.
.
Chromatin acetylation, memory, and LTP are impaired in CBP+/- mice: a model for the cognitive deficit in Rubinstein-Taybi syndrome and its amelioration.
.
Neuron
.
2004;
;
42
:
:947.
–
59
.
54.
Korzus
E
,
Rosenfeld
MG
,
Mayford
M.
CBP histone acetyltransferase activity is a critical component of memory consolidation.
.
Neuron
.
2004;
;
42
:
:961.
–
72
.
|