| |
| Med Sci (Paris). 40(11): 882–884. doi: 10.1051/medsci/2024158.EROS, une chaperonne cruciale pour la NADPH oxydase et le récepteur P2X7 Maya Law-pois1* and Sophie Dupré-Crochet2** 1M1 Biologie Santé, Université Paris-Saclay
,
Orsay
,
France 2Université Paris-Saclay, UVSQ, LGBC
,
Versailles
,
France MeSH keywords: |
Le complexe NADPH oxydase est un composant crucial de l’immunité innée. Ce complexe est constitué d’un hétérodimère transmembranaire gp91
phox
-p22
phox
(
phagocyte homology
) ainsi que de plusieurs protéines cytosoliques (
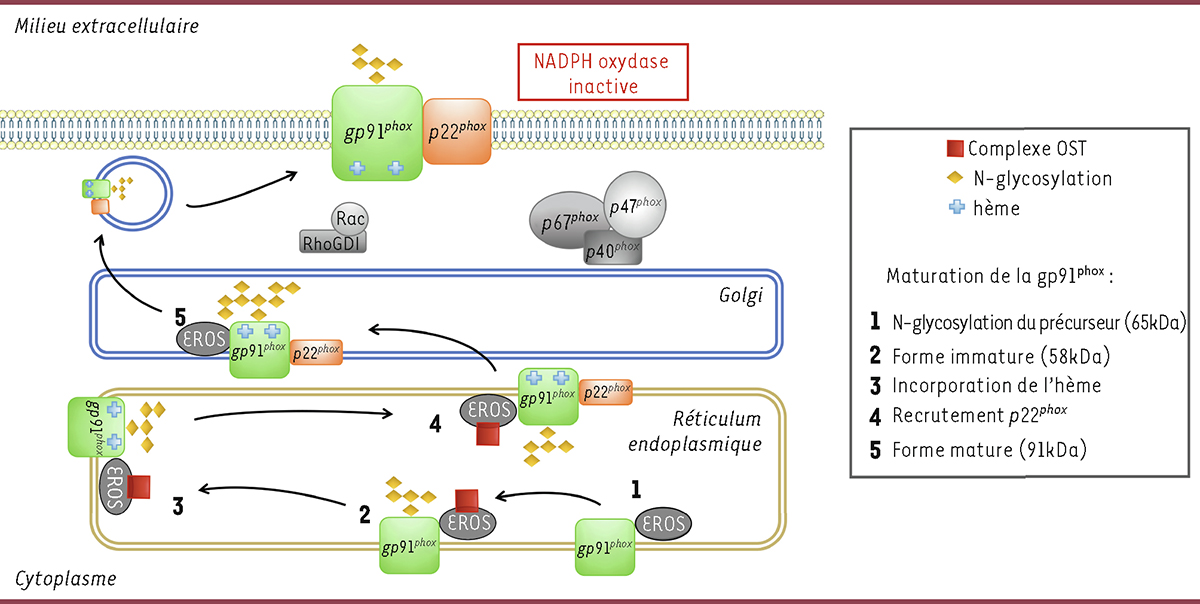
Figure 1
). Lors de la phagocytose d’agents pathogènes ou lors de l’activation des cellules immunitaires innées par des composants microbiens solubles, les protéines cytosoliques et transmembranaires s’associent pour former un complexe NADPH oxydase actif, appelé NOX2, au niveau des membranes phagosomales ou plasmiques [
1
]. NOX2 permet de générer des formes réactives de l’oxygène (
FRO
)
1
qui jouent un rôle essentiel dans les réponses immunitaires, notamment pour la défense de l’hôte contre les microbes. Cependant, NOX2 doit être finement régulée. En effet un excès des formes réactives de l’oxygène peut induire des lésions tissulaires. À l’inverse, une NADPH oxydase absente ou non fonctionnelle conduit, chez l’homme, à des infections sévères et récurrentes, regroupées sous le terme de maladie granulomateuse chronique (
chronic granulomatous disease
, CGD). Cette maladie est principalement due à des mutations dans l’un des constituants du complexe NOX2. Cependant, l’absence de la protéine EROS (
essential for reactive oxygen species
) a récemment été identifiée comme une nouvelle cause de maladie granulomateuse chronique. EROS régulerait l’abondance de la sous-unité catalytique gp91
phox
[
2
]. Celle-ci est synthétisée sous forme d’un précurseur de 58 kDa dans le réticulum endoplasmique (RE). Elle est ensuite glycosylée puis acquiert deux hèmes et s’associe à la protéine p22
phox
. Elle subit ensuite de nouvelles glycosylations dans l’appareil de Golgi. L’incorporation d’hèmes sur gp91
phox
est nécessaire pour le processus d’hétérodimérisation avec p22
phox
(
Figure 1
). L’absence d’incorporation d’hèmes entraîne la dégradation rapide des protéines gp91
phox
et p22
phox
[
3
]. Les mécanismes contrôlant la régulation de l’hétérodimère gp91
phox
-p22
phox
par EROS étaient encore inconnus. L’objectif des travaux conduits par Randzavola
et al
. [
4
] était d’élucider le rôle d’EROS dans la régulation de l’abondance de l’hétérodimère gp91
phox
-p22
phox
et d’une autre protéine importante dans l’immunité innée, le récepteur purinergique P2X7.
 | Figure 1.
Rôle d’EROS dans la maturation de gp91phox
. EROS lie et stabilise la forme immature de la sous unité catalytique de la NADPH oxydase, gp91
phox
, à la membrane du réticulum endoplasmique, permettant ainsi au complexe oligosaccharyltransférase (OST) de glycosyler gp91
phox
, ensuite l’hème est ajouté à gp91
phox
puis p22
phox
s’associe à gp91
phox
. De nouvelles glycosylations sont ajoutées à cette dernière dans l’appareil de Golgi puis l’hétérodimère est transféré à la membrane cytoplasmique ou à la membrane des endosomes, dans les macrophages, et des granules secondaires dans les neutrophiles. La NADPH oxydase est constituée des deux sous unités membranaires gp91
phox
, p22
phox
, des sous unités cytosoliques p47
phox
, p40
phox
et p67
phox
et de la petite GTPase Rac. L’assemblage des sous-unités cytosoliques et de Rac avec les sous-unités membranaires a lieu lors de l’activation des phagocytes et génère une NADPH oxydase active.
|
|
EROS stabilise l’hétérodimère gp91
phox
-p22
phox
en intervenant dans les stades précoces de la biosynthèse de gp91
phox
Afin de préciser par quels mécanismes EROS régule l’abondance de l’hétérodimère gp91
phox
-p22
phox
, Randzavola
et al
. ont réalisé différents
Western blot
en co-transfectant gp91
phox
ou p22
phox
avec ou sans EROS dans des lignées cellulaires n’exprimant pas ces protéines. Leurs résultats indiquent qu’EROS régule spécifiquement l’abondance de la forme immature de 58 kDa de la protéine gp91
phox
mais pas celle de la protéine p22
phox
. De plus, l’utilisation d’inhibiteur de la synthèse protéique a révélé que EROS stabilise la forme immature de gp91
phox
. La surexpression d’EROS dans une lignée de cellule myéloïde différenciée en cellule de type neutrophile augmente également l’abondance de la protéine gp91
phox
endogène et notamment la forme immature. De plus, les chercheurs ont démontré dans cette lignée, par une approche de co-immunoprécipitation, l’interaction entre EROS et gp91
phox
endogène. Afin d’explorer plus en avant l’association d’EROS avec gp91
phox
et p22
phox
, Randzavola
et al
. ont réalisé une co-immunoprécipitation suivi d’une chromatographie d’exclusion. Cette expérience a permis de montrer l’association d’EROS, de la forme hémique partiellement glycosylée de gp91
phox
et de p22
phox
. L’ajout d’un inhibiteur de la synthèse des hèmes n’empêche pas l’association d’EROS à gp91
phox
mais prévient la fixation de p22
phox
au complexe. Différentes expériences ont ensuite montré une association directe entre gp91
phox
et EROS. Ces résultats suggèrent qu’EROS lie et stabilise la forme immature de gp91
phox
et reste associée à celle-ci lors de l’incorporation de l’hème et après la liaison avec p22
phox
(
Figure 1
).
|
EROS permet la maturation de gp91
phox
en coopérant avec le complexe OST
Afin de mieux comprendre comment EROS est impliqué dans la biosynthèse de gp91
phox
, Randzavola
et al
. ont cherché d’autres partenaires d’EROS situés dans la voie de biosynthèse des protéines. Pour cela, ils ont analysé par spectrométrie de masse les protéines co-immunoprécipitées avec EROS. Parmi les partenaires d’EROS identifiés se trouvent des sous-unités du complexe oligosaccharyltransférase (OST) [
5
]. Les chercheurs ont donc émis l’hypothèse qu’EROS participe à la maturation de gp91
phox
en s’associant au complexe OST
2
. Des expériences d’inmmunofluorescence indiquent effectivement une colocalisation périnucléaire et au niveau du réticulum endoplasmique, des protéines EROS, de la sous-unité catalytique du complexe OST, STT3A (
staurosporine and temperature sensitive 3A)
, et de la protéine gp91
phox
. De plus, les chercheurs ont noté une augmentation de la forme gp91
phox
immature non glycosylée lorsque le complexe OST est soit inhibé, soit délété de la sous-unité STT3A confirmant ainsi le rôle du complexe OST dans la maturation de gp91
phox
.
|
EROS stabilise et augmente l’activité du récepteur purinergique P2X7
Grâce à des expériences de protéomique réalisées à partir de cellules immunitaires (macrophages et lymphocytes T CD4
+
), les auteurs ont observé que, dans les cellules déficientes pour EROS, le récepteur purinergique P2X7, est présent en plus faible quantité comme gp91
phox
. Les chercheurs ont donc voulu savoir si, comme pour la protéine gp91
phox
, EROS régule ce récepteur. Ils ont tout d’abord observé dans différents types de cellules immunitaires une diminution de l’abondance du récepteur P2X7 lors de la délétion d’EROS. Puis ils ont ensuite montré qu’EROS co-immunoprécipite avec P2X7 et mis en évidence l’interaction directe entre EROS et P2X7 grâce à une expérience de NanoBiT (
Nano-Luc Binary Technology
)
3
.
Le récepteur P2X7 stimulé par l’ATP permet un influx de
Ca
2+
et
Na
+
et un efflux de K
+
. Ce récepteur induit indirectement la libération de l’interleukine-1β (IL-1β) dans les macrophages stimulés par du LPS (lipopolysaccharide) [
7
] (
→
).
(→) Voir la Synthèse de M. Groslambert et B.F. Py,
m/s
n° 1, janvier 2018, page 47
Par différentes expériences, Randzavola
et al
. ont montré que la perte d’EROS permettait de diminuer l’activité du récepteur purinergique P2X7. Ils ont notamment pu observer une baisse de la sécrétion d’IL-1β par des macrophages de souris déficientes pour EROS après stimulation avec du lipopolysaccharide bactérien (LPS) et de l’ATP.
|
EROS, une nouvelle cible thérapeutique ?
Les auteurs de l’article ont donc réussi à élucider les mécanismes impliquant EROS dans les régulations de la protéine gp91
phox
et du récepteur purinergique P2X7. Ils ont montré qu’EROS lie et stabilise la forme immature de gp91
phox
au niveau du réticulum endoplasmique. Cette dernière est glycosylée par le complexe OST. EROS reste associée à celle-ci lors de l’incorporation de l’hème et après la liaison avec p22
phox
(
Figure 1
). Il reste à découvrir si EROS reste lié à gp91
phox
à la membrane plasmique.
Les auteurs ont, par ailleurs, montré que la perte d’EROS permet de freiner l’infection par le virus de la grippe A, les souris EROS-KO ayant un taux de survie plus élevé que les souris sauvages après une infection par ce virus. Ce résultat est cohérent avec le fait que la délétion ou l’inhibition de P2X7 ou gp91
phox
protège des effets délétères de l’inflammation par le virus de grippe A chez les souris et améliore la résistance de ces dernières à l’infection par ce virus [
8
,
9
]. Cette observation s’explique d’un point de vue mécanistique par le fait que les formes réactives de l’oxygène produites par la NADPH oxydase peuvent inhiber la signalisation du TLR7 (
Toll like receptor 7
), lui-même activé par l’ARN viral, retardant ainsi la réponse immunitaire et favorisant la multiplication virale [
9
,
10
] (
→
).
(→) Voir la Nouvelle de J. Miesch et
al., m/s
n° 6-7, juin-juillet 2018, page 615
Ces découvertes suggèrent qu’un inhibiteur d’EROS pourrait être utilisé dans le traitement des immunopathologies virales. |
Footnotes |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article
.
|
1.
Paclet
MH
,
Laurans
S
,
Dupré-Crochet
S.
Regulation of Neutrophil NADPH Oxidase, NOX2: A Crucial Effector in Neutrophil Phenotype and Function.
.
Front Cell Dev Biol.
.
2022;
;
10
:
:945749.
.
2.
Thomas
DC
,
Charbonnier
LM
,
Schejtman
A
,
et al.
.
EROS/ CYBC1 mutations: Decreased NADPH oxidase function and chronic granulomatous disease.
.
J Allergy Clin Immunol.
.
2019;
;
143
:
:782.
–
85.e1
.
3.
DeLeo
FR
,
Burritt
JB
,
Yu
L
,
et al.
.
Processing and maturation of flavocytochrome b558 include incorporation of heme as a prerequisite for heterodimer assembly.
.
J Biol Chem.
.
2000;
;
275
:
:13986.
–
93
.
4.
Randzavola
LO
,
Mortimer
PM
,
Garside
E
,
et al.
.
EROS is a selective chaperone regulating the phagocyte NADPH oxidase and purinergic signalling.
.
Elife.
.
2022;
;
11
:
:e76387.
.
5.
Puschnik
AS
,
Marceau
CD
,
Ooi
YS
,
et al.
.
A Small-Molecule Oligosaccharyltransferase Inhibitor with Pan-flaviviral Activity.
.
Cell Rep.
.
2017;
;
21
:
:3032.
–
39
.
6.
Dixon
AS
,
Schwinn
MK
,
Hall
MP
,
et al.
.
NanoLuc Complementation Reporter Optimized for Accurate Measurement of Protein Interactions in Cells.
.
ACS Chem Biol.
.
2016;
;
11
:
:400.
–
8
.
7.
Groslambert
M
,
Py
BF.
NLRP3, un inflammasome sous contrôle. Regulation of the NLRP3 inflammasome.
.
Med Sci (Paris)
.
2018;
;
34
:
:47.
–
53
.
8.
To
EE
,
Vlahos
R
,
Luong
R
,
et al.
.
Endosomal NOX2 oxidase exacerbates virus pathogenicity and is a target for antiviral therapy.
.
Nat Commun.
.
2017;
;
8
:
:69.
.
9.
Rosli
S
,
Kirby
FJ
,
Lawlor
KE
,
et al.
.
Repurposing drugs targeting the P2X7 receptor to limit hyperinflammation and disease during influenza virus infection.
.
Br J Pharmacol.
.
2019;
;
176
:
:3834.
–
44
.
10.
Miesch
J
,
Segoviano
Vilchis I
,
Dupré
S.
NOX2, un acteur versatile de la réponse immunitaire, complice de l’infection par le virus de la grippe.
.
Med Sci (Paris)
.
2018;
;
34
:
:615.
–
7
.
|